采后保鲜与贮藏岗位
袁一林 岳红 王良睿 李宇轩 郑璞帆 陈婷 苗云刚 李晓雪 谭丽平
摘要:ABA响应元件结合因子(ABRE binding factor, ABF)是bZIP转录因子的一个重要亚家族,在脱落酸(abscisic acid, ABA)依赖型和非依赖型信号通路中发挥关键作用。鉴定阳光玫瑰葡萄VvABF家族并探究其进化、功能及其在采后二氧化氯(Chlorine dioxide, ClO2)处理下的表达模式,有助于为研究该家族在二氧化氯提高采后果实品质机制中的作用提供依据。通过生物信息学方法,从阳光玫瑰葡萄转录组测序数据鉴定VvABF家族成员,对其进行生物信息学分析,并结合qRT-PCR分析其在不同贮藏天数和不同二氧化氯浓度处理下的表达模式。阳光玫瑰葡萄VvABF家族共有13个家族成员,可分为3个亚家族,每个成员含有3到6个外显子,在10条染色体均有分布,共4对基因存在共线性关系。VvVTH家族蛋白均为亲水蛋白且均不稳定,整个VvYTH家族共有7个保守基序和6个保守结构域超家族,可能与非特异性丝氨酸/苏氨酸蛋白激酶如D7TPP4_VITVI等相互作用。此外,发现8 g/kg二氧化氯处理下VvABF2、VvABF4、VvABF9和VvABF13表达量显著提高。推测二氧化氯可能通过提高VvABF2、VvABF4、VvABF9和VvABF13基因表达量以增强超氧化物歧化酶和过氧化氢酶等抗氧化酶活性来减少活性氧引起的采后阳光玫瑰葡萄果实褐变与衰老。
关键词:阳光玫瑰葡萄;VvABF基因家族;ClO2保鲜处理;采后贮藏品质;转录组测序;生物信息学分析
阳光玫瑰葡萄(Vitis labruscana × Vitis vinifera 'Shine Muscat')是一种经种间葡萄杂交育成的优良鲜食葡萄品种,在日本被广泛种植,具有极高的经济价值[1]。由于其颗粒饱满、糖分含量高、有特殊的玫瑰香气及较强的耐贮性等特点,被世界上很多国家引种栽培,深受消费者喜爱[2]。但是,其采后储存期间易受病原菌侵染和氧化应激影响,导致腐败、褐变和品质下降,造成不可估量的经济损失[3, 4]。
二氧化氯(chlorine dioxide, ClO2)作为一种高效且温和的食品保鲜剂,具有良好的杀菌作用并可维持采后果实品质,已经被广泛应用于果蔬保鲜领域[5]。ClO2可以提高果实的抗氧化能力,以草莓(Fragaria vesca)为例,在草莓中,ClO2联合1-甲基环丙烯(1-methylcyclopropene, 1-MCP)处理可将超氧化物歧化酶(superoxide dismutase, SOD)活性提高至约192.6 U/g,同时显著抑制多酚氧化酶(polyphenol oxidase,PPO)活性,减少酚类氧化与褐变[6]。类似效果也可在荔枝(Litchi chinensis Sonn.)中观察到,ClO2能够较好抑制贮藏期间PPO活性上升,显著降低采后果实腐烂和果皮褐变[7]。然而,现有关于ClO2抗氧化的分子机制研究,尤其是脱落酸(abscisic acid, ABA)信号通路相关的研究仍较有限。
脱落酸作为一种重要的植物激素,在植物应对逆境胁迫过程中起着核心调控作用,同时也是果实成熟、衰老与应激反应的关键激素,ABA可以提升SOD和过氧化氢酶(Catalase, CAT)活性,增强活性氧(reactive oxygen species, ROS)清除能力,缓解果实氧化应激,有助于抑制褐变和软化[8, 9, 10]。ABA 响应元件结合因子(ABF)是一类转录因子,是属于碱性亮氨酸拉链(bZIP)转录因子家族的一个亚家族,能够特异性地识别和结合ABA响应元件(ABRE),从而调控下游逆境响应基因的表达,在植物响应ABA信号、逆境胁迫应答及果实采后成熟软化过程中起着不可替代的作用[8, 11]。
近来随着高通量测序技术和生物信息学分析手段的发展,植物基因家族的研究方面取得了显著进展,通过全基因组分析可对整个基因家族的结构,功能与进化进行系统的研究[12]。ABF基因家族方面,在拟南芥(Arabidopsis thaliana)、长蒴黄麻(Corchorus olitorius)、豌豆(Pisum sativum)等多种植物中均存在相关的ABF基因研究[11, 13, 14]。通过对这些植物ABF基因家族的研究,ABF基因在ABA信号转导途径及抗氧化调节中发挥的作用已初步探明。然而,关于阳光玫瑰葡萄VvABF基因家族的研究却相对较少,目前尚缺乏对其全面而系统的分析。
本研究以本实验室前期对阳光玫瑰葡萄转录组测序结果为依据,基于VvABF家族基因信息进行了系统的生物信息学分析及表达模式研究,解析了其基因家族的结构特性、进化关系及采后抗氧化调节功能,并为进一步探索阳光玫瑰葡萄的抗逆分子机制及相关的果蔬保鲜研究奠定了基础。
1 材料和方法
1.1 试验材料
试验所用阳光玫瑰葡萄于2023年9月下旬采自天津市津润果蔬种植专业合作社,运回国家农产品保鲜工程技术研究中心(天津)后,经过0±1 ℃预冷24 h,挑选出成熟度一致且无机械损伤的葡萄样本,分装入微孔膜中以进行后续试验。
1.2 阳光玫瑰葡萄转录组测序
选择贮藏0天及贮藏72天的样品进行RNA-seq测定(上海美吉生物有限公司)。将0天对照组记为CK-0d,72天对照组记为CK-72d,72天2 g/kgClO2处理组记为T3-72d,72天8 g/kgClO2处理组记为T5-72d。每个样品均设置3个生物学重复。
1.3 阳光玫瑰葡萄VvABF家族成员鉴定和系统进化分析
从Plam(https://pfam.xfam.org/)下载ABF保守结构域的hmm文件(编号PF00170),利用隐马尔可夫模型(Hidden Markov Model,HMM)在阳光玫瑰葡萄转录组数据检索ABF家族蛋白,之后从拟南芥基因组数据库 TAIR(https://www. arabidopsis. org/)中下载9个AtABF蛋白序列[15]作为搜索序列,利用Blast从阳光玫瑰葡萄转录组数据检索ABF家族蛋白(identity>40 %,E-value<1e-20),对两次检索结果取交集。
从文献报道中获取草莓的6个FvABF蛋白序列[16]和番茄(Solanum lycopersicum)的10个SlABF蛋白序列[17],与先前得到的拟南芥AtABF家族蛋白序列和阳光玫瑰葡萄VvABF家族蛋白序列一起通过MEGA12软件进行多序列比对,并用邻接法(neighbor-joining,NJ)构建系统发育树,之后通过在线工具iTOL(https://itol.embl.de/)进行美化。
1.4 阳光玫瑰葡萄VvABF家族蛋白理化性质分析
通过使用在线工具Multiple Protein Profiler(https://mproteinprofiler.microbiologyandimmunology.dal.ca/protein_profiler/prot_char/)分析阳光玫瑰葡萄VvABF家族蛋白的氨基酸数量(Number of amino acids)、分子量(Molecular Weight)、等电点(Isoelectric Point)、亲水性平均系数(GRAVY)、脂肪族指数(Aliphatic Index)及不稳定指数(Instability Index)共6个理化性质[18]。
1.5 阳光玫瑰葡萄VvABF家族基因结构及染色体定位分析
从NCBI(https://www.ncbi.nlm.nih.gov/)上获取物种参考基因组文件及gtf注释文件,使用TBtools中“Gene Structure View”工具分析阳光葡萄VvABF基因家族成员的编码区/非编码区(CDS/UTR)以明晰其基因结构。通过TBtools中“Gene Location Visualize from GTF/GFF”工具绘制染色体定位图,并加入基因密度显示。
1.6 阳光玫瑰葡萄VvABF家族保守结构域和基序分析
使用在线网站MEME(http://meme-suite.org/memei)分析阳光玫瑰葡萄VvABF蛋白的保守基序[19],以E-value<1e-5为界限进行筛选。使用在线工具Batch CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析其保守结构域,获得hitdata文件,并与上面获得的保守基序通过TBtools中“Gene Structure View”工具共同展示。
1.7 阳光玫瑰葡萄VvABF家族共线性分析和GO富集
通过TBtools中“One Step MCScanX”工具进行阳光葡萄物种内共线性分析,得到共线性文件后使用TBtools中“Advanced Circos”工具进行可视化,并对其中的VvABF家族基因进行标注。使用美吉生物云平台(https://cloud.majorbio.com/)对阳光玫瑰葡萄VvABF家族进行GO功能富集并进行可视化。
1.8 阳光玫瑰葡萄VvABF家族的蛋白互作分析和基于转录组数据的表达模式分析
利用在线工具String(https://cn.string-db.org/)对阳光玫瑰葡萄VvABF家族蛋白序列进行分析,预测其蛋白互作网络。使用美吉生物云平台(https://cloud.majorbio.com/)对阳光玫瑰葡萄VvABF家族基因在不同贮藏天数和不同浓度ClO2处理下(0 d,0 g/kg;72 d,0 g/kg;72 d,2 g/kg;72 d,8 g/kg)的表达量进行表达模式聚类和分析。
1.9 阳光玫瑰葡萄VvABF家族荧光定量PCR分析
采用Primer Premier 6.0软件设计VvABF基因家族qRT-PCR引物序列(表1),使用QuantStudio TM 1 Plus PCR仪进行荧光定量。用TaKaRa TB GreenⓇ EX TaqTM Ⅱ预混试剂(含耐热性RNaseH)进行qRT-PCR。实验的反应体系设为20 μL:cDNA 2.0 μL,TB Green 10 μL,ddH2O 6 μL,上下引物均为1 μL。采用两步法PCR反应程序:设置40个循环,95 ℃ 30 s预变性阶段;PCR反应阶段设置为95 ℃ 5 s和60 ℃ 30 s。试验设置4组平行实验。以VvActin-101为内参基因,使用2-ΔΔCt法计算VvABF基因相对表达量。
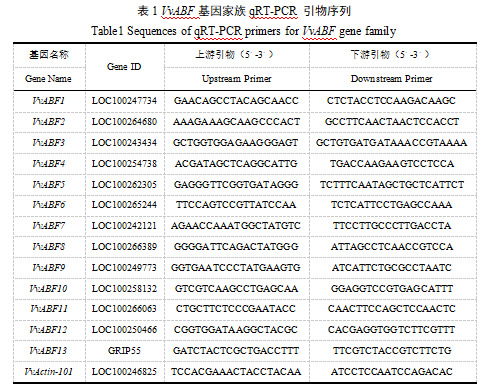
2 结果与分析
2.1 阳光玫瑰葡萄VvABF家族成员鉴定和系统进化分析
ABF基因家族是bZIP家族的亚族,拥有bZIP家族的保守结构域,首先使用隐马尔可夫模型(Hidden Markov Model,HMM)对bZIP保守结构域进行检索,初步筛选出58个候选成员。之后在这58个候选成员中使用模式生物拟南芥的九个AtABF蛋白序列作为搜索序列,利用Blast检索出13个ABF家族成员作为最终筛选结果,分别命名为VvABF1-VvABF13。
为探究阳光玫瑰葡萄与其他物种ABF家族基因的进化关系,对阳光玫瑰葡萄(Vitis labruscana × Vitis vinifera 'Shine Muscat'),拟南芥(Arabidopsis thaliana),草莓(Fragaria vesca)和番茄(Solanum lycopersicum)共4个物种38个ABF基因的氨基酸序列进行多重比对并基于此构建系统发育树(图1)。依据系统发育分析可将ABF家族分为三个亚家族,分别命名为Group Ⅰ、Group Ⅱ和Group Ⅲ。Group Ⅰ中全部为VvABF家族成员,共有5个;Group Ⅱ中包含6个VvABF,6个SlABF,4个AtABF和4个FvABF;Group Ⅲ中包含2个VvABF,4个SlABF,5个AtABF和2个FvABF。可以观察到VvABF2、VvABF6、VvABF9、VvABF10与VvABF11相对于其他物种进化关系较为独立;VvABF1、VvABF4、VvABF5和VvABF13与番茄ABF家族进化关系较近;VvABF3、VvABF8和VvABF12与拟南芥ABF家族进化关系较近。
2.2 阳光玫瑰葡萄VvABF家族蛋白理化性质分析
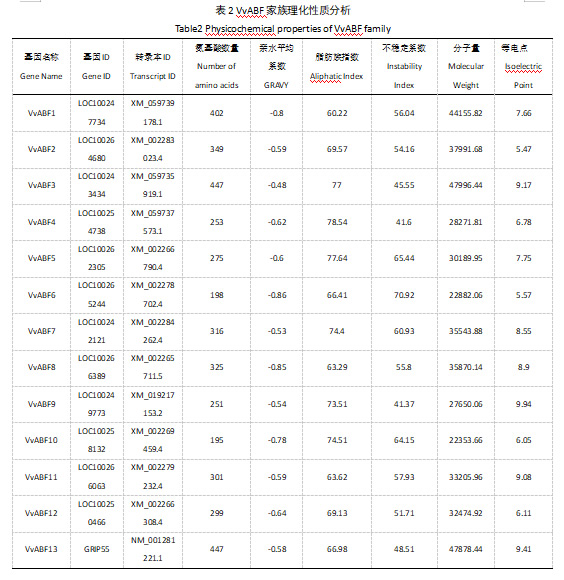
对13个VvABF蛋白进行理化性质分析,所得到的九个理化性质见表1。其序列长度最长为447个残基,最短最短为195个残基,平均残基个数为312。VvABF2、VvABF4、VvABF6、VvABF10和VvABF12等电点小于7,呈酸性,而其余VvABF等电点均大于7。所有蛋白的亲水性平均系数(grand average of hydropathicity,GRAVY)均小于0,表明其均为亲水蛋白。同时,可以观察到所有蛋白稳定性均较差,不稳定指数(Instability Index)均在40以上。
2.3 阳光玫瑰葡萄VvABF家族基因结构及染色体定位分析
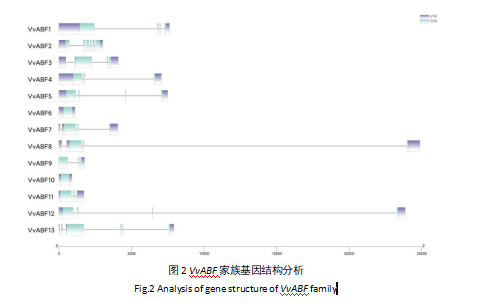
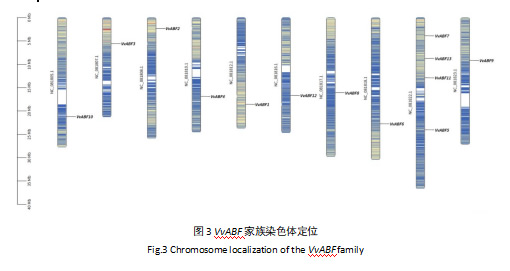
阳光玫瑰葡萄VvABF基因家族13个VvABF基因中,除VvABF6和VvABF10之外,其余均有内含子(图2)。除VvABF6和VvABF10之外,其他家族成员基因外显子数目在3到6个之间,其中VvABF2最多,共有6个外显子。
VvABF家族基因染色体定位图显示在染色体上分布较为均匀(图3),10条染色体上均有分布,但除NC_081822.1之外的九条染色体上均只有一个VvABF家族基因,而NC_081822.1染色体是VvABF家族基因分布最多的染色体,共有4个基因。
2.4 阳光玫瑰葡萄VvABF家族保守结构域和基序分析
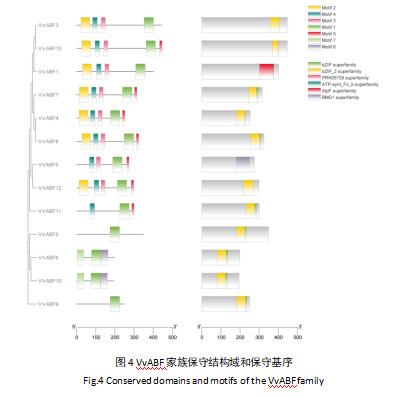
通过在线工具MEME的分析,结果显示,在阳光玫瑰葡萄VvABF家族共鉴定到7个保守基序(Motif1-Motif7)(图4)。其中,Motif 1高度保守,存在于所有VvABF家族序列中。同时可以看出,亲缘关系相近的家族成员拥有相近的保守基序,如VvABF6和VvABF10,VvABF4、VvABF7和VvABF8。这表示VvABF家族是高度保守的家族。
对VvABF家族成员蛋白序列的保守结构域的鉴定显示,除bZIP保守结构域超家族外,还有其他保守结构域超家族存在,共鉴定到6个保守结构域超家族。
2.5 阳光玫瑰葡萄VvABF家族共线性分析和GO富集
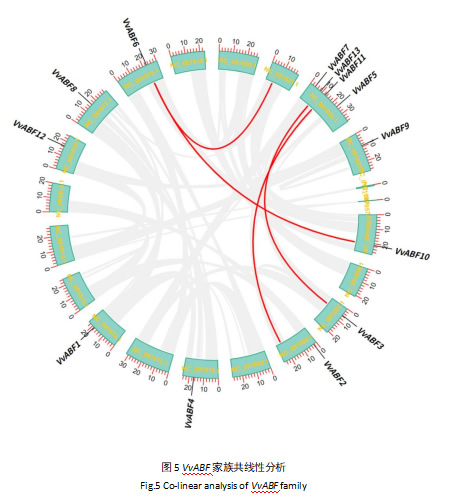
基因的复制为新基因的产生提供基础,促进新基因和新的功能产生[20]。前期研究发现,基因的串联重复(tandem duplication)、片段复制(segmental duplication)、易位事件(transposition events)是进化的三种主要模式。其中片段复制和基因的串联重复是基因家族产生并且拓展产生的主要原因[21]。从共线性分析的结果可以得知VvABF家族共有4对基因存在共线性关系,表明它们参与了染色体片段复制事件。这为阳光玫瑰葡萄的生物学进化奠定了重要的生物学基础。
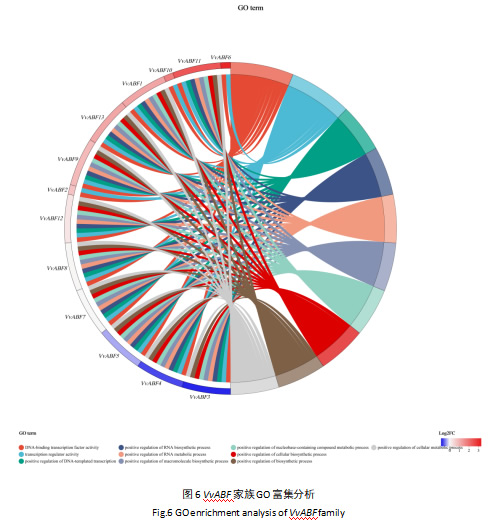
为探究VvABF基因家族在阳光玫瑰葡萄生物体中发挥的作用,对VvABF基因家族13个家族成员进行GO富集分析(图6),结果表明,其主要富集于DNA结合转录因子活性、转录调节因子活性、DNA模板转录的正向调控、RNA生物合成过程的正向调控、RNA代谢过程的正向调控、大分子生物合成过程的正向调控等功能,与前人对植物ABF家族的研究相符[11]。
2.6 阳光玫瑰葡萄VvABF基因家族的蛋白互作分析和基于转录组数据的表达模式分析
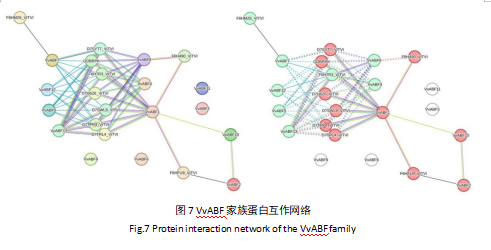
蛋白互作分析结果表明,在互作网络中的VvABF蛋白可以聚类为两类(图7)。其中,VvABF10与VvABF1、VvABF2存在相互作用。VvABF1、VvABF4、VvABF5、VvABF7、VvABF8、VvABF12和VvABF13均可与非特异性丝氨酸/苏氨酸蛋白激酶如D7TPP4_VITVI、D7U6Z6_VITVI和F6H7R3_VITVI等相互作用,推测VvABF家族蛋白可能通过与其他蛋白级联在植物ABA信号通路中发挥重要作用。
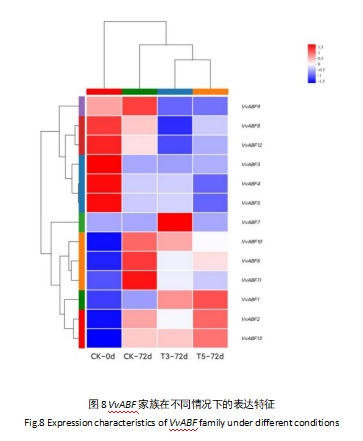
通过分析对照组在第0天与第72天,以及2 g/kg和8 g/kgClO2处理组在第72天的转录组数据,对其进行聚类(图8),其表达模式共可分为表达量随时间上升/下降两个大类,以及其中7个子聚类。这表明VvABF基因家族具有多种不同表达模式。其中VvABF3、VvABF4、VvABF5、VvABF8和VvABF12贮藏第72天时相比贮藏0天时上调,VvABF1、VvABF2、VvABF6、VvABF9、VvABF10、VvABF11和VvABF13贮藏第72天时相比贮藏0天时下调。此外,VvABF1、VvABF2、VvABF3和VvABF13都出现了在T5-72d处理下表达量相较于CK-72d和T3-72d均上调的现象。
2.7 阳光玫瑰葡萄VvABF基因家族表达量分析
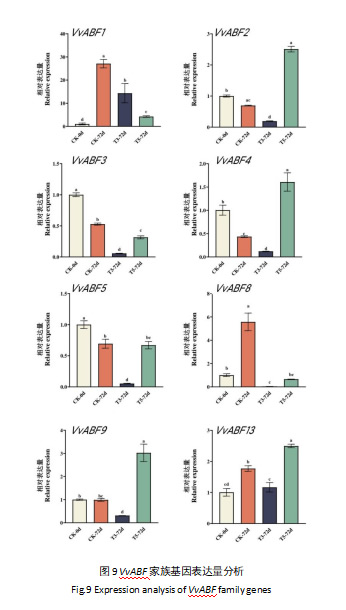
为探究阳光玫瑰中13个VvABF基因在不同浓度ClO2处理下表达量变化情况,采用qRT-PCR对其基因表达水平进行相对定量检测(图9)。由于VvABF基因家族中VvABF6、VvABF7、VvABF10、VvABF11以及VvABF12的基因表达量极低,因此未进行进一步的分析。结果表明,VvABF1、VvABF8和VvABF13在贮藏第72天时相比贮藏0天时显著上调,而VvABF2、VvABF3、VvABF4和VvABF5在贮藏第72天时相比贮藏0天时显著下调。用8 g/kg浓度的ClO2处理能大幅度提高贮藏第72天时VvABF2、VvABF4、VvABF9和VvABF13的基因表达量,分别是对照组(CK-72d)的3.61、3.69、3.05以及1.41倍。同时,ClO2处理降低了贮藏第72天时VvABF1、VvABF3和VvABF8的基因表达量,分别为对照组(CK-72d)的6.38、1.67和8.45倍。
3 结论与讨论
转录因子能够调控基因表达,在植物的发育、成熟和激素信号转导等各个方面发挥着重要的调节作用[22, 23]。bZIP家族作为植物中最大的转录因子家族之一,其家族成员在植物生长、发育、成熟、衰老和应对氧化应激等方面发挥着极其重要的作用[8, 23]。ABF为bZIP家族A组成员,参与植物ABA信号转导,果实成熟衰老和调控逆境胁迫响应[8, 11]。已有研究指出,某些ABF基因过表达可以增加内源ABA含量,以及提高植物体内SOD和CAT等抗氧化酶活性,增强清除ROS的能力,提升植物抗氧化性[24],但将其与采后ClO2保鲜处理关联的研究尚在起步阶段。本文利用阳光玫瑰葡萄转录组数据,对阳光玫瑰葡萄 VvABF 家族进行了全面的生物信息学分析,并结合实时qRT-PCR 技术检测了其在采后经由不同浓度ClO2处理72天的表达模式,获得了一系列有价值的结果。
在本研究中,从阳光玫瑰葡萄转录组中成功鉴定出13个VvABF家族成员。通过构建系统发育树,发现阳光玫瑰葡萄VvABF家族成员与其他物种的ABF成员在进化上具有一定的同源性(图1)。部分VvABF成员与番茄或拟南芥的ABF成员亲缘关系相近,表明它们在进化过程中有类似的功能及可能相同的起源,这与对枣的ZjABF家族研究结论一致[25, 26]。另有部分阳光玫瑰葡萄VvABF成员相对独立分群,这暗示在阳光玫瑰葡萄的进化过程中它们可能已经发生了特异性的分化,并获得了独特的功能。从蛋白理化性质分析可知(表2),所有鉴定到的VvABF蛋白均为亲水蛋白且稳定性较差,其性质与枣(Ziziphus jujuba Mill.),甜菜(Beta vulagris)等其它植物鉴定得到的ABF蛋白性质高度相似[23, 25]。这种亲水性和不稳定性可能与ABF蛋白在细胞内的定位和功能密切相关,同时亲水特性有助于它们在细胞质和细胞核之间进行穿梭,从而更好地参与 ABA 信号转导途径以及调控下游基因的表达[27]。
内含子在基因表达调控中具有重要作用,其可以通过影响mRNA的剪接、稳定性以及转录效率等方式,对基因的表达进行精细调控[28]。基因结构分析显示(图2),除VvABF6和VvABF10之外的VvABF基因均含有内含子,且内含子的数量和位置在不同基因之间存在一定差异。VvABF基因内含子的多样性可能为其在不同组织和不同胁迫条件下的差异化表达提供了一种潜在的调控机制,这种结构上的差异可能与基因的功能分化以及对不同环境信号的响应有关[23]。染色体定位显示(图3),VvABF基因分布于阳光玫瑰葡萄的所有染色体上,分布较为均匀,这一分布特点与番茄等其他植物基因家族的染色体定位情况类似,推测其在进化过程中可能通过随机分布的方式,避免了因基因簇集而导致的功能冗余或基因间的相互干扰,有助于植物应对不同环境选择压力[17]。基因复制可促使基因家族扩大及获得新功能,在基因复制的过程中原基因的突变积累可以使基因在进化过程中获得新的功能或者新的表达模式。共线性分析发现(图5),阳光玫瑰葡萄中有4对VvABF基因存在共线性关系,说明基因复制事件在VvABF家族的进化过程中发挥过重要作用。
GO富集分析结果表明(图6),VvABF基因主要富集于DNA结合转录因子活性、转录调节因子活性、DNA模板转录的正向调控等功能类别上,这与ABF基因家族在植物中的已知功能是一致的[29]。结合蛋白互作分析(图7),发现VvABF蛋白可聚类为两类,并与多种参与信号转导、转录调控等过程的蛋白存在相互作用,这进一步证实了VvABF基因在ABA信号通路以及植物生长发育调控网络中的重要地位。这与甜菜BvABF蛋白互作网络分析结果得出的结论类似,研究发现甜菜BvABF蛋白也与多种磷酸化相关蛋白及ABA受体相互作用,共同参与ABA信号转导和逆境胁迫响应过程[23]。
通过结合qRT-PCR分析了VvABF基因在不同浓度ClO2处理下的表达变化发现,VvABF基因在果实贮藏过程中表达量发生显著变化,尤其是在贮藏第72天时,VvABF1、VvABF8和VvABF13在贮藏第72天时相比贮藏0天时显著上调,而VvABF2、VvABF3、VvABF4和VvABF5在贮藏第72天时相比贮藏0天时显著下调,这暗示这些基因可能作为脱落酸激素响应元件的结合蛋白,通过激活ABA信号途径参与了果实的成熟、衰老和抗氧化调控过程[30, 31, 32]。在拟南芥和番茄等的研究中已发现部分ABF基因过表达可以提高植物体内SOD和CAT等抗氧化酶活性,增强清除ROS的能力[24, 33],而ClO2处理对VvABF基因的表达量产生了显著影响,在8 g/kg浓度的ClO2处理下,VvABF2、VvABF4、VvABF9和VvABF13的基因表达量大幅度提高,暗示这些基因可能在ClO2提高采后阳光玫瑰葡萄抗氧化能力的生物机制中处于关键位置。增加这些基因的表达量从而提升采后阳光玫瑰葡萄果实的ROS清除能力,可能是ClO2缓解ROS 引发的阳光玫瑰葡萄果实褐变与衰老的途径之一。然而ClO2提升这些VvABF基因表达量的具体机制仍有待研究。未来可进一步发掘VvABF基因家族在阳光玫瑰葡萄植物体内的其他功能,也为进一步研究和提升ClO2对果蔬的保鲜能力提供依据和支持。
综上所述,本研究从阳光玫瑰葡萄转录组数据中鉴定出13个VvABF家族成员,分为3个亚家族,每个成员含有3到6个外显子,在10条染色体均有分布,家族成员中共4对基因存在共线性关系。其蛋白稳定性均较差且均为亲水蛋白,共有7个保守基序和6个保守结构域超家族,可能与非特异性丝氨酸/苏氨酸蛋白激酶如D7TPP4_VITVI等相互作用。此外,发现8 g/kg的ClO2处理下VvABF2、VvABF4、VvABF9和VvABF13表达量显著提高。推测ClO2可能通过提高VvABF2、VvABF4、VvABF9和VvABF13基因表达量以增强SOD和CAT等抗氧化酶活性来减少活性氧引起的果实褐变与衰老,为未来进一步研究和开发VvABF基因家族在ClO2提高采后果实品质机制中的作用提供依据。