病毒病防控岗位
范旭东 董雅凤 高颉
葡萄蚕豆萎蔫病毒(grapevine fabavirus,GFabV)于2017年在中国首次报道,在我国葡萄上的检出率达19.1%(55/288),在表现明显症状的葡萄中的检出率为48.1%(22/52)。研究表明GFabV可引起贝达(Beta)产生严重的叶片褪绿、畸形症状。通过小RNA测序和PCR检测,结果显示GFabV在发病的‘阳光玫瑰’样品中的检出率高达88.2%,初步表明了GFabV与我国阳光玫瑰葡萄病毒病的发生相关。针对GFabV的危害性,有必要开发一种适合田间快速筛查且不依赖贵重仪器的检测方法,本研究基于逆转录环介导等温扩增技术(RT-LAMP)与CRISPR/Cas12a系统,开发了一种高效检测葡萄蚕豆萎蔫病毒的RT-LAMP-CRISPR/Cas12a可视化检测方法。
1 研究方法
1.1 实验材料
本实验所用样品种植在辽宁省兴城市中国农业科学院果树研究所国家落叶果树脱毒中心毒源保存圃。
1.2 RT-LAMP引物、crRNA和荧光探针设计合成
基于GenBank中GFabV分离株的保守核苷酸序列,采用NEB LAMP在线设计平台(https://lamp.neb.com)默认参数设计了6组LAMP引物。为简化实验流程,将每组引物混合配制成10×浓度引物母液,分别命名为LAMP primer set 1、LAMP primer set 2、LAMP primer set 3、LAMP primer set 4、LAMP primer set 5、LAMP primer set 6。10×引物母液中各引物浓度为: F3和B3引物各 2 μМ, FIP和BIP引物各16 μМ, LF和LB引物各4 μМ。针对CRISPR/Cas12a系统,使用Target Design在线工具(http://skl.scau.edu.cn/targetdesign)设计了靶向LAMP扩增区域的crRNA。所有LAMP引物、crRNA和ssDNA荧光探针均由生工生物工程(上海)股份有限公司合成。
1.3 RT-LAMP反应
实时荧光RT-LAMP反应体系:含5 μL WarmStart LAMP预混液(New England Biolabs,货号E1708S)、0.3 μL 50×荧光染料、1 μL 10×引物母液、2.7 μL无RNase双蒸水和1 μL RNA模板。反应程序设置为: 65 ℃ 30 s,随后进行40个循环的扩增反应,每个循环包括65 ℃ 15 s和65 ℃ 40 s两个步骤,每个循环结束后实时采集荧光信号。
比色法RT-LAMP检测反应体系:含5 μL WarmStart比色法LAMP 2×预混液(New England Biolabs,货号M1804S)、1 μL 10×引物母液、3 μL无RNase双蒸水和1 μL RNA模板。该反应在65 ℃恒温条件下进行45 min,通过反应液颜色变化判断检测结果。
1.4 不同GFabV变种检测效果测试
为评估建立的RT-LAMP技术对不同GFabV变种的检测适用性,本研究选取LN_BETA、TJ-Cas1和LN_XF1 3个GFabV变种的RNA作为模板,分别进行实时荧光RT-LAMP和比色法RT-LAMP检测。
1.5 RT-LAMP-CRISPR/Cas12a检测方法
在反应管底部加入LAMP反应体系(含5 μL WarmStart LAMP 2×预混液、1 μL 10×引物母液、3 μL无RNase双蒸水和1 μL RNA模板),在管盖内预装CRISPR/Cas12a反应体系(含0.5 μL 50 μM Cas12a蛋白、1 μL 25 μM crRNA(25 μM)、2 μL 10×NEBuffer™ r2.1缓冲液、0.5 μL 100 μM ssDNA探针和0.5 μL 40 U/μL重组RNase抑制剂)。反应程序设置为:首先65℃反应40 min完成LAMP扩增,经混匀离心后,37 ℃反应12 min激活CRISPR/Cas12a系统,切割ssDNA荧光探针,最终使用365 nm紫外手电筒进行结果读取。
1.6 RT-LAMP-CRISPR/Cas12a方法的特异性与灵敏度分析
使用携带其它多种病毒的葡萄RNA样品、GFabV阳性样品和阴性样品进行RT-LAMP-CRISPR/Cas12a反应,从而验证检测特异性;将GFabV阳性样品RNA按10倍梯度稀释,对稀释样品进行RT-PCR、实时荧光RT-LAMP和RT-LAMP-CRISPR/Cas12a反应,比较RT-LAMP-CRISPR/Cas12a方法与其它方法的检测灵敏度。
1.7 RT-LAMP-CRISPR/Cas12a方法检测田间样本
为评估RT-LAMP-CRISPR/Cas12a检测法的实用性能,本研究选取田间葡萄园采集的GFabV感染样本进行验证实验。所有样本均经PCR方法预先确认为阳性,包括7份叶片样本和7份枝条样本,用于评价该检测体系的田间适用性。
2 结果与分析
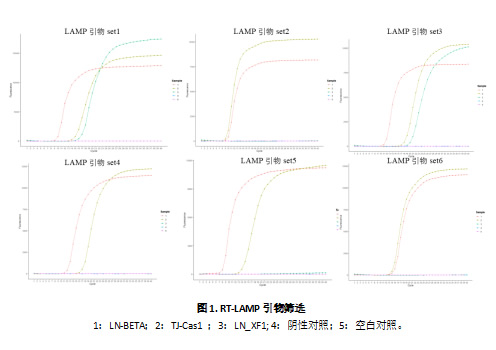
2.1 GFabV RT-LAMP引物的筛选
结果显示:引物组1和引物组3均能对3个GFabV变种进行有效检测。引物组2、4、5、6仅能检测出3个变种中的2个。经比较发现,引物组1比引物组合3能更快速启动LAMP扩增反应(图1a),因此选定引物组1作为最优引物组合用于后续实验。
2.2 RT-LAMP-CRISPR/Cas12a单管检测方法的建立
以3种GFabV变种(LN_XF1、LN_BETA和TJ-Cas1)的总RNA为模板,评估RT-LAMP-CRISPR/Cas12a方法的检测效率。结果表明,RT-LAMP-CRISPR/Cas12a检测方法能有效检出3个GFabV变种,且表现出较高的荧光信号和相对较低的背景荧光(图2)。

2.3 RT-LAMP-CRISPR/Cas12a方法的特异性与灵敏度检测
采用RT-LAMP-CRISPR/Cas12a方法对6份混合多种病毒的样本进行特异性测试,结果显示,仅GFabV阳性对照产生强荧光信号,表明该方法具有较好的特异性。实时荧光RT-LAMP同样显示特异性扩增曲线。采用10倍梯度稀释(10-1至10-8)的GFabV阳性样本RNA进行灵敏度测试,结果,RT-LAMP-CRISPR/Cas12a方法和实时荧光RT-LAMP均可检测至10-6稀释度的样本,而RT-PCR仅能检测到10-2稀释度。
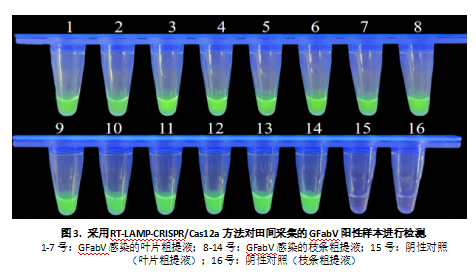
2.4 田间样本RT-LAMP-CRISPR/Cas12a检测
采用RT-LAMP-CRISPR/Cas12a方法对田间采集的GFabV阳性样本进行了检测,直接使用枝条和叶片的粗提液作为检测材料。检测结果显示,该方法对枝条和叶片粗提液的检出率均达到100%,表现出较好的检测效率。结果表面,本研究建立的RT-LAMP-CRISPR/Cas12a系统在GFabV田间检测中具有较好的可靠性。