鲜食葡萄品种改良岗位
1 材料与方法
1.1 材料
供试葡萄品种为‘瑞都红玉’,是北京市农林科学院林业果树研究所育成的红色早熟优新玫瑰香型鲜食葡萄品种。试验植株为露地栽培10年生自根苗,定植于北京市农林科学院林业果树研究所葡萄试验园内,单臂篱架水平龙干整形,株行距0.80 m×2 m,试验地土壤肥力中等,pH6.9。采用简易避雨、地表园艺地布覆盖、滴灌供水和常规病虫害等管理模式,生长期内修剪及肥水管理一致。
1.2 样品采集
于2022年对‘瑞都红玉’果实样品进行采集。依据往年物候期记载并结合果实表型,于6月26日开始取样,此时,果实并未开始转色,之后每4—5天取样一次,直至果实完全转色成熟,香气特征表现出来。根据采样时间和果实表型确定不同样品的转色天数(表1)。取样时,选取生长势基本一致的单株,每株随机选取3穗果实,每一穗从不同位置选取10—20个果实作为一个重复。样品采收后迅速转移到实验室,其中一部分果实样品取汁测定基本理化指标,一部分样品迅速剥离果皮,用以测定类黄酮和花色苷含量,剩余样品液氮速冻,-80 ℃保存,用于后续试验分析。
1.3 葡萄果皮总类黄酮和总花色苷含量的测定
参考WANG等方法提取和测定葡萄果皮总类黄酮,并略有修改。葡萄果皮样品经液氮研磨后准确称取1 g于50 mL离心管中,加入10 mL甲醇(含2% HCL),超声60 min,4 ℃ 12 000 r/min离心10 min,取上清备用。
总类黄酮测定:取上清液0.5 mL,加入0.25 mL 5%亚硝酸钠溶液,混匀,静置反应5 min。加入0.25 mL 10%六水合氯化铝溶液,混匀,反应6 min。加入2 mL 1 mol·L-1氢氧化钠溶液和2 mL去离子水,混匀,显色20 min,用紫外-可见分光光度计在510 nm处测定吸光值。以儿茶素为标品。
参考Boss等方法提取花色苷,并作少量修改,葡萄果皮样品经液氮研磨后准确称取1 g于10 mL离心管中。加入20 mL甲醇-HCI(90﹕10)溶液,超声破碎30 min,涡旋振荡混匀,4 ℃提取过夜。4 ℃ 12 000 r/min离心10 min,取上清液。用紫外-可见分光光度计在520 nm处测定吸光值。以矢车菊素-3-O-葡萄糖苷作为标准品,估算总花色苷含量。
1.4 单萜化合物提取和测定
参考孙磊等[23]方法提取和测定单萜化合物。取50 g葡萄果实,液氮保护下打碎去籽,分别加入1 g D-葡萄糖酸内酯和1 g聚乙烯基聚吡咯烷酮(polyvinylpolypyrrolidone,PVPP),打磨成粉末,室温静置浸提,4 ℃ 8 500 r/min离心10 min,得到澄清葡萄汁,用于游离态单萜测定,每个处理进行3次独立的提取。采用固相萃取柱(Cleanert PEP-SPE柱,天津博纳艾杰尔公司)提取糖苷结合态单萜化合物,依次进行固相萃取、洗脱和浓缩,然后重新溶解在10 mL 2 mol·L-1柠檬酸-磷酸盐缓冲溶液(pH5.0)中。用200 μL糖苷酶AR 2000(100 mg·L-1,在pH5.0的2 mol·L-1柠檬酸盐/磷酸盐缓冲液中)40 ℃酶解结合态挥发性化合物16 h。
单萜化合物的测定:取5 mL葡萄汁或者上述酶解产物分别加入1.0 g NaCl和10 µL 4-甲基-2-戊醇,40 ℃加热搅拌30 min后,用已活化或热解析过的聚二甲基硅氧烷/碳筛/二乙烯苯(PDMS/CAR/DVB)萃取头相同温度下吸附30 min,然后将萃取头插入气相色谱的进样口,250 ℃热解析8 min。试验所用气相色谱为安捷伦7890B,质谱为5977A(Agilent,USA),色谱柱为HP-INNOWAX(长60 m,内径0.25 mm,液膜厚度0.25 µL)。载气为高纯氦气,流速为1 mL·min-1。固相微萃取采用自动进样,不分流模式。质谱接口温度为280 ℃,离子源温度为230 ℃,电离方式EI,离子能量70 ev,质量扫描范围为20—350 u。
根据已有化合物标样的色谱保留时间和质谱信息,参照NIST 05标准谱库及相关文献对样品进行定性分析;利用已有的化合物制备标准曲线进行定量分析,没有标准品的物质利用化学结构、官能团相似、碳原子数相近标准品的标准曲线进行定量
1.5 RNA -Seq和加权基因共表达网络分析
使用分别在贮藏后0、15、30天收集的RDHY、RDXY和MGX葡萄进行RNA-Seq分析。总RNA提取和质量分析参考我们之前描述的方法进行(Wang et al., 2022)。使用Illumina his eq 2500基于Illumina标准程序构建了27个来自收集的样品的测序文库(每个时间点3个生物重复)并进行测序,该程序在Origingene公司(https://www.origin-gene.com/)。
生成的原始数据(原始读数)首先通过内部Perl脚本进行处理。通过从原始数据中去除包含接头的读数、包含poly-N的读数和低质量读数获得高质量数据。此外,计算数据的Q20、Q30、GC含量和序列重复水平。然后使用HISAT2(Kim et al., 2019)比对到参考基因组序列
(https://plants.ensembl.org/Vitis_vinifera/Info/Index)。基因表达水平的定量通过每百万个作图片段的每千个转录物碱基的片段来估计(FPKM,Trapnellet al., 2010)。利用EdgeR软件进行各组样本之间的DEGs分析(Robinson et al., 2010)。使用R包WGCNA模块(Langfelder & Horvath, 2008)进行自动网络构建功能。
1.6 RT-qPCR验证
为了验证转录组数据,使用SYBR qPCR Master Mix(天根生物有限公司)和CFX96实时PCR检测系统(Bio-Rad)进行了qRT-PCR分析。所有检测基因的引物均由来自NCBI的Primer-Blast(https://www.ncbi.nlm.nih.gov/tools/primerblast/)。两个VvGAPDH(CB975242)和VvUbiquitin(EC 929411)用作内参基因。
1.7 数据处理与统计分析
数据统计分析利用分析软件SPSS 13.0,采用Duncan 多重比较进行显著性方差分析,最低显著水平P<0.05;主成分分析和聚类分析采用MetaboAnalyst 4.0;绘图采用Excel 和Sigma Plot 10.0。
2 结果
2.1 葡萄转色过程中基本理化指标特征
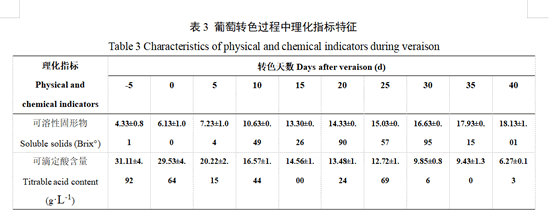
葡萄果实可溶性固形物含量及可滴定酸含量在一定程度上反映果实的成熟情况,由表3可见,随着转色天数的增加,‘瑞都红玉’果实中可溶性固形物含量逐渐增加,在转色30 d时达到(16.63±0.95) Brix°,此时,果实已达到生理成熟。在转色40 d时,可溶性固形物含量达到最大值,为(18.13±1.01) Brix°,然而,可滴定酸含量逐渐降低,在转色40 d时达到最低值,此时果实已经成熟。
2.2 葡萄果实转色过程中单萜类化合物含量变化
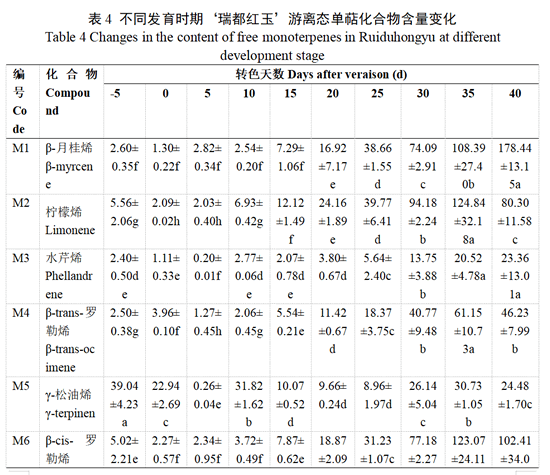
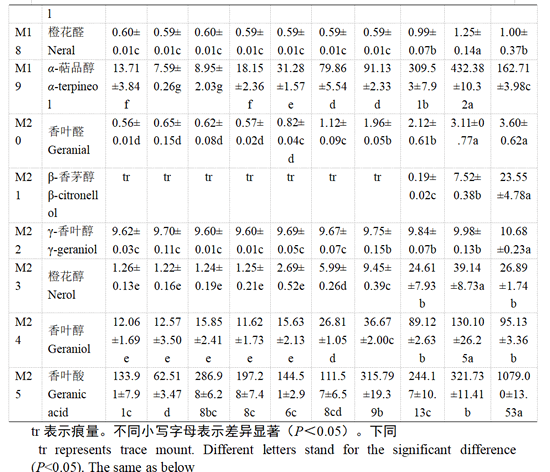
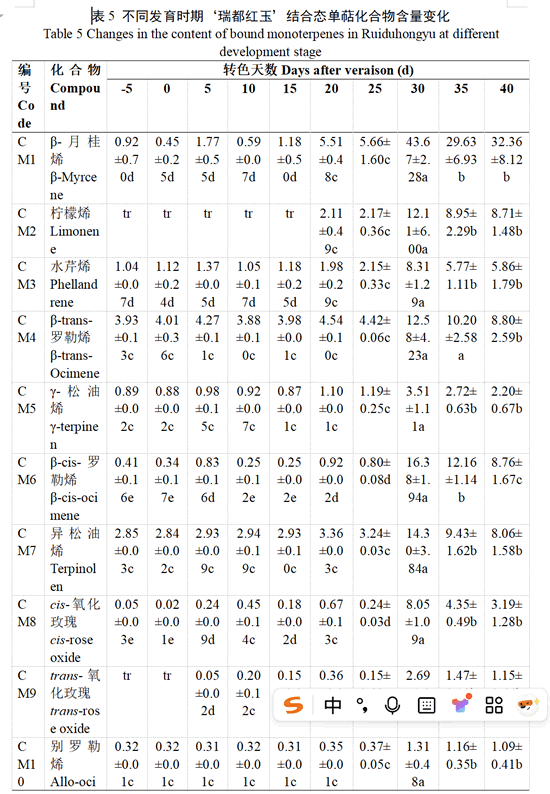
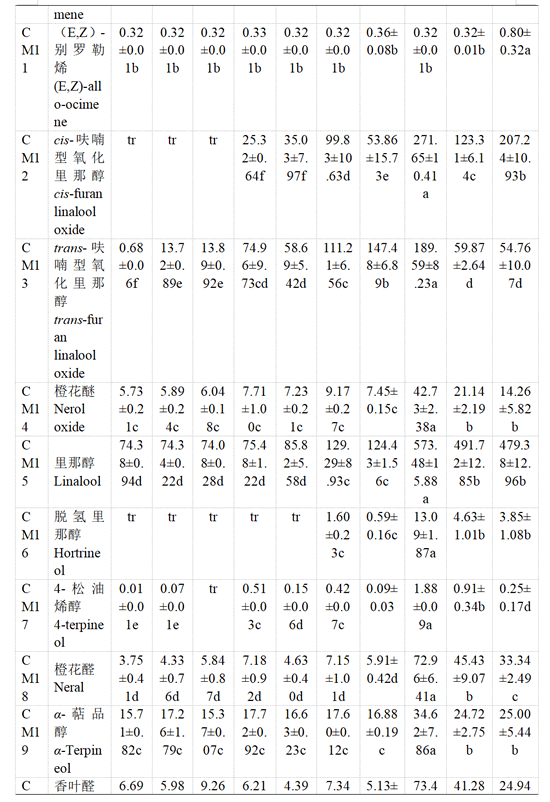
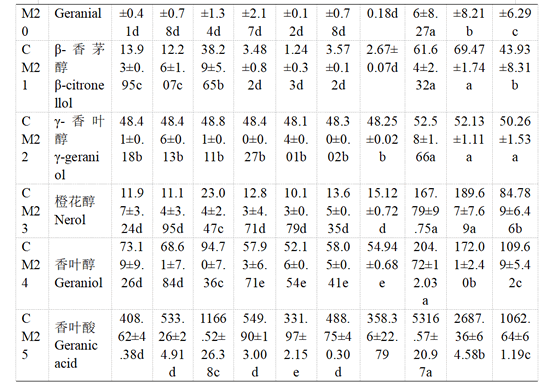
用HS-SPEME-GC-MS方法对‘瑞都红玉’果实中25种游离态和糖苷结合态单萜类化合物进行定性定量分析(表4—表5)。
在整个转色过程中,‘瑞都红玉’果实中主要游离态单萜成分存在波动(表4),在转色前和转色初期,脱氢里那醇、香叶酸、呋喃氧化里那醇和γ-松油烯等游离态单萜含量较高。转色开始后15 d,里那醇、α-萜品醇等单萜合成开始增加,转色开始后20 d,β-月桂烯、柠檬烯、脱氢里那醇、里那醇等大部分单萜合成开始增加。转色25 d后,各单萜成分含量持续增加,其中,含量较高的单萜化合物依次为里那醇、脱氢里那醇、呋喃型氧化里那醇、异油松烯和α-萜品醇等,香叶醇含量也显著升高。而在转色开始后30—35 d,‘瑞都红玉’果实转色已经完成(表1),果实进入始熟期,脱氢里那醇、异松油烯和α-萜品醇为除了里那醇以外含量较高的单萜化合物。到转色后40 d,果实已经成熟,主成分单萜主要有里那醇、脱氢里那醇、呋喃型氧化里那醇、β-月桂烯、α-萜品醇和香叶醇等。
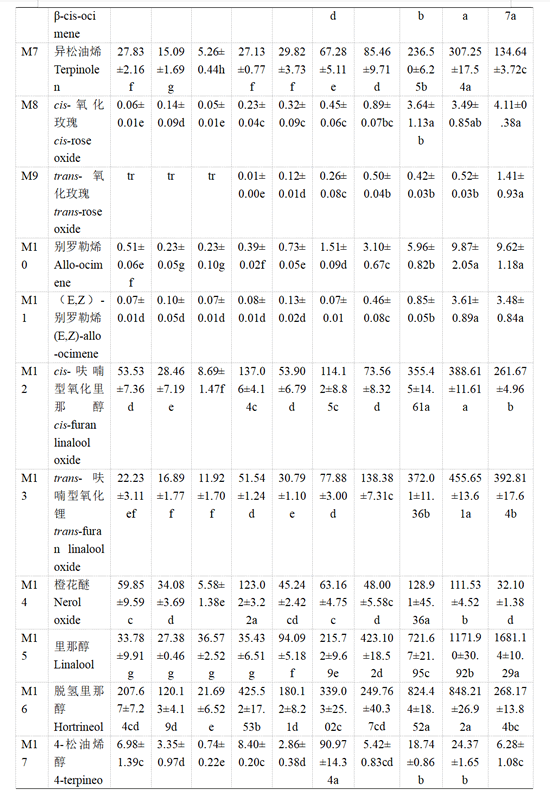
主要结合态单萜类化合物与游离态单萜略有不同,‘瑞都红玉’葡萄果实结合态单萜类化合物含量整体变化幅度小于游离态单萜(表5)。转色前直至转色开始后20 d,主要结合态单萜化合物为β-月桂烯、β-trans-罗勒烯、β-cis-罗勒烯、别罗勒烯、(E,Z)-别罗勒烯以及香叶酸等。转色开始30 d时,大部分结合态单萜化合物含量显著增加,里那醇、橙花醇、香叶醇以及香叶酸含量显著提升。转色开始35 d时,除橙花醇及β-香茅醇含量小幅增高,其余结合态单萜化合物含量小幅下降或没有显著变化。转色开始40 d时,β-月桂烯、水芹烯、(E,Z)-别罗勒烯、cis-呋喃型氧化里那醇和α-萜品醇的含量有增加趋势,β-香茅醇、橙花醇、香叶醇和香叶酸的含量略有下降,其他结合态单萜化合物含量呈小幅下降趋势。
为了更好地挖掘转色过程中单萜化合物的变化规律,分别对25种游离态和结合态单萜含量进行聚类分析(图1)。结果显示,大多数游离态单萜含量在转色前和转色初期处于较低水平,在转色开始后20 d开始增加,随着果实成熟,含量逐渐增加。但是不同游离态单萜积累模式略有不同,主要有3种不同类型(图1-A),第一类包括β-月桂烯(M1)、trans-氧化玫瑰(M9)、(E,Z)-别罗勒烯(M11)、里那醇(M15)、香叶醛(M20)、β-香茅醇(M21)、γ-香叶醇(M22)和香叶酸(M25)等化合物,这一类单萜含量在转色开始15 d开始显著增加,随着转色过程推进,含量逐渐积累,前期积累缓慢,后期迅速积累至转色后40 d含量达到最高水平。第二类单萜化合物包含了柠檬烯、水芹烯、β-trans-罗勒烯等在内13个单萜成分,这类单萜也是在转色开始后15—20 d开始合成增加,转色30 d迅速积累,转色35 d含量达到最高水平,转色后40 d含量略有下降。第三类化合物包括γ-松油烯(M5)、橙花醚(M14)、脱氢里那醇(M16)和4-松油烯醇(M17)等单萜化合物,这类化合物在转色期内含量变化经历波动,存在不止一次变化,基本在转色期30—35 d时含量达到最高值。
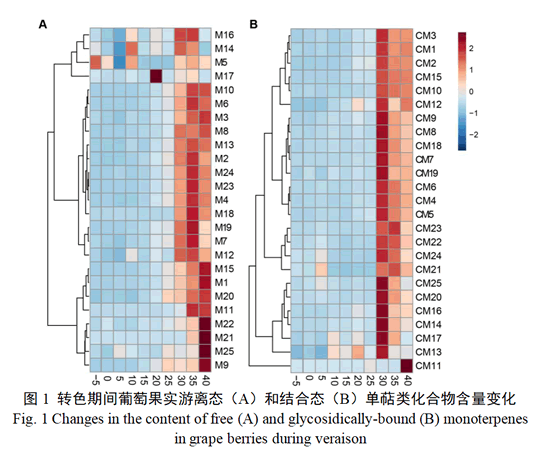
‘瑞都红玉’果实中大部分结合态单萜含量变化趋势表现为先增加后减少(图1-B),大部分结合态单萜化合物在转色30 d含量显著增加并达到最高值,之后含量减少。只有 (E,Z)-别罗勒烯(CM11)含量在转色30 d时没有显著地增高。结合态单萜化合物β-香茅醇(CM21)和橙花醇(CM23)的含量在转色35 d含量达到最高值。
2.3 葡萄果实转色过程中总单萜、总类黄酮和花色苷类化合物含量变化
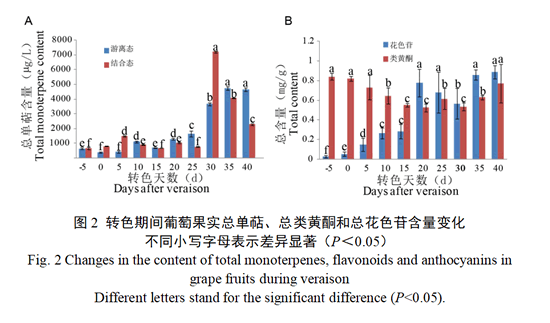
为了进一步监测单萜与花色苷合成关系,对总游离态和结合态单萜含量变化趋势进行分析(图2-A)。结果显示,总游离态单萜含量在转色初期含量较低,在转色开始20 d之后总游离态单萜含量显著增加,直至转色过程完成。总结合态单萜含量与游离态单萜积累模式相似,也是在转色后期开始大量合成积累,但是落后于游离态单萜合成,在转色开始后30 d合成显著增加,之后总含量呈下降趋势。
通过对‘瑞都红玉’果皮类黄酮类物质含量进行测定(图2-B),结果显示,总类黄酮含量在转色开始前已经开始大量积累(0.84 mg·g-1),之后,随着转色过程推进呈下降趋势,直至转色25 d随着花色苷的大量合成,含量又逐渐升高。而在转色期内‘瑞都红玉’果皮花色苷含量,随着果实转色过程,含量逐渐增加,在转色开始后20 d时迅速合成达到0.78 mg·g-1,之后,含量略有波动,至转色40 d达到最高值(0.89 mg·g-1)。
2.4 葡萄果实转色过程转录组水平变化
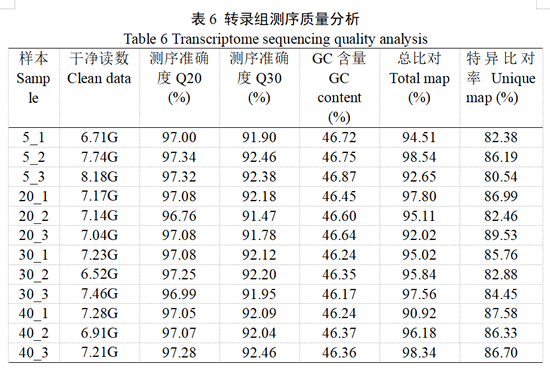
依据化合物分析结果,对4个时期12个果实样品进行cDNA文库构建并测序,经过滤,共获得86.61 Gb clean data,各样品clean data均在6.52 Gb以上(表6)。Q20均大于96%,Q30均大于91%。4个时期的clean data与参考基因组的特异比对率超过80%。测序数据质量较高,可以用于后续分析。
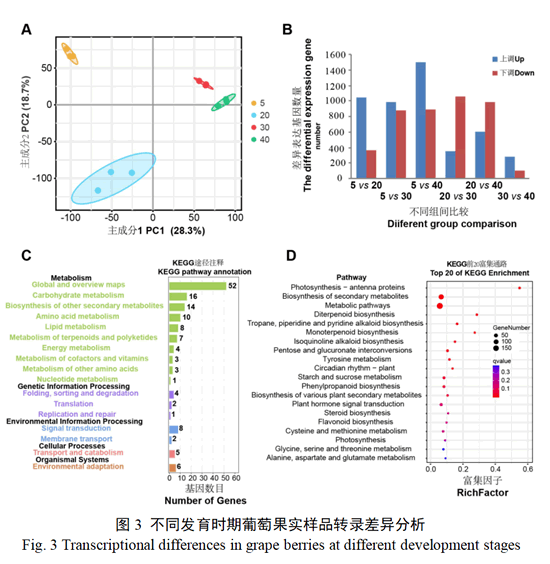
基于转录组数据,进行主成分分析(图3-A),结果显示,各个时期样品生物学重复较好。不同时期样品被明显区分开,说明各发育时期在转录水平存在较大差异。差异表达基因(DEG)分析结果显示(图-3B),共鉴定出5 836个差异表达基因,不同比较组间的DEG数目差异较大,最少为383个(转色30天vs转色40天),其中,上调基因279个,下调基因104个。最多为2 390个(转色5天vs转色40天),上调基因1 495个,下调基因895个。为了确定葡萄果实转色过程中DEG的主要生物学功能,对不同发育时期之间的DEG进行KEGG富集分析。由于不同组间DEG的注释结果相似,这里仅展示了转色5天vs转色30天组间DEG的富集结果(图3-C、D)。大部分差异基因富集到代谢过程(metabolism),其中包括其他次生代谢产物合成途径(biosynthesis of other secondary metabolites)和萜类及聚酮类代谢过程(metabolism of terpenoids and polyketides)等。在KEGG前20富集通路中,有苯丙氨酸合成(phenylpropanoid biosynthesis)、类黄酮合成(flavonoid biosynthesis)和单萜合成通路(monoterpenoid biosynthesis)。说明花色苷和单萜类合成相关基因表达在果实转色过程中发生显著的变化。
2.5 葡萄果实转色过程单萜和花色苷合成途径差异表达基因分析
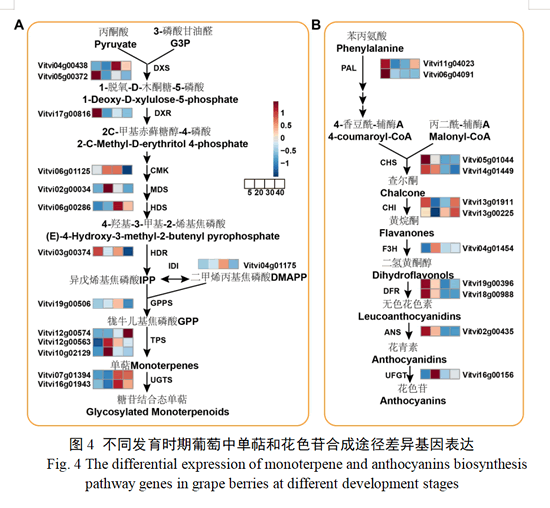
经注释,差异比较组合中共筛选出14个与单萜生物合成相关基因(图4-A),包括2个DXS基因(Vitvi05g00372和Vitvi04g00438)、1个DXR基因(Vitvi17g00816)、1个4-二磷酸胞苷基-2-C-甲基-D-赤藓糖醇激酶基因(CMK,Vitvi06g01125)、1个2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶基因(MDS,Vitvi02g00034)、1个4-羟基-3-甲基丁-2-烯-1-基二磷酸合酶基因(HDS,Vitvi06g00286)、1个HDR基因(Vitvi03g00374)、1个异戊烯基二磷酸δ异构酶基因(IDI,Vitvi04g01175)、1个GPPs基因(Vitvi19g00506)、3个TPS基因(Vitvi12g00563、Vitvi12g00574和Vitvi10g02129)和2个UGTs基因(Vitvi16g01943和Vitvi07g01394)。由基因表达热图可见(图4-A),包括DXS、DXR和HDR等在内的多数上游途径基因,在转色5 d就有一定量的表达,在转色20 d表达量降低,到转色30 d表达量又明显上升,这与此时单萜的积累相吻合。而包括GPPs、TPS和UGT等在内的中下游途径基因,则在转色早期表达量较低,转色20 d之后表达量升高,与单萜积累模式一致。
筛选出与花色苷生物合成相关基因11个(图4-B),包括花色苷合成途径上游结构基因2个PAL基因(Vitvi11g04023和Vitvi06g04091)、2个CHS基因(Vitvi05g01044和Vitvi14g01449)、2个CHI基因(Vitvi13g00225和Vitvi13g01911)和1个F3H基因(Vitvi04g01454),花色苷合成途径下游结构基因 DFR(Vitvi18g00988和Vitvi19g00396),ANS(Vitvi02g00435)和UFGT基因(Vitvi16g00156),这些基因均在转色早期具有较高的表达量,表达模式与花色苷含量相关。
2.6 葡萄果实转色过程单萜和花色苷合成相关转录因子分析
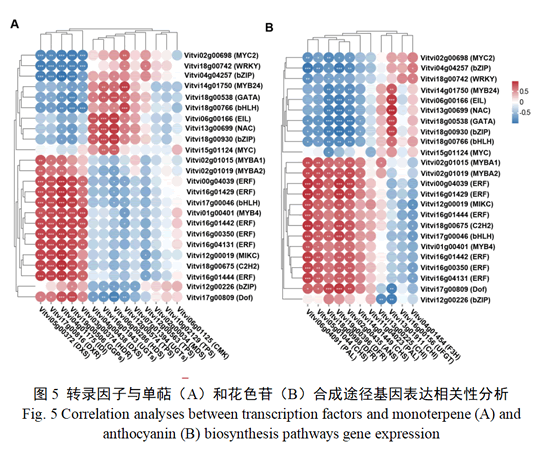
转录因子在单萜和花色苷生物合成中起重要调控作用。通过相关性分析筛选与单萜和花色苷合成相关基因共表达的差异转录因子,发现有24个转录因子与两个途径基因均具有显著的相关性(图5),分别属于MYC、MYB、bHLH、bZIP、C2H2、GATA、ERF、NAC和WRKY等转录因子家族,其中包含了已经被报道的转录因子,如参与调控葡萄花色苷合成的转录因子MYBA1(Vitvi02g01015)、MYBA2(Vitvi02g01019)、MYC(Vitvi15g01124)和MYB4(Vitvi01g00401)等,以及调控单萜合成的转录因子MYB24(Vitvi14g01750)等转录因子,这些转录因子分别与单萜和花色苷合成途径多个基因表现显著的相关性,推测可能参与调控二者的合成。
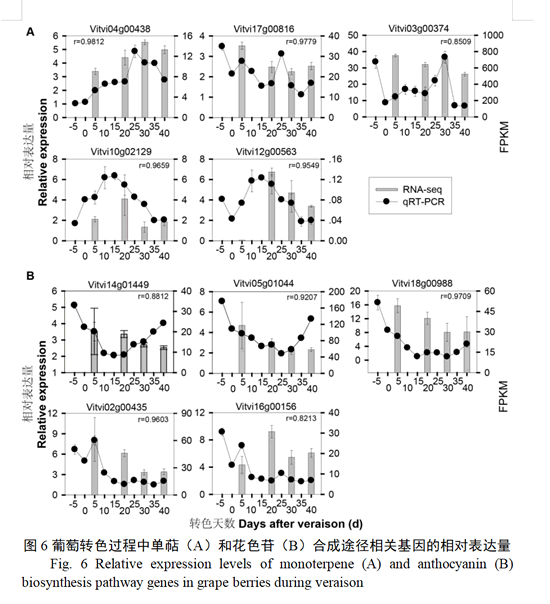
2.7 葡萄果实转色过程单萜和花色苷合成基因的表达验证
分别选择单萜合成途径5个基因(1个DXS基因Vitvi04g00438、1个DXR基因Vitvi17g00816、1个HDR基因Vitvi03g00374、2个TPS基因Vitvi10g02129和Vitvi12g00574),以及花色苷合成途径5个基因(2个CHS基因Vitvi14g01449和Vitvi05g01044、1个DFR基因Vitvi18g00988、1个ANS基因Vitvi02g00435和1个UFGT基因Vitvi16g00156)进行10个发育时期qPCR表达分析(图6)。DXS基因(Vitvi04g00438)表达量在整个转色期呈增加趋势,转色25 d达到最高水平,随后表达量减少;DXR基因Vitvi17g00816和HDR基因Vitvi03g00374均在转色初期大量表达,随后表达量减少,转色25 d表达量快速升高;2个TPS基因均随着转色进程,表达逐渐升高,至转色15 d达到最高水平,随后略有下降(图6-A)。而花色苷合成途径基因均在转色早期表达量较高,随后逐渐降低(图6-B)。qPCR结果与转录组数据表现出相似的表达趋势。