土壤与产地环境污染管控与修复
摘要:镉对葡萄的生长、发育和品质都会造成严重影响,果园受到的低浓度镉污染问题不容忽视,砧木嫁接能够提高葡萄对镉胁迫的适应能力,但关于镉胁迫下砧木嫁接后镉胁迫对葡萄的转录变化机制,尚未见报道。本研究以三种不同砧木嫁接的阳光玫瑰葡萄的二年生苗为试材,采用RNA-Seq技术,研究了镉胁迫下三种砧穗组合叶片的基因表达的变化。分析表明,SM/SO4与SM/5BB特有差异基因都大量显著富集在信号转导通路上,SM/3309C组合特有差异基因显著富集在遗传信息处理层面和能量代谢等途径。同时发现镉胁迫影响了葡萄植株的碳水化合物代谢、氨基酸代谢、次生代谢物的生物合成、能量代谢、信号转导及转录、翻译等基本代谢过程。此外,ERF转录因子家族可能是SM/SO4和SM/5BB响应低镉胁迫的主要转录因子,SM/3309C组合中MYB家族可能起重要作用。WGCNA分析结果表明,WRKY54、VIT_13s0084g00670、VIT_11s0016g02070、VIT_09s0054g00900等基因可能是阳光玫瑰葡萄响应低镉胁迫的关键基因;而类黄酮生物合成、苯丙烷类生物合成等次级代谢物生物合成,以及植物-昼夜节律、谷胱甘肽代谢等通路,可能是嫁接阳光玫瑰葡萄响应低镉胁迫的重要代谢通路。镉对高等植物暂无有益作用,转录组分析表明ERF和MYB转录因子可能在响应低镉胁迫中起重要作用。上述发现有助于了解嫁接阳光玫瑰葡萄在低镉胁迫下的响应机制,为进一步明确葡萄植株对镉的吸收及其调控机制,提供理论参考。同时为生产中阳光玫瑰葡萄砧木选择、改良葡萄品质提供理论支撑。
1 引言
随着现代工业化和城市化进程的加速,环境胁迫对植物生长发育的影响日益显著。土壤中重金属超标、低温、高盐等不良环境因素,不仅影响植物的正常生长,还通过食物链传递对生态系统和人类健康造成潜在威胁。在这样的背景下,深入了解植物在环境胁迫下的响应机制,对于提高农作物的抗逆性、保障粮食安全具有重要意义。转录组分析作为一种强大的技术手段,能够全面揭示植物在不同环境条件下基因表达的变化,为探究植物抗逆机制提供了关键线索。
重金属污染(尤其Cd污染)作为植物在生长发育过程中经常面临的不利环境条件,是一种常见的非生物胁迫,也是农业生产实践中普遍且极具威胁的一种危害。长期以来,人们已经知道过量的Cd会抑制植物的生长,降低叶绿素含量(Chen et al., 2011),破坏细胞膜完整性(Sko´rzyn´ska-Polit et al., 2010),并扰乱水分13.6%态(Poschenrieder et al., 1989)。此外,在分子水平上, Cd胁迫后植物细胞核及核仁将发生形变甚而分解,染色体畸变并影响DNA 的复制,进而影响细胞的转录、翻译等过程,如小麦(Triticum aestivum L.)和水稻(Oryza sativa L.)叶片DNA胶联程度随Cd处理浓度的上升而接续加重(葛才林等,2002)。
因此,本试验以三种不同砧木(生产常用)嫁接的阳光玫瑰葡萄为试验材料,用不同浓度的Cd处理土壤,研究Cd胁迫对葡萄转录组的影响;通过比较三种不同砧木对Cd的耐受性,以及Cd处理后葡萄叶片的Cd积累,通过转录组分析,结合抗氧化系统等表型数据,探讨Cd胁迫对阳光玫瑰葡萄重要代谢通路的影响。上述研究上述研究对于了解Cd胁迫对葡萄基因的表达和代谢的调控机制,具有重要意义,可为生产上通过选择适宜的砧木、减少重金属危害、促进优质葡萄生产,提供理论支撑。
2 材料与处理
2.1 试验材料
本研究中使用的葡萄材料为嫁接一致的一年生阳光玫瑰,所选的砧木品种分别为SO4、5BB和3309C三种常见的阳光玫瑰砧木品种,嫁接苗采用简写形式分别为SM/SO4、SM/5BB和SM/3309C。
葡萄园土过筛,每盆称重20kg,将CdCl2按需换算为Cd浓度梯度。Cd浓度梯度为0 mg/kg、0.2 mg/kg、0.4 mg/kg、0.8 mg/kg、1.6 mg/kg、3.2 mg/kg,后将每盆所需CdCl2溶于500 ml蒸馏水,边铺土边喷含Cd溶液,最后搅拌3-5次,保证充分混匀。每个Cd浓度处理的每种砧木设置3个生物学重复,以0 mg/kg的为对照组,共计54盆。定植28天后,待叶片长到6-8片叶时,取长势好、成熟、完整的葡萄叶片于12 小时收集样品,立即在液氮中冷冻,并储存在-80℃冰箱,用于转录组分析。
2.2 转录组测序及分析
2.2.1 基础生信分析
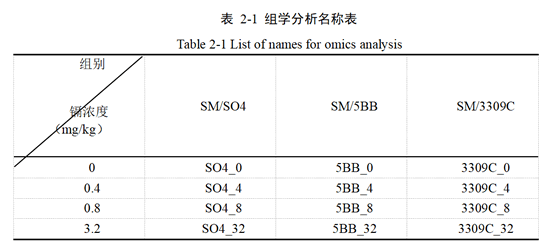
本研究使用0 mg/kg、0.4 mg/kg、0.8 mg/kg、3.2 mg/kg镉胁迫28天后的三种砧穗组合的葡萄叶片,分为12组,每组两个生物学重复,共计24个样品进行转录组测序。文库构建和测序均在美吉生物技术有限公司(中国上海)完成。其中组学分析样本名称采用简写,如表2-1所示。
数据初步分析,包括使用HISAT2将筛选后的RNA-seq数据与参考基因组进行比对;利用表达定量软件RSEM将测序读长进行组装并评估其表达量;采用FPKM计算公式计算基因转录水平的相对表达量等均在美吉生物云平台(https://cloud.majorbio.com/)完成。用DESeq2分析葡萄叶片样品组内及组间的差异表达,然后差异基因的GO注释、KEGG富集分析、转录因子家族统计以及WGCNA分析均在美吉生物云平台完成。具体分析软件详情如下表所示:

2.2.2 差异表达基因的实时荧光定量PCR
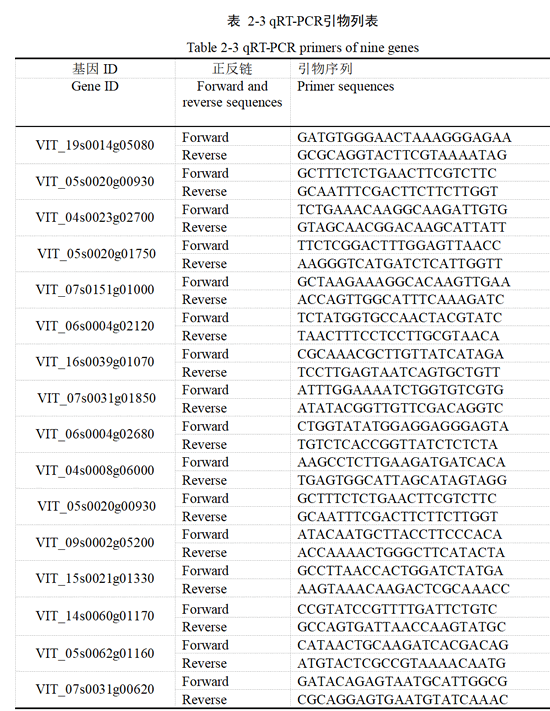
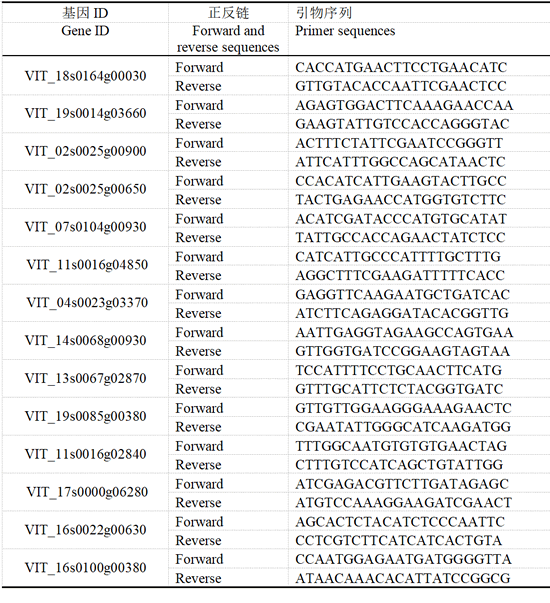
本试验挑选30个差异基因进行qRT-PCR 分析。利用qPrimerDB 网站和Primer 5 软件查找和设计引物,引物序列如表2-3所示,反应条件为:95℃预变性3min 之后,95℃变性10s,55℃退火30s,后二步进行40 个循环。以VvGAPDH为内参基因,∆∆CT方法进行数据分析。
3.结果与分析
3.1 三种砧穗组合转录组学分析
3.1.1 RNA 测序数据质量评估
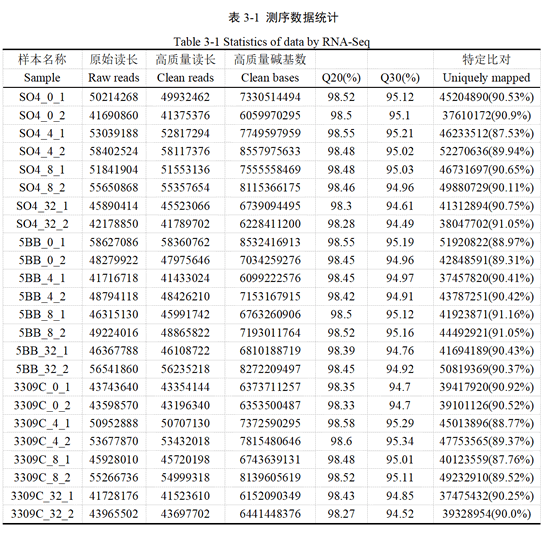
本试验采用Illumina测序完成了葡萄叶片24个样品的转录组测序,构建了Illumina PE文库,对获得的原始测序数据进行质量控制,以保证后续分析的顺利进行。如表3-1 所示,共获得171.59 Gb Clean Data,各样品Clean Data均达到6.06 Gb以上,Q20的碱基比例分别达98%以上,Q30的碱基比例达94%以上,直观地反映出样本的测序质量和文库构建质量较好。将质控后得到的高质量测序数据与葡萄参考基因组进行比对,质控后的测序数据中87 %以上可以比对到参考基因组中,由此说明,测序数据的质量较好,比对结果较好,可以进行下一步分析。
3.1.2 差异表达基因(DEGs)的筛选
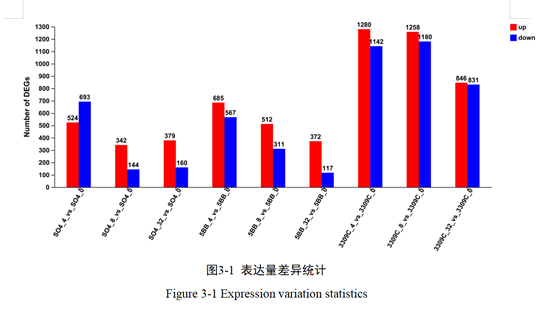
本试验中,我们以p-adjust<0.05且|log2FC|≥1,对葡萄叶片不同浓度镉胁迫的基因进行筛选。由图3-1可知,和对照组SO4_0相比,SM/SO4组别中0.4mg/kg、0.8 mg/kg和3.2mg/kg镉胁迫下显著上调表达基因数分别是524、342和379,显著下调分别有693、144和160;和对照组5BB_0相比,SM/5BB组中0.4mg/kg、0.8 mg/kg和3.2mg/kg镉胁迫下显著上调表达基因数分别是685、512和372,显著下调分别有567、311和117;和对照组3309C_0相比,SM/3309C组别中0.4mg/kg、0.8 mg/kg和3.2mg/kg 镉胁迫下显著上调表达基因数分别有1280、1258和846,显著下调分别有1142、1180和831。随着镉浓度增加,SM/SO4组差异表达基因数量先下降后上升;SM/5BB组差异表达基因数量呈下降趋势;SM/3309C组差异表达基因数量先上升后下降且差异基因数目远大于其余两组,三种砧穗组合的差异表达基因数量总体随镉浓度的增加而减少。此外,参与镉胁迫调控上调的基因数目大于下调基因的数目,说明葡萄叶片主要通过基因的正调控来提高其对镉的抗性。
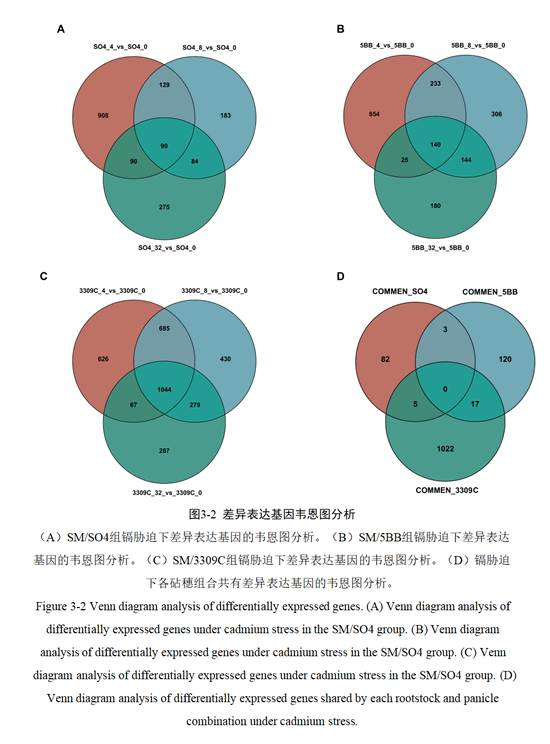
利用韦恩图分析葡萄三种砧穗组合、不同镉浓度胁迫的差异表达基因情况,结果表明,SM/SO4组共有的差异基因数量为90(图3-2A);SM/5BB组共有的差异基因数量为140(图3-2B);SM/3309C组共有的差异基因数量为1044(图3-2C)。同时对不同砧穗组合的共有差异基因进行韦恩图分析,发现SM/SO4组特有的差异基因有82个,SM/5BB组特有的差异基因有120个,SM/3309C组特有的差异基因有1022个(图3-2D)。
3.1.3 差异表达基因的GO功能注释和KEGG富集分析
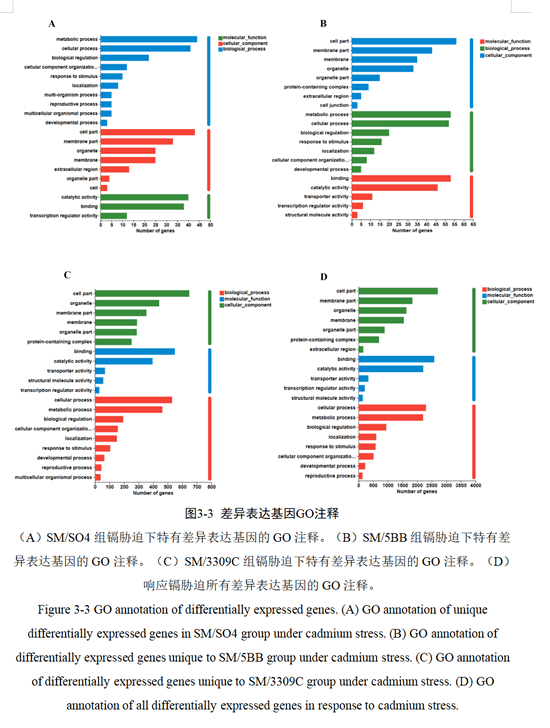
基因本体论(Gene Ontology,GO)包括有三个基本分类:分子功能(molecular function,MF)、细胞组分(cellular component,CC)以及生物学过程(biological process,BP),每个基本分类下又有若干个小类(term)。通过GO对基因进行注释,可以理解生物体中基因或者基因产物的属性。分别对上述三种砧穗组合特有的差异基因和所有响应镉胁迫的差异基因进行GO功能注释(图3-3)。
可以发现,三种砧穗组合在GO分类中有相同之处,也存在不同。三种砧穗组合生物学过程中代谢过程(GO:0008152)、细胞过程(GO:0009987)、生物调节(GO:0065007)等基本过程和区域化(GO:0051179)等占比都较高;在细胞成分上细胞部分(GO:0044464)、膜部分(GO:0044425)、膜(GO:0016020)等基本成分都占比较高,在行使的分子功能中结合(GO:0005488)、催化活性(GO:0003824)、转录调节活性(GO:0140110)都参与了镉胁迫的响应。不同之处如SM/SO4和SM/5BB组中应激响应(GO:0050896)都主要参与了其生物学过程,SM/3309C组中并没有;在分子功能中SM/SO4组中抗氧化活性(GO:0016209)占比较高,SM/3309C组中结构分子活性占比(GO:0005198)较高。三种砧穗组合在GO功能上的差异,可能导致了不同砧木响应Cd的不同。
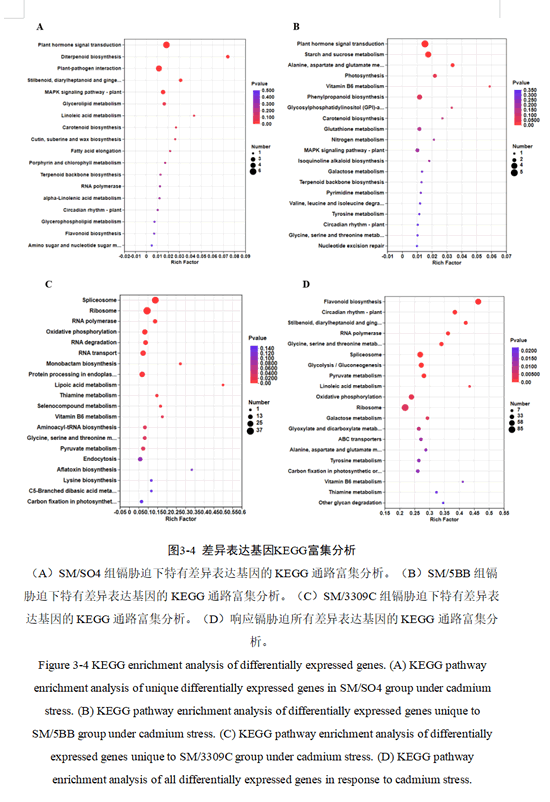
为了比较三种砧穗组合低镉胁迫后在转录水平的差异代谢通路,分别对SM/SO4、SM/5BB和SM/3309C组的上述特有的DEGs开展KEGG功能富集分析。结果如图3-4所示,SM/SO4、SM/5BB和SM/3309C显著富集到的代谢通路数分别为5、4、15(P-value < 0.05)。SM/SO4组显著富集的通路(根据P值排序)为植物激素信号转导,二萜类生物合成,植物-病原体相互作用,二苯乙烯类、二芳基庚烷类和姜辣素生物合成,植物-MAPK信号通路(图3-4A);SM/5BB组显著富集的通路(根据P值排序)为植物激素信号转导,淀粉和蔗糖代谢,丙氨酸、天冬氨酸和谷氨酸代谢,光合作用(图3-4B);SM/3309C组显著富集的通路(根据P值排序)为剪接体,核糖体,核糖核酸聚合酶,氧化磷酸化,核糖核酸降解,核糖核酸转运,单巴坦生物合成,内质网中的蛋白质加工,硫辛酸代谢,硫胺素代谢,硒化合物代谢,维生素B6代谢,氨酰基-tRNA生物合成,甘氨酸、丝氨酸和苏氨酸代谢,丙酮酸代谢(图3-4C)。同时将响应镉胁迫下的所有差异基因进行KEGG 富集分析发现显著富集的通路有27条,其中前15条通路(根据P值排序)为类黄酮生物合成,植物-昼夜节律,二苯乙烯类、二芳基庚烷类和姜辣素生物合成,核糖核酸聚合酶,甘氨酸、丝氨酸和苏氨酸代谢,剪接体,糖酵解/糖异生,丙酮酸代谢,亚油酸代谢,氧化磷酸化,核糖体,半乳糖代谢,乙醛酸和二羧酸代谢,ABC转运蛋白,丙氨酸、天冬氨酸和谷氨酸代谢等代谢通路(图3-4D)。
综上所述,SM/SO4和SM/5BB组在信号转导通路都有大量基因显著富集,而SM/3309C组大量基因显著富集在遗传信息处理层面。三种砧穗组合在转录水平通路富集的相似与差异,可能导致了不同砧木响应Cd的相近与不同。同时可以发现低镉胁迫影响了葡萄植株的碳水化合物代谢,氨基酸代谢,次级代谢物的生物合成,能量代谢,信号转导及转录,翻译等基本代谢过程。
3.1.4 镉胁迫响应的转录因子分析
转录因子是植物中普遍存在的一类调节蛋白、在植物生长发育、逆境应答等方面可以起到调节和控制作用,其重要性不言而喻。为了比较三种砧穗组合镉胁迫响应的差异,分别对上述特有差异基因所属的转录因子家族进行统计。由表3-2可知,在响应镉胁迫丰度前10的转录因子家族中,SM/SO4组共有11个转录因子参与镉胁迫响应,主要为ERF;SM/5BB组也有11个转录因子参与镉胁迫响应,主要为ERF、MYB_related、NAC等;SM/3309C组共有18个转录因子参与镉胁迫响应,主要为MYB、MYB_related等。同时三种砧穗组合所有响应镉胁迫的转录因子有200个,主要为ERF、MYB、MYB_related、NAC、bHLH、WRKY、B3、HB-other等八类。可以发现ERF转录因子家族中的转录因子是SM/SO4和SM/5BB响应镉胁迫的主要转录因子,可能也说明了SM/SO4和SM/5BB在响应Cd胁迫时比较相似。此外,嫁接后阳光玫瑰葡萄在响应低镉胁迫时ERF、MYB、NAC、bHLH、WRKY家族可能起着重要作用。
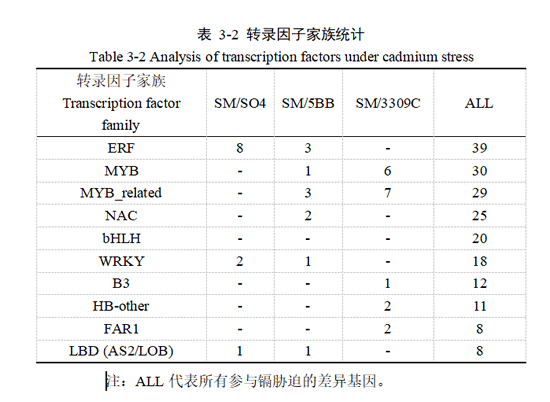
3.1.5 加权基因共表达网络分析
加权基因共表达网络分析(Weighted Gene Co-expression Network Analysis, WGCNA)是当前高通量基因测序数据挖掘的主流方法之一。该方法不仅可以挖掘高度相关的基因模块,更可以直观深入地反映基因之间可能存在的表达调控关系以及处于其中核心位置的节点,即核心基因(hub gene)。在本试验中将转录组数据与上述生理表型数据结合即过氧化氢(H2O2)、丙二醛(MDA)、脯氨酸(Pro)、叶绿素(Chl)、超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)进行WGCNA分析。我们确定了6个生动的模块(具有各种颜色),其中灰色模块代表没有划分到具体模块的基因(图3-5A)。此外,还检测到5个性状特有的模块。根据模块与表型的相关性与显著性,从中筛选出了1个模块,即棕色模块,可以发现棕色模块与叶绿素含量、SOD和GR活性呈显著正相关(P<0.05),与过氧化氢含量呈负相关(图3-5B)。
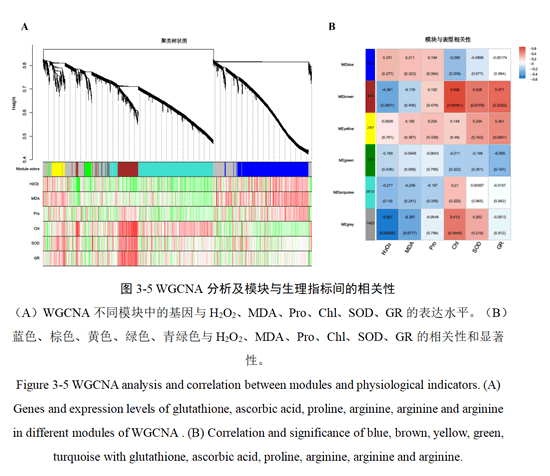
筛选棕色模块内连通性排名前100的基因上传到stringdatabase官网进行蛋白互作网络分析并利用Cytoscape软件进行作图。结果如图3-6A所示,WRKY54、VIT_13s0084g00670、VIT_11s0016g02070、VIT_09s0054g00900这4个基因介数中心性(betweenness centrality)最高,表明它们与其他蛋白的联系最强。这可以推测其在响应低镉胁迫中具有重要的作用。此外,在表3-5中列出了介数中心性排名前10的基因。同时对棕色模块进行KEGG富集通路分析发现低镉胁迫显著影响了棕色模块中类黄酮生物合成,苯丙烷类生物合成等次级代谢物生物合成和植物-昼夜节律,谷胱甘肽代谢通路(图3-6B)。这些基因和代谢通路可能是嫁接阳光玫瑰葡萄响应低镉胁迫的关键基因和重要代谢通路。
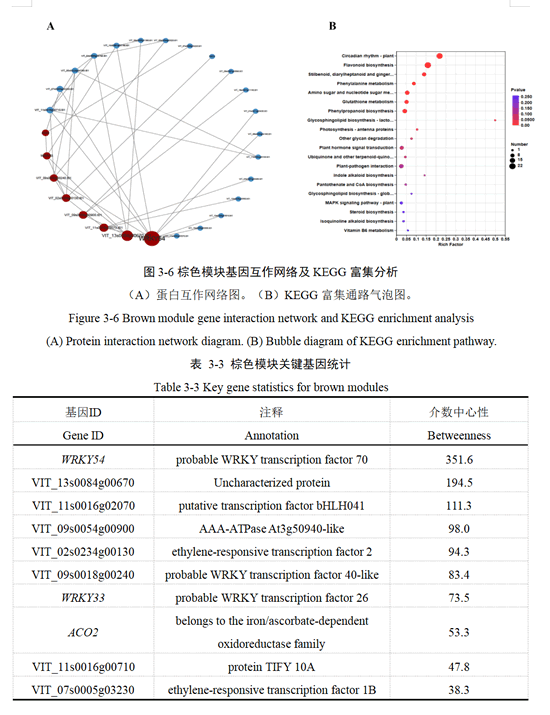
3.1.6 qRT-PCR 和RNA-seq 的表达量分析
本研究对随机选择30 个基因进行qRT-PCR 验证。通过相关分析表明(图3-7): qRT-PCR分析结果虽然与测序结果不完全一样,但差异表达趋势相同,且发现两者呈现正相关性(R2=0.9047),表明了转录组测序数据的可靠性。
4 结论
本研究围绕葡萄在种植中镉污染的基本问题,开展嫁接葡萄响应镉胁迫相关机制研究。利用三种常见砧木嫁接的阳光玫瑰葡萄,结合三种砧穗组合镉处理后叶片组织的转录组测序结果,探究镉胁迫下接穗叶片的基因表达谱的变化。主要结果如下:
在转录水平上,SM/SO4与SM/5BB特有差异基因都大量显著富集在信号转导通路上,SM/3309C组特有差异基因显著富集在遗传信息处理层面和能量代谢等途径。同时可以发现镉胁迫影响了葡萄植株的碳水化合物代谢、氨基酸代谢、次级代谢物的生物合成、能量代谢、信号转导及转录、翻译等基本代谢过程。此外,ERF转录因子家族中的转录因子是SM/SO4和SM/5BB响应镉胁迫的主要转录因子,SM/3309C组中MYB家族似乎起着更重要作用。WGCNA分析结果表明,WRKY54、VIT_13s0084g00670、
VIT_11s0016g02070、VIT_09s0054g00900等基因和类黄酮生物合成、苯丙烷类生物合成等次级代谢物生物合成及植物-昼夜节律、谷胱甘肽代谢、苯丙氨酸代谢等通路可能是嫁接阳光玫瑰葡萄响应低镉胁迫的关键基因和重要代谢通路。