济南综合试验站
王超萍 李勃
葡萄作为一种重要的经济果树,其果实品质是影响葡萄经济价值的最主要因素。果实品质的关键指标包括果径、糖分累积、果皮颜色和香气成分等。然而,随着全球水资源日益紧张,传统灌溉方式不仅具有浪费水资源、灌溉不均匀、破坏土壤结构等缺点,还增加了生产成本。其已难以满足现代农业对水资源高效利用和环境保护的要求。因此,开发节水灌溉技术的同时提升果实品质,成为葡萄栽培的重要研究方向。
近年来,根系干湿分区灌溉(PRI)作为一种新型节水灌溉技术受到广泛关注。该技术通过交替灌溉植物根系两侧,降低了用水量,使水分利用率提高;并且创造局部水分胁迫环境从而激发植物的生理调节机制,增加植物的抗逆性。研究发现,PRI对多种作物都有节水效果并可提高果实品质。房玉林等研究认为在调亏灌溉下,尽管葡萄叶片光合速率较常规灌溉下降,但更多的同化物向果实分配,葡萄果实糖分积累速率与转色速率较常规灌溉显著上升。杨建昌等研究认为根系干湿分区能够促进水稻籽粒与苹果果实的同化物积累速度。
然而,目前研究关于PRI对葡萄果实品质影响,其共识仍存在一些问题。首先,不同研究结果存在差异,这可能与葡萄品种、灌溉方式和环境条件等因素有关。其次,PRI对葡萄果实品质影响的机制尚未完全明确,尤其是对葡萄果实糖分积累速率与果皮颜色的影响方面。此外,现有研究多关注短期效应,缺乏对长期灌溉管理影响的系统研究。
本研究以3年生‘玫瑰香’葡萄为材料,采用根系干湿分区灌溉(PRI)、常规灌溉(CK)和传统调亏灌溉(RDI)三种灌溉方式,通过测定叶片光合参数、果实品质指标(果径、单果重、果实颜色指数、糖度、可溶性糖含量等)以及果实糖代谢酶活性,探讨PRI对葡萄果实品质、糖组分含量以及糖代谢酶活性的影响以及机制,并提出适合‘玫瑰香’葡萄的优化灌溉方案,为葡萄节水提质技术提供理论依据,进而优化灌溉策略,减少水资源浪费,提高葡萄果实的糖分含量和果皮颜色等品质指标,提升葡萄的市场竞争力,推动葡萄产业的可持续发展。
1 材料与方法
1.1 试验材料
试验于江苏省扬州市扬州大学园艺园林学院农场避雨大棚内进行,于2022年2月底种植扦插苗,采用盆栽方式栽培,限根器直径65cm、高60cm,中间用厚塑料板分隔根系,使根系平均分配至限根器两侧。试验材料按照南北行向栽培(图1D),株行距2.0 m。生长基质为园土和营养土(1:1,V/V),定期施加菜籽饼肥,并喷施叶面肥。在花期对树体进行剪穗处理,确保每株葡萄树都有相同数量的果实串和均匀的果实粒数。2023年果实进入转色期时,选取 10 株葡萄进行根系干湿分区栽培处理,10 株进行常规灌溉(图1A)作为对照组,10 株进行传统调亏灌溉处理(图1C)。在所有这些处理中,除了灌溉方式不同外,其他管理措施均保持一致。根系干湿分区灌溉(PRI)以每 10 d为一个周期,测定期长共计 30d。每个周期内仅对一侧根系进行灌溉,并在不同周期中交替灌溉干区和湿区。每个周期内湿区(灌溉区)称之为 PRI,干区(非灌溉区)称之为 PDI(PRI-dry)。在一个周期内当湿区水势降至-20 kpa 时,仅向湿区灌溉5 L水(图1 B)。传统调亏灌溉(RDI,图1C):在每次根系干湿分区灌溉灌溉侧时,用5 L水灌溉根的两侧。

1.2 试验方法
1.2.1 光合速率测定
于干区土壤水势为-60 kpa、CK土壤水势为0 kpa和调亏灌溉土壤水势为-40 kpa时,当天天气晴朗,从凌晨6点到晚上18点,每隔两小时使用CIRAS-3便携式光合测定系统(汉莎科技公司,美国)测量一次各处理叶片的光合参数。使用光合仪时提前半小时开机预热,选取每个处理三个重复,每个重复随机选取向阳面节位大小一致的成熟叶片。首次测量后对所选测定叶片挂牌标记并记录,每次测定前用喷雾器清洗掉表面污垢,待干燥后测定。
1.2.2 葡萄果实品质测定
在处理开始后对葡萄果实挂牌处理每隔 3d 观察果皮颜色,并于最后采收期采样记录其果径、单果重、红色葡萄果实颜色指数(CIRG)、糖度、可溶性糖含量、总酚含量、花色苷含量与酒石酸含量。其中糖度由糖度仪测定。
(1)果实果径与 TSS测定
每处理随机选取 15 个果实作为重复。游标卡尺测定其果实腰部直径,采用手持便携式数显糖度仪 PRl01(Atago,日本)进行测定 TSS,单位为:百分比(%)。
(2)果实颜色指数测定
果实颜色指数(CIRG)使用分光色差仪(Hunter Associates Laboratory,美国)测定:每个处理方案,精心挑选15颗大小相对均匀的果粒,在果粒赤道附近的位置,选取2个点测定。测定后的 L,a,b值依据国际照明委员会L*a*b测定体系与红色葡萄果实颜色指数计算方式计算,公式如下:
CIRG=(180-H/L*+C),(公式1)
式中:
H=arctan(b*/a*);
C=(a*2+b*2)*0.5。
(3)果实可溶性糖含量测定
可溶性糖含量通过蒽酮比色法测定:每处理选取三个生物学重复,将果实冰水浴下研磨成匀浆,重复三次,每次超声提取 30 min,4000 r/min 离心后取上清液得样品提取液。取0.5 mL样品提取液,加入 1.5 mL灭菌水,接着依次向样品提取液中加入 5 mL 浓硫酸和 0.5 mL 2% 蒽酮—乙酸乙酯试剂,充分振荡确保两者完全混匀,接着将该混合物置于沸水浴中加热 1 min, 之后取出并让其自然冷却直至达到室温。用空白溶液作对照,在波长 630 nm 处测吸光度。使用先前测定的标准曲线测可溶性糖含量。
(4)果实总酚含量测定
果实总酚含量使用福林酚法测定:每处理选取三个生物学重复,将果实冰水浴下研磨成匀浆,4000r/min 离心取上清液,按照所得体积 1:16 加入70%的乙醇提取液(混合 1%甲酸),超声提取30 min,4000 r/min离心取上清液,重复3次,合并上清液,于-20℃冰箱中保存。将0.5 mL稀释两倍的提取液与4 mL双蒸水(ddH2O)混合均匀后,再加入0.5 mL浓度为0.5N的 Folin-ciocalteu试剂(购自Sigma,美国)。等待反应进行3 min之后,向其中加入1mL的 7%的 Na2CO3溶液,并振荡使其充分混合。随后,在30℃的水浴中保持2 h。用紫外分光光度计(型号为DU-8000 ,由Beckman Coultor公司生产,美国)在760 nm波长下测定混合液的吸光度。以没食子酸(购自Sigma,美国)作为标准品绘制标准曲线,最终将总酚含量表示为每克样品中含有的毫克数(mg/g)。
(5)葡萄果皮总花色苷含量测定
使用 pH 示差法测定总花色苷含量:每个处理选取三个生物学重复,将果实冰水浴下研磨成匀浆,重复三次,每次超声提取 30 min,4000 r/min 离心取上清液得样品提取液。取0.2 ml提取液,分别与 0.8 mL的NaAc 缓冲液(pH=4.5)和 KCI 缓冲液(pH=10)混合均匀,进行稀释,然后在室温下避光静置反应 20 min。之后,使用紫外-可见分光光度计测定510 nm和700 nm波长下的吸光度。总花色苷含量可由公式2得:
总花色苷含量:mg /g =A×MW× DF×V/(e×m)(公式2)
式中:
A=(A510nm- A700 nm)pH10-(A510 nm - A700 nm)pH4.5;
MW- cyaniding-3-glucoside(C3G)的相对分子质量 449.2;
DF-稀释倍数 5;
V -提取液的总体积;
s - C3G 的摩尔消光系数26900;
M-样品质量。
(6)葡萄酒石酸含量
葡萄酒石酸含量采用滴定法估算测定:每个处理选取三个生物学重复,称取所测果实可溶性糖的匀浆 1 g,用水洗入并于 250 mL容量瓶中定容,水浴锅 80℃水浴 30 min,间隔 5 min 振荡瓶身数次,使内部温度均匀,加速提取过程。随后取上清液,加入3 滴酚酞指示剂,然后使用0.1 mol/L NaOH 标准溶液滴定至浅红色并稳定不变色,立即记下碱液用量。酒石酸含量可由公式3得:酒石酸含量 mg/ml=0.65*V×V2/W×V1 (公式3)
式中:
W-样品鲜重(g);
V-提取液总体积(mL);
V1-所取上清液总体积(mL);
V2-测定时消耗的 0.1 mol/L NaOH 标准溶液体积(mL)。
1.2.3 葡萄果实糖组分测定
葡萄果实糖组分采用高效液相色谱测定:每隔3d 田间取样,称取各样品 1 g,先测定果实糖度,计算稀释倍数,稀释后果实糖度大于0.1 g/L,小于4 g/L。在冰上研磨至匀浆,加入适量超纯水(体积数为上面计算值)。超声30 min后,室温下8000 r/min,离心5 min取上清液,重复操作两次,定容至固定刻度,过 0.22 um纯水相滤膜,使用安捷伦1260液相色谱仪,安捷伦纯水柱,流动向为纯水,流速为0.2 mL/min。测定标准品出峰时间与峰面积来计算果实糖组分含量N(mg/g)。
1.2.4 果实糖代谢酶的测定
将糖分积累出现差异的8d和差异最大的12d的果实,于-80℃冰箱保存,称取1~2 g置于预冷的研钵中,分三次,共加入4 mL提取液(由10 mmol / L MgCl2、50 mmol / L HEPES-NaOH(pH=7.5)、2.5 mmol / L二硫苏糖醇(DTT)、1 mmol / L乙二胺四乙酸(EDTA)、 0.1%(w/v)牛白蛋白(BSA)和0.05%(v/v)Triton X-100 组成),将样品在冰浴中充分研磨成均匀的浆液,随后在4℃下以10000 r/min的速度离心10分钟。将提取液置于透析袋中处理,恒温2℃环境,使用上述所提取的缓冲液用以去除Triton X-100,随后用浓度低于原缓冲液10倍的缓冲液进行透析,共处理24小时,至12小时换透析液,随后定容测定的酶提取液至总体积6 毫升。在冰水浴中进行整个提取和透析过程,将酶提取液透析后产物存于-80℃的冰箱中。
酸性转化酶(AI)活性的测定步骤如下:首先,取0.1 mL的酶提取液,并将其与0.9 mL的反应混合液混合,该混合液由0.1 mol / L的乙酸钠(用乙酸调至pH 4.8)和0.1 mol / L的蔗糖组成。然后,在37℃的恒温条件下反应20分钟,之后通过沸水浴加热5分钟来终止反应。随后,将1 mL的3,5-二硝基水杨酸加入每个试管,于沸水浴中加热5min,然后冷却至室温。利用比色法在540 nm处测定所生成糖的含量。另外进行一个空白对照实验,取0.1 mL的酶提取液作为对照,在沸水中加热10分钟,此处理的酶提取液使用0.1 mL的蒸馏水,其余操作方法与上文实验相同。转化酶的活性可以由计算还原糖的生成速率,即通过实验组与空白对照组的差异,单位为mg sucrose/(g FW ∙min)。
中性转化酶(NI)活性测定的操作与酸性转化酶(AI)相似,唯一的不同在于反应液从乙酸钠(用乙酸调节至pH 4.8)更换为0.1 mol / L的磷酸缓冲液(pH=7.5)。其他步骤保持一致。
AI/NI活性可以通过以下公式计算(公式4):AI/NI 活性(mg sucrose/(g FW∙min))=C×Vt×n/(FW×t×Vs)
其中各参数的含义如下:
C-在标准曲线中测得的葡萄糖含量(μg);
FW-组织的湿重(g);
t-反应进行的时间(h);
Vt -提取的酶液的总体积(mL);
Vs-在测定过程中使用的酶液体积(mL);
n -在测定时提取液的稀释倍数。
蔗糖合成酶(SS,促进蔗糖分解方向)活性测定:酶提取液定容 0.5 mL反应液,其中反应体系中含80 mmol / LMes缓冲液(pH 5.5)、5 mmol / L NaF、100 mmol / L蔗糖和5 mmol / L UDP;30℃水浴下反应 30 min 后加入0.5 mL DNS 试剂终止反应,随后沸水浴5 min,冷却后540 nm处测定OD值,对照反应体系中不含 UDP 。
SS 活性可由公式5得:
SS 活性(mg glucose/(g FW ∙min))=C×Vt×n/(FW×t×Vs)(公式5)
式中:
C -标曲中查得的葡萄糖量(mg);
FW -组织鲜重(g);
t -反应时间(h);
Vt -提取酶液总体积(mL);
Vs -测定时取用酶液体积(mL);
n -提取液测定中的稀释倍数。
蔗糖磷酸合成酶(SPS)活性测定:50 uL 酶提取液加入50 uL反应液,内含0.1 mol/L 硼酸缓冲液(pH8.0)、10 mmol / L UDPG、5 mmol / L 果糖-6-磷酸(F-6-P)、15 mmol / L葡萄糖-6-磷酸(G-6-P)、15 mmol / LMgCl2和1 mmol/L EDTA,将样品补充至0.2 mL后,在34℃下反应30分钟。接着,加入0.1 mL浓度为2 mol / L的氢氧化钠,进行100℃的沸煮5分钟,冷却后再添加0.8 mL的0.1%间苯二酚和1.4 mL的30%盐酸,充分摇匀。然后在80℃水浴中反应10分钟,待冷却后在480 nm波长下测定OD值。对照空白处理相同。通过两者之间的差异计算蔗糖合成量,从而得出蔗糖磷酸合酶的活性,单位为μg sucrose/(g FW∙min)。
SPS活性可以通过以下公式计算得到(公式6):
SPS 活性μg sucrose/(g FW ∙min)=C×Vt×n/(FW×t×Vs)
其中各参数的含义如下:
C-在标准曲线中测得的葡萄糖含量(μg);
FW-组织的湿重(g);
t-反应进行的时间(h);
Vt -提取的酶液的总体积(mL);
Vs-在测定过程中使用的酶液体积(mL);
n-在测定时提取液的稀释倍数。
2 结果与分析
2.1 根系干湿分区灌溉对叶片光合的影响
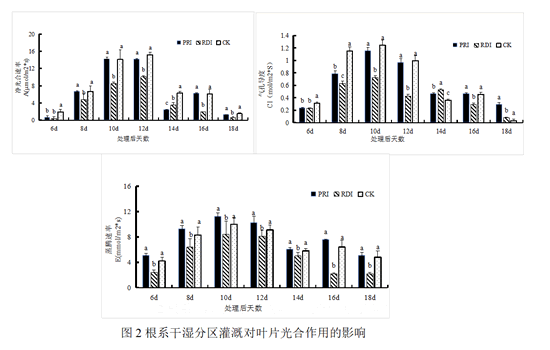
葡萄叶片是植株最主要的光合作用场所,叶片光合作用的强弱能够影响果实的糖分积累速率。由图2A可知,传统调亏灌溉(RDI)减弱了葡萄的净光合速率,除14:00外RDI光合速率均显著低于CK和PRI。根系干湿分区灌溉(PRI)的净光合速率与常规灌溉除6:00、14:00两个时间点外无显著差异。PRI与CK光合日变化曲线呈双S曲线趋势为先增后减再增加。三个处理在10:00~12:00净光合速率达到最大值。在12:00时CK的净光合速率为RDI的154.84%,PRI的净光合速率为RDI的138.88%。由图2B可知,PRI叶片的气孔导度总体上小于CK,大于RDI。在6:00~8:00期间,PRI显著气孔导度小于CK,但在10:00~12:00、16:00~18:00与CK无显著差异。除14:00外RDI气孔导度均显著低于CK和PRI。图2C可知,PRI的蒸腾速率与CK也无显著差异。
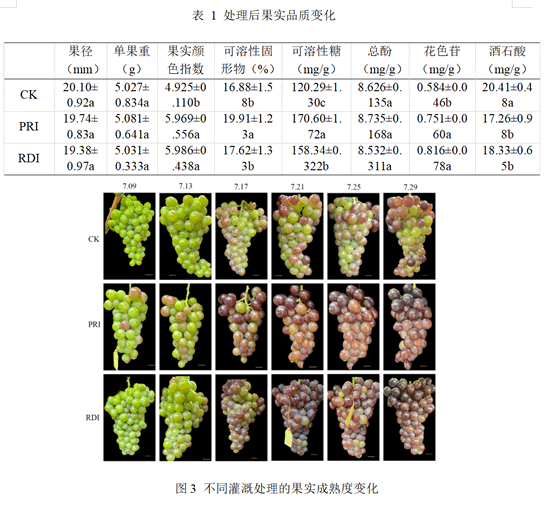
2.2 根系干湿分区灌溉对果实品质的影响
如图3所示,根系干湿分区灌溉处理后处理组果实颜色指数高于 CK,7月29日时 PRI 处理组转色已完成,而 CK 处理组仅有部分转色。表1 为8月2日采收时各处理的果实品质情况。从表中可以看出,三种处理的葡萄单果重与果径没有显著差异,果实总酚含量也无显著差异,PRI 的 TSS 与可溶性糖含量显著高于CK与 RDI,其 TSS约是CK的117.68%、RDI的113.34%,可溶性糖含量约是 CK 的141.82%、RDI的107.79%。PRI果实颜色指数,花色苷含量均显著高于CK,但与 RDI 无显著差异。CK酒石酸含量显著高于PRI和RDI。
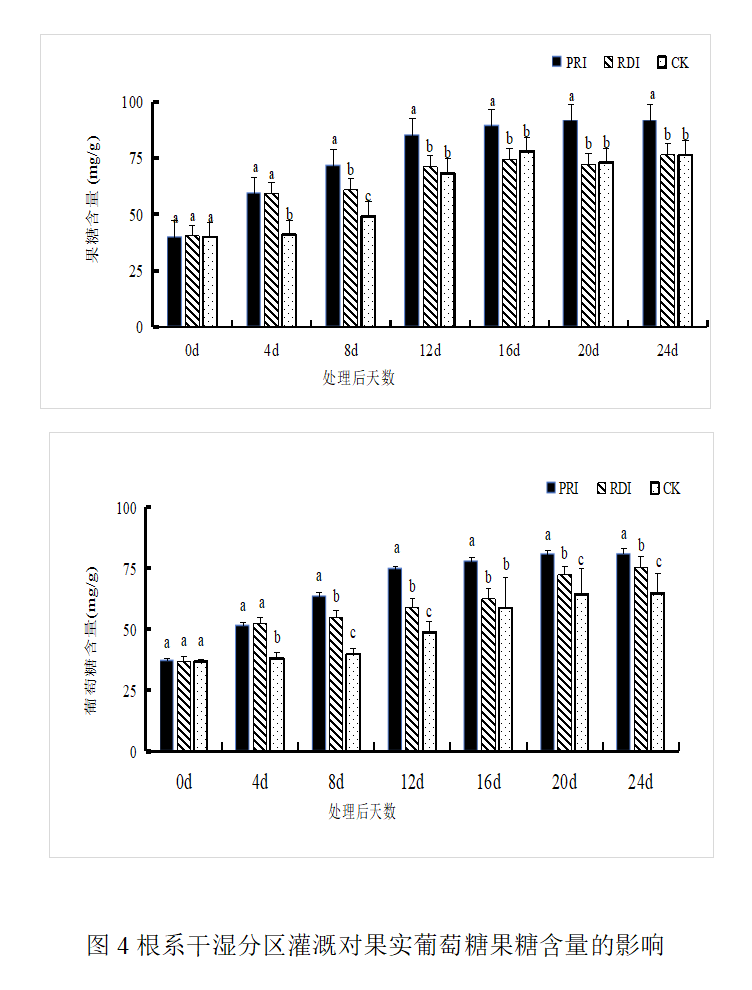
2.3 根系干湿分区灌溉对糖组分含量的影响
葡萄果实产物主要为葡萄糖与果糖。从图4可知,三个处理果实所含葡萄糖含量与果糖含量与含量均增加,处理4天后PRI葡萄糖与果糖含量与CK出现显著差异,在处理8 d后PRI葡萄糖与果糖含量与CK和RDI均有显著差异。处理12 d后PRI与CK糖分含量差异最大,PRI葡萄糖含量高于CK 29.77%;果糖含量高于CK 24.67%。在处理24 d采收时根系干湿分区灌溉的果实果糖含量显著高于CK,为CK的133.52%,葡萄糖含量为CK的113.42%。
2.4 根系干湿分区灌溉对糖代谢酶活性的影响
葡萄糖分积累过程,通常被认为主要是光合同化物从源到库以蔗糖形式通过韧皮部运输,在库端通过共质体与质外体途径卸载,在糖代谢酶作用下分解为葡萄糖与果糖,进而转运到液泡中储存的过程,因此,果实内糖代谢酶活性能直接反应果实糖分积累速率。由图5可知,在糖分积累出现显著差异的第8d与第12d,三种处理下酸性转化酶和蔗糖合成酶(分解方向)活性高于中性转化酶和蔗糖磷酸合成酶。PRI处理组在8d时,相较于CK处理组,酸性转化酶与蔗糖磷酸合成酶的活性均呈现出显著增高的趋势。特别是在第12d时,不仅酸性转化酶和蔗糖磷酸合成酶的活性显著高于CK处理组,且蔗糖合成酶和中性转化酶的活性也均表现出明显高于CK处理组的水平。
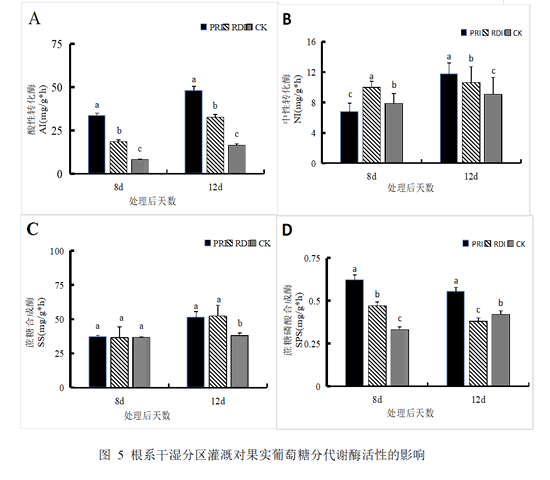
由图5可知,在糖分积累出现显著差异的第8d与第12d,三种处理下酸性转化酶和蔗糖合成酶(分解方向)活性高于中性转化酶和蔗糖磷酸合成酶。PRI处理组在8d时,相较于CK处理组,酸性转化酶与蔗糖磷酸合成酶的活性均呈现出显著增高的趋势。特别是在第12d时,不仅酸性转化酶和蔗糖磷酸合成酶的活性显著高于CK处理组,且蔗糖合成酶和中性转化酶的活性也均表现出明显高于CK处理组的水平。
3 讨论与结论
3.1根系干湿分区灌溉下光合速率的变化
根系干湿分区灌溉处理对树体光合速率的影响一直存在争议,不同植物根系干湿分区灌溉后对其光合的影响均有各种不同的报告。本试验中,根系干湿分区灌溉处理叶片整体的净光合速率大于调亏灌溉处理叶片低于常规灌溉处理叶片。根系干湿分区灌溉处理叶片净光合速率为常规灌溉处理叶片的89.7%,调亏灌溉处理叶片的145.3%,在上午10:00~12:00时净光合速率达到最大值。 根系干湿分区灌溉处理叶片的气孔导度除14:00外的其他时段均显著低于常规灌溉处理叶片。这一现象被认为是由于干区根系水分亏缺产生的激素信号ABA调控导致气孔关闭导致的。干区根的土壤水势下降,根系产生ABA量增加,并通过木质部汁液运输至叶片。
3.2 根系干湿分区灌溉对葡萄品质的影响
关于根系干湿分区灌溉栽培方式下的葡萄果实品质显著提升的报告已有不少。葡萄糖和果糖作为葡萄果实主要贮藏成分,在根系干湿分区灌溉下显著高于常规灌溉与传统调亏灌溉处理。从果皮颜色来看,根系干湿分区灌溉处理的葡果实颜色指数明显高于CK处理,但与RDI处理差异不显著。在前人的研究中,梁鹏曾研究报告了根系干湿分区灌溉下葡萄果实的产量不会下降。杨建昌等报告了水稻这种栽培下穗粒更为饱满。Thibaut Scholasch等研究了随着水分亏缺的增加,葡萄藤蔓开始关闭气孔(气孔导度降低)来限制蒸腾水分损失,从而导致光合作用减少。在不断增加的水分胁迫下,由于生长减缓先于光合作用的减少,更多的碳水化合物变得可用,可以分配给果实等,从而有利于浆果品质决定化合物(风味化合物、花色苷、糖含量等)的合成。结果表明,根系干湿分区灌溉方式不仅促进了果实颜色变化,还显著提升了果实糖分积累。
3.3 根系干湿分区灌溉对果实糖转化的影响
与前文提到根系干湿分区灌溉对植物库端糖分积累的差异相比,不同于水稻和小麦将糖分以淀粉形式储存在淀粉体里,甘蔗则将糖分以蔗糖的形式储存在细胞质中,葡萄果实在液泡中以葡萄糖与果糖的形式储存糖分。由于源端叶片光合产物通常以蔗糖形式将同化物通过筛管伴胞运输到库端葡萄果实。因此葡萄的糖分积累过程必定是由蔗糖转化成葡萄糖与果糖后再储存于库端的过程,并且糖分也需要通过一些方式进入液泡。对于葡萄蔗糖分解可以通过对其酶活性的测定进行研究。研究发现根系干湿分区灌溉下葡萄果实内蔗糖代谢的两种方式的糖代谢酶活性均显著上升。蔗糖在果实内通过两种方式分解。一种方式在果实细胞壁、细胞质或液泡膜中被水解为葡萄糖与蔗糖。这种方式下蔗糖受酸性转化酶与中性转化酶的影响,根系干湿分区灌溉下显著提高了蔗糖酸性转化酶的活性,而另一条途径在蔗糖合成酶的催化下,蔗糖转化为果糖与UDP-葡萄糖。蔗糖合成酶的活性在根系干湿分区灌溉处理下也显著提高,而UDP-葡萄糖还会经历一系列变化,一部分会成为葡萄糖而另一部分成为海藻糖,因此葡萄糖组分含量中果糖含量会超过葡萄糖含量。
综上所述,根系干湿分区灌溉、常规灌溉及调亏灌溉果实的糖分积累出现差异的机制可能由多种因素导致。毕竟常规灌溉处理的葡萄叶片光合作用并没有显著下降。在本次实验中,常规灌溉条件下果实的糖分含量显著低于根系干湿分区灌溉和调亏灌溉的果实糖分含量。光合速率显著下降的调亏灌溉方式的糖积累量与糖积累速率显著高于常规灌溉果实。前人报告中亏缺灌溉与根系干湿分区灌溉方式下果实内内源激素ABA含量相对常规灌溉显著提升,可能是果实糖分积累量与糖积累速率出现显著差异的原因导致的。