质量安全与营养品质评价岗
郑蔚然 徐明飞 王新全等
熊果苷(Arbutin,对-羟基苯-β-D-吡喃葡萄糖苷),又名熊果素、熊果酚苷、熊果叶苷,其是白色针状结晶物质。熊果苷具有良好的抗氧化活性,它能够抵抗过氧化氢叔丁基酯等有毒物质,并对红细胞和皮肤成纤维细胞产生保护作用[1],还具有抗炎抗菌、镇咳平喘祛痰、抗肿瘤和抑制酪氨酸酶活性等功效[2,3,4,5,6]。岩白菜、梨、蓝莓等植物源性产品中均含有熊果苷[7,8,9],因此定性定量分析植物源性产品中熊果苷的含量有助于产品本身的品质评估以及进一步开发利用。
中草药和水果中熊果苷含量的常用检测方法有高效液相色谱法(HPLC)、分光光度法、毛细管电泳安培法、高效液相色谱-串联质谱[8,9,10,11],其中分光光度法和毛细管电泳安培法存在分离效果不理想,定量不准确的问题,高效液相色谱-串联质谱使用成本较高;高效液相色谱法能够高效分离各种混合物,还可以对样品中各组分进行定量分析,并且性价比较高,深受研究人员的青睐。固相萃取技术因其具有操作简便、高效分离、富集净化和适用性广的优点,被应用于样品的前处理过程[12]。
尽管相关研究人员已经对一些中草药和水果中熊果苷含量进行了测定[13,14,15],但均只测量了单一的植物源性产品,未见有同时涵盖中草药和水果中熊果苷的检测方法。因此,有必要重新建立更为适合大多数植物源性产品中熊果苷含量检测方法。本研究采用固相萃取结合高效液相色谱技术,建立了一种测定植物源性产品中熊果苷含量的定量分析方法,与现有的类似方法相比,本研究的方法在样品前处理和适用性方面具有优势,不仅为植物源性产品的品质评估提供了科学依据,也为其深度开发利用提供了技术支持。
1. 材料与方法
1.1 仪器与试剂
Waters ACQUITY Arc高效液相色谱仪(配有Waters 2998 PDA检测器)(美国Waters公司);Oasis HLB固相萃取小柱(200 mg,6 mL,美国Waters公司)、Oasis HLB固相萃取小柱(60 mg,3 mL,美国Waters公司); SAX固相萃取小柱(500 mg、6 mL,赛默飞世尔科技(中国)有限公司)、NH2固相萃取小柱(500 mg、6 mL,天津博纳艾杰尔科技有限公司)、C18固相萃取小柱(500 mg、6 mL,天津博纳艾杰尔科技有限公司)、Plexa固相萃取小柱(200 mg、3 mL,安捷伦科技(中国)有限公司);Thermo Fisher高速冷冻离心机(赛默飞世尔科技(中国)有限公司);KS-080超声波清洗机(深圳深华泰超声洗净设备有限公司);TTL-DCⅡ型氮吹仪(北京同泰联科技发展有限公司);HSE-12B固相萃取仪(天津市恒奥科技发展有限公司)。
甲醇、乙腈、乙醇(分析纯,上海凌峰化学试剂有限公司);甲醇、乙腈、(色谱纯,德国默克股份两合公司);熊果苷(纯度不小于99%)(上海迈瑞尔化学技术有限公司)。实验中所用的样品均为市售样品。
1.2 标准溶液的配制
准确称取适量的熊果苷标准品,用10%甲醇水溶解定容,配制成0.5 mg·mL-1的标准储备液,于-18 ℃避光保存。移取适量0.5 mg·mL-1的标准储备液,用10%甲醇水稀释,配制成0.0005、0.001、0.002、0.004、0.005、0.008、0.01和0.05 mg·mL-1的标准工作液,现配现用。
1.3 样品前处理
1.3.1 高含水量样品的提取
水果洗净、擦干,切碎后进行匀浆。精确称取样品匀浆5.00 g,置于50 mL离心管中,加入20 mL纯水,涡旋1 min,超声处理20 min,8000 r·min-1离心10 min,取2 mL上清液待净化。
1.3.2 低含水量样品的提取
干燥的中草药进行粉碎,过50目筛。精确称取样品粉末5.00 g,置于50 mL离心管中,加入10 mL甲醇(分析纯),涡旋1 min,超声处理30 min,8000 r·min-1离心10 min,吸取上清液,再加入10 mL甲醇(分析纯),涡旋1 min,超声处理30 min,8000 r·min-1离心10 min,吸取上清液,将两次吸取的上清液置于50 mL离心管中混匀,取混匀后的3 mL上清液置于10 mL离心管中,50 ℃氮吹至近干,用3 mL水复溶,涡旋1 min,8000 r·min-1离心10 min,取2 mL上清液待净化。
1.3.3 高、低含水量样品的净化
依次用3 mL甲醇和3 mL纯水活化HLB固相萃取小柱,活化完成后取1.3.1和1.3.2中离心后的2 mL上清液作为上样液,经HLB固相萃取小柱萃取净化,用20%甲醇水洗脱,收集洗脱液,过0.22 μm亲水性滤膜,进行HPLC测定。
1.4 色谱条件
色谱柱为Waters XSelect HSS T3色谱柱(250 mm×4.6 mm,5 μm);检测波长:282 nm;进样体积20 μL;体积流量0.8 mL·min-1;柱温30 ℃;流动相A为水,流动相B为甲醇,梯度洗脱时间程序见表1。
2. 结果与讨论
2.1 仪器检测方法的条件优化
采用Waters 2998 PDA检测器,在190~400 nm波长范围内对熊果苷标准工作液进行光谱扫描,结果表明检测波长为282 nm时熊果苷的响应最佳,所以检测波长设置为282 nm。选择4种规格皆为250×4.6 mm, 5.0 μm的色谱柱Agilent ZORBAX SB-C18、Waters Xselect HSS T3、Waters Xterra MS C18和Agilent TC-C18对熊果苷进行检测,比较不同色谱柱下熊果苷的检测效果。四种色谱柱的对于熊果苷的检测效果接近,但是Waters Xselect HSS T3柱可耐100%水相,而流动相体系中水相占据大多数,所以选择Waters Xselect HSS T3柱作为实验所用色谱柱。通过比较不同柱温和不同流速下熊果苷的检测效果,柱温为30 ℃和流速为0.8 mL/min时熊果苷检测效果最佳,所以将柱温设置为30 ℃,流速设置为0.8 mL·min-1。
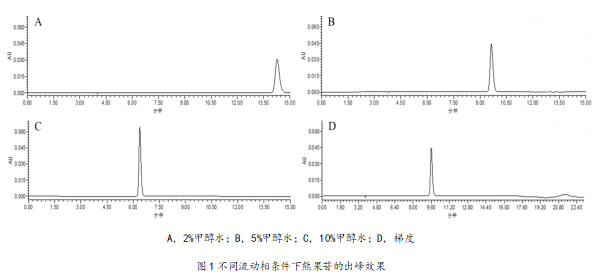
随后对流动相条件进行优化,选择4种流动相比例洗脱条件(A:水,B:甲醇):1、A:B=98:2, 15 min; 2、A:B=95:5, 15 min; 3、A:B=90:10, 15 min; 4、梯度(0~12 min, 5%~5%B; 12~15 min, 5%~30%B; 15~17 min, 30%~80%B; 17~20 min, 80%~5%B; 20~23 min, 5%~5%B)对熊果苷进行检测,比较不同流动相条件下熊果苷的检测效果。有机相和水相不同比例条件下熊果苷的检测效果如图1所示,4种流动相条件下熊果苷峰形较好、无明显拖尾现象、峰面积接近,峰高和保留时间不同,但梯度条件下逐步增加有机相的浓度,可以避免色谱柱受到极端条件的长期影响,还有助于在分析过程中对色谱柱进行有效清洗,去除残留的组分和杂质,有利于延长色谱柱的使用寿命,所以流动相条件最终选择梯度条件。
2.2 前处理方法的条件优化
2.2.1 提取条件的优化
水果果肉中含水量一般在80%以上[16],即水果为高含水量样品,市售药材一般经过干燥处理后含水量在10%左右[17],干燥后的中草药为低含水量样品。用早酥梨肉和覆盆子分别进行高含水量样品和低含水量样品提取条件的优化,常见的熊果苷提取溶剂有乙醇、水和甲醇[15,18,19],因此分别加入20 mL纯水、甲醇、乙腈和乙醇对早酥梨肉和覆盆子中的熊果苷进行提取,每种3个平行,在早酥梨肉样品中,4种提取溶剂所提取的熊果苷含量分别为87.30、87.50、75.97、80.92 mg·kg-1,乙腈和乙醇作为提取溶剂时提取的熊果苷含量较低,甲醇和水提取的熊果苷含量接近,但是水果样品含水量高,5 g水果样品中有4 mL左右的水,并且水作为提取溶剂时性价比更高,所以高含水量样品最终选择水作为提取溶剂。
在覆盆子样品中,4种提取溶剂所提取的熊果苷含量分别为11.51、13.34、9.08、12.52 mg·kg-1,甲醇作为提取溶剂时所提取的熊果苷含量最高,并且甲醇渗透性好,有利于低含水量样品中熊果苷的提取,所以低含水量样品选择甲醇作为提取溶剂。但是低含水量样品在后续加标回收过程中加入标液后样品粉末易结块导致加标回收率偏低,高、中、低(100、10、1 mg·kg-1)三个浓度加标后回收率均只有30%左右,故将提取方式改成使用20 mL甲醇进行两次提取,提取方式改良后低含水量样品加标回收率均达到80%以上,符合实际检测需求。
2.2.2 固相萃取条件的优化
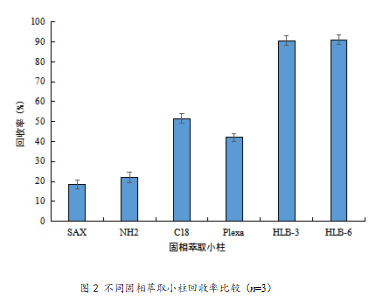
高含水量样品和低含水量样品只在提取条件上有区别,固相萃取条件一致,因此选择熊果苷含量更高的早酥梨肉样品作为优化固相萃取条件的阳性样品。选择SAX(500 mg、6 mL)、NH2(500 mg、6 mL)、C18(500 mg、6 mL)、Plexa(200 mg、3 mL) 、HLB-3(60 mg、3 mL)和HLB-6(200 mg、6 mL)固相萃取小柱对早酥梨肉样品离心后的水溶液进行净化,将洗脱流出液进样,比较不同固相萃取小柱对早酥梨肉样品净化后的熊果苷回收率。6种不同固相萃取小柱的回收率比较如图2所示(n=3),回收率分别为18.50%、22.08%、51.55%、42.07%、90.62%、91.11%,SAX、NH2、C18和Plexa固相萃取小柱的回收率均不足60%,HLB-3和HLB-6固相萃取小柱的回收率均达到了90%以上,但是HLB-3固相萃取小柱的价格相较于HLB-6固相萃取小柱更加便宜,所以选择HLB-3固相萃取小柱进行样品提取液的萃取净化。
样品上样液过柱后增加淋洗步骤,用水淋洗完HLB固相萃取小柱后熊果苷回收率只有75%左右,因此不对HLB固相萃取小柱进行淋洗。随后对上样液体积和洗脱溶剂进行优化,每种3个平行,上样液体积为2、4、5 mL时,熊果苷回收率分别为89.71%、78.42%、69.46%,上样体积为2 mL时熊果苷回收率最高,所以上样体积选择为2 mL,洗脱溶剂分别为10%、20%、30%甲醇水时,熊果苷回收率分别为82.39%、90.87%、90.90%,20%和30%甲醇水的熊果苷回收率接近,但是甲醇比例增加后可能易将杂质洗脱下来,因此洗脱溶剂选择为20%甲醇水。
2.3 方法学验证
2.3.1 线性关系、检出限和定量限
取1.2节标准工作液进行检测。以熊果苷色谱峰面积为纵坐标,对照溶液的浓度为横坐标,由峰面积(Y)对溶液浓度(X)线性回归,得线性方程y= 10599288x-1083.4,得出相关系数为0.9998,线性范围为0.0005~0.05 mg·mL-1。由熊果苷的回归方程及相关系数可以得出熊果苷在浓度范围内呈现良好的线性关系。对空白样品进行加标,按1.3节方法处理加标样品,对样品溶液逐级稀释并进样检测直至信噪比(S/N)分别为3和10时,确定熊果苷的检出限 (LOD)和定量限(LOQ),熊果苷的检出限为0.3 mg·kg-1和定量限为1.00 mg·kg-1。
2.3.2 回收率和精密度
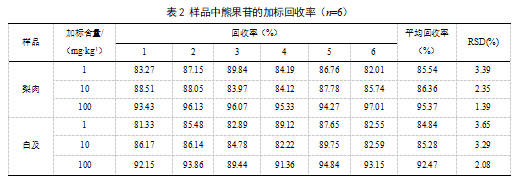
本实验选择了梨肉、白及作添加回收率试验的样品,进行1、10、100 mg·kg-1三种水平的添加回收率试验,每种处理6个平行。结果表明,添加回收率范围在81.33%~97.01%,相对标准偏差(RSD)均小于3.65%(表2),反映本标准方法具有良好的准确性,能满足实际检测需要。
2.4 与文献报道方法的比较
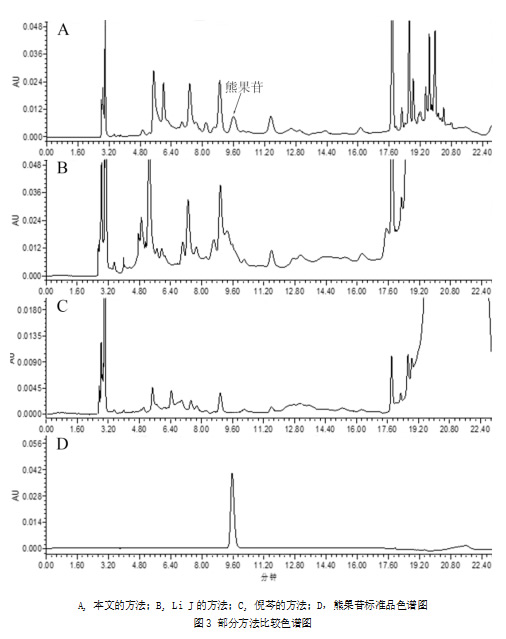
将本方法与不同文献中检测熊果苷的方法进行对比,样品统一使用本文所使用的样品,文献中原先检测样品为低含水量样品用覆盆子代替,高含水量样品则用早酥梨肉代替,称样量统一为1 g。检测结果如表3(n=3)所示,本文的方法测得覆盆子和早酥梨肉中熊果苷含量最高,使用倪芩[12]和Li J[18]的方法并未在覆盆子中检测到熊果苷,Li J的方法、倪芩的方法和本文方法所得出的覆盆子样品色谱图如图3所示,由图3A和图3B、3D比较可知,Li J方法的覆盆子色谱图中熊果苷色谱峰被杂质所包裹,可能是未使用固相萃取柱对覆盆子样品进行净化导致熊果苷未被检出,由图3A和图3C、3D比较可知,倪芩方法的覆盆子色谱图在保留时间内并未出现熊果苷色谱峰,可能是倪芩方法中添加较多提取溶剂导致(料液比为1:100 g·mL-1)熊果苷含量过低,并且倪芩的方法中也未使用固相萃取柱对样品进行净化,不利于样品中熊果苷的检测,表明倪芩和Li J的方法不适用于覆盆子样品的检测;使用郑迎春[21]的方法也未能在覆盆子中检测到熊果苷,通过郑迎春和张小双[21]的方法对比可知,郑迎春的方法中添加提取溶剂过多(料液比为1:150 g·mL-1),导致熊果苷的含量低于检出限,并且郑迎春和张小双的方法中均用水对HLB固相萃取小柱进行淋洗,由2.2.2可知用水淋洗HLB固相萃取小柱会造成部分熊果苷损失,表明郑迎春和张小双的方法仍然存在着不足之处;由2.2可知,乙醇的提取得率不如甲醇,并且早酥梨肉样品经C18柱净化后熊果苷回收率低于60%,上述两个原因导致李丽梅[14]的方法所提取的熊果苷含量偏低,杨淑霞[22]的方法提取得率虽然比李丽梅的方法高,但其方法未使用固相萃取柱,对于检测其他样品可能存在熊果苷被杂质包裹的情况,进而导致熊果苷无法检出。
其他文献中报道的检测熊果苷的方法具有一定的不足之处,存在着未使用固相萃取柱、提取溶剂体积添加过多的问题,导致出现不能从样品中检测出熊果苷、提取的熊果苷含量偏低的情况。本文所建立的熊果苷检测方法能够很好的适应不同样品的检测需求,在样品前处理方面比其他方法更具优势,具有应用范围广、准确度高的特点。
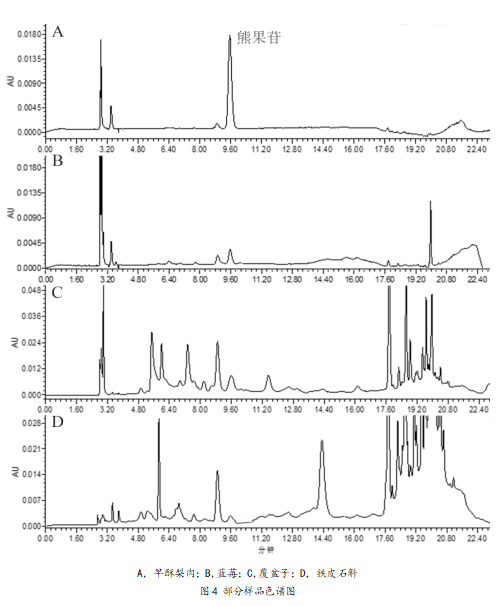
2.5 实际样品检测
将建立的方法应用于实际植物源性产品中进行熊果苷的检测,水果和中草药中测定熊果苷的含量见表4(n=3),部分阳性样品色谱图见图4。水果中梨和蓝莓有熊果苷检出,而苹果、葡萄、草莓和桃子等水果均未有熊果苷检出,中草药中白及、覆盆子和铁皮石斛有熊果苷检出。已检测的植物源性产品中早酥梨肉熊果苷含量为87.7 mg·kg-1,该含量与张小双[22]检测早酥梨肉中熊果苷含量(80.0 mg·kg-1)接近。水果中梨和蓝莓含有熊果苷,增加了梨和蓝莓的营养价值,可为梨和蓝莓的品质评估和相关产品开发提供基础,覆盆子、白及和铁皮石斛中含有熊果苷则可以提升其药用价值,提高其市场竞争力。

3. 结论
本文通过仪器检测方法和前处理条件方法的优化建立了一种植物源性产品中熊果苷的固相萃取-高效液相色谱检测方法。该检测方法在0.0005~0.05 mg·mL-1范围内线性关系良好,相关系数为0.9998;熊果苷按照1、10和100 mg·kg-1水平添加,熊果苷在梨肉中回收率为82.01%~97.01%,RSD为1.39%~3.39%,在白及中回收率为81.33%~94.84%,RSD为2.08%~3.65%,熊果苷在样品中的检出限0.3 mg·kg-1,定量限1.0 mg·kg-1,证明该方法具有较高的精密度、准确度。通过与其他文献报道方法对比,本方法在前处理方面具有优势,还具有适用范围广、准确度高的特点。该方法成功应用于苹果、梨、蓝莓等水果,元胡、覆盆子、白及等中草药中熊果苷的检测,可以为植物源性产品中熊果苷含量的检测提供技术支持。