育种方法与技术岗位
葡萄常规的遗传转化体系需较长时间且效率低,瞬时转化表达系统相比较稳定遗传转化系统具有简单、便捷、实验周期短等优势,表达时间一般维持在一周左右,适用于不易再生的植物研究。因此本方法以葡萄组培苗为材料,利用根癌农杆菌介导建立葡萄整株瞬时转化技术,为后续葡萄基因功能研究奠定基础,具体方法如下:
1、试验材料与试剂。
(1)挑选生长健壮且生长势较一致的5周苗龄的无核白组培苗为试验材料;该实验使用的根癌农杆菌菌株为GV3101,植物载体为pHB;实验中主要用的药品包括LB培养基、硫酸卡那霉素、利福平、MES、氯化镁、乙酰丁香酮、SilwetL-77等。
2、实验步骤。
(1)农杆菌活化:使用LB固体抗性培养基(含卡那霉素、利福平)进行菌株划线,于28℃培养箱中倒置培养16 h-20 h;随后挑取单克隆于500 μl LB液体抗性培养基中,于28℃摇床中培养12 h左右,转速为200 rpm;初次活化后,吸取100 μl菌液接入200 ml LB液体抗性培养基中,于28℃摇床中培养12-16 h左右至OD600 0.8-1.0。
(2)农杆菌收集及侵染菌液制备:将菌液置于50 ml离心管中,6000 rpm离心10 min,弃上清。MES缓冲液(10 mM MES,10 mM MgCl2,100 μM乙酰丁香酮)调整菌液OD600至0.5,根据最终菌液体积按照4:1添加SilwetL-77,随后菌液于避光条件下静置2-3 h。
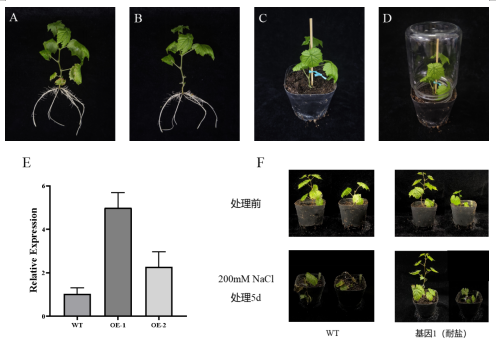
(3)幼苗准备:挑选生长健壮且生长势较一致的5周苗龄组培苗(图A),将其从培养基中取出后,修剪茎底部叶片(图B)。
(4)根癌农杆菌介导的瞬时转化:葡萄叶片的蜡质层较厚,因此需要采用真空渗透的方法对葡萄组培苗进行瞬时转化。将葡萄组培苗倒置于玻璃瓶中,将重悬的农杆菌菌液浸没植株,真空-0.1 Mpa,渗透10 min,重复2次,期间可观察葡萄叶片是否呈现半透明状。
(5)侵染植株培养:将农杆菌真空渗透侵染的葡萄植株栽培于土壤中,用竹签固定根上部(图C),使用塑料瓶倒扣组培苗维持植株高湿环境(图D),置于室温条件下弱光共培养4天后,进行取样并开展后续实验。
(6)转化植株qPCR阳性验证:采用CTAB法提取葡萄叶片RNA,利用DNase I消化RNA中残留的DNA,随即将RNA反转录成cDNA。以稀释20倍的cDNA为模板进行qPCR验证(图E,将侵染了pHB空载的植株作为对照)。
(7)转化植株的非生物胁迫处理(盐胁迫处理):配置200 mM NaCl溶液对植株进行胁迫处理,置于温度25℃、光照时间16 h/d的环境中培养,观察并记录胁迫情况(图F)。