病虫害防控研究室
任芳 董雅凤 范旭东 胡国君
葡萄卷叶病是葡萄上的一类重要病害,在世界范围内普遍发生,给葡萄生产造成很大危害。该病害由多种葡萄卷叶伴随病毒引起,葡萄卷叶相关病毒1(Grapevine leafroll-associated virus 1,GLRaV-1)是葡萄卷叶病的重要病原之一。葡萄卷叶病的主要传播途径是通过带毒繁殖材料在全球范围内的交换和传播,从而导致其在全球范围内的广泛分布。因此,繁育和种植无病毒苗木是防控葡萄卷叶病的重要手段,病毒检测是葡萄无病毒苗木繁育和推广的关键环节。实时荧光定量RT-PCR(RT-qPCR)检测技术特异性强、灵敏度高,已在多种果树病毒检测上得到广泛研究和应用,本实验室通过引物筛选和体系优化,建立了GLRaV-1的RT-qPCR检测技术体系,为进一步提高葡萄病毒检测准确度和检测效率提供技术支撑。
1 试验材料与仪器设备
1.1 样品采集
分别在春夏秋季采集葡萄植株上部嫩叶、嫩叶柄、下部老叶、老叶柄、卷须和枝条等6个部位样品,冬季采集休眠枝条。
1.1 主要仪器与试剂
实时荧光定量PCR仪为CFX ConnectTM Real-Time System(BIO-RAD,美国)。主要试剂10 × PCR Buffer、dNTPs、Taq酶、DNA Marker DL2000、反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser 和Escherichia coli DH5α感受态购自大连宝生物公司(TaKaRa);2×SYBR Green qPCR Mix、pTOPO-TA载体、胶回收试剂盒购自北京艾德莱生物有限公司。
2 检测方法
2.1 总RNA 提取
采用吸附柱法提取总RNA:(1)刮取葡萄休眠枝条韧皮部样品约50 mg,放入塑料袋中,加入1 mL提取液研磨;匀浆转入事先加入NLS的离心管中,70℃保温10分钟,冰上放置5分钟,13000 rpm,离心15分钟;(2)取上清液600 μL,加入300 μL无水乙醇,颠倒混匀45秒,混合液加入吸附柱中,12000rpm离心1分钟,弃掉废液;(3)加入700 μL去蛋白液,室温放置2分钟,12000 rpm离心1分钟,弃掉废液;(4)加入700 μL清洗液,12000 rpm离心1分钟,弃掉废液;再加入500 μL清洗液,12000 rpm离心1分钟,弃掉废液;将吸附柱放回空收集管中,12000 rpm离心2分钟,弃掉废液;(5)取出吸附柱,放入新的离心管中,加50 μL DEPC水,室温放置1分钟,12000 rpm离心1分钟,所得RNA溶液–70℃超低温保存备用。
2.2 反转录合成cDNA
采用去除基因组DNA反转录方法(PrimeScriptTM RT reagent Kit with gDNA Eraser,Takara):取5× gDNA Eraser buffer 2.0 μL,gDNA Eraser 1.0 μL,总RNA 1.0 μL混匀,42.0 ℃ 2 min;加入以下混合液:PrimeScript RT Enzyme MixⅠ 1.0 μL,RT Primer Mix 1.0 μL,5× PrimeScript buffer 2 4.0 μL,RNase Free dH2O 4.0 μL;37 ℃ 15 min,85 ℃ 5 s,–20 ℃保存备用。
2.3 检测引物
根据文献报道和序列分析,选择3对GLRaV-1引物L1-QF1/R1、L1-QF2/R2、L1-QF3/R3(表1)作为RT-qPCR候选检测引物。采用3对引物分别对疑似携带GLRaV-1的葡萄样品进行RT-qPCR检测,根据检测特异性和灵敏度选择最佳引物。PCR扩增产物回收克隆转化,阳性克隆测序验证。

2.4 检测体系
RT-qPCR反应体系25 L,含2× SYBR GreenⅠqPCR Mix12.5 μL、正反向引物各0.25 ~ 1.25 μL、cDNA 1 μL、DEPC水补足至25μL。反应条件:95℃预变性3 min;95℃ 15 s,54~64℃15 s,72℃ 20 s,40个循环,熔解曲线60~95℃,每5 s增加0.5℃。以10-1倍稀释的cDNA作为模板。分别在54.0、54.7、56.0、57.9、60.4、62.3、63.5和64.0 ℃等退火温度进行RT-qPCR扩增,筛选最佳退火温度;分别采用50、100、200、300、400和500 nmol/L引物浓度进行RT-qPCR扩增,筛选最佳引物浓度。
3 结果与分析
3.1 检测引物筛选
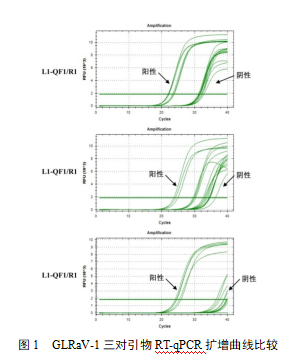
分别在7、8、9月采集2株疑似携带GLRaV-1的葡萄嫩叶、嫩叶柄、老叶、老叶柄、卷须和枝条等组织部位共36个样品,采用3对候选引物进行RT-qPCR检测比较。结果表明,引物L1-QF3/R3扩增阳性样品Cq值较低,阴性样品无假阳性,扩增效果最好(图1)。并且检出样品数最多,检出率55.6%(20/36)。L1-QF3/R3扩增产物回收并克隆测序,获得序列为GLRaV-1目标序列,表明扩增片段正确。因此,最终选择L1-QF3/R3作为检测引物。
3.2 RT-qPCR检测体系优化
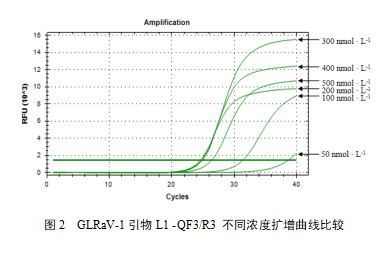
引物L1-QF3/R3不同退火温度扩增结果表明,57.9℃扩增曲线Cq值较低、相对荧光强度较强,综合扩增效果最好,因此选择58℃作为L1-QF3/R3最佳退火温度。不同引物浓度扩增结果表明,300 nmol/L浓度扩增Cq值较低,相对荧光强度较强强,且扩增阴性对照和水对照无扩增峰为阴性,因此选择300 nmol/L作为引物L1-QF3/R3最佳引物浓度(图2)。
3.3 RT-qPCR检测田间葡萄样品
利用所建立的GLRaV-1 RT-qPCR技术对不同时间和部位采集的50个‘贵人香’田间葡萄样品进行检测,并与常规RT-PCR检测结果进行比较。结果表明常规PCR仅18个样品检测为阳性,检出率36%,RT-qPCR有35个样品检测为阳性,检出率70%,明显高于常规RT-PCR(表2)。

4 小结
根据体系优化及田间样品检测验证结果,最终确立GLRaV-1的RT-qPCR检测体系:反应体系25μL,包含2× SYBR GreenⅠqPCR Mix12.5 μL、cDNA 1 μL、DEPC水10μL,正反向引物各0.75μL。反应条件:95℃预变性3 min;95℃ 15 s,58℃15 s,72℃ 20 s,40个循环,熔解曲线分析温度60~95℃,每5 s增加0.5℃。对不同时间和部位田间葡萄样品检出率70%,高于常规RT-PCR。