石家庄综合试验站
设施栽培可以提早成熟、降低病虫危害、改善品质,在果树生产上得到广泛应用。近年来,我国设施葡萄产业发展迅速,形成以避雨栽培为主,促早与延后为辅的多种生产模式。然而设施生产中,常因覆盖物使得设施内部光照减弱,一些红色品种或黑色品种出现上色困难、着色不良的现象。现有研究表明,行间覆盖反光膜有调控周边微环境、改善内膛光照、提高果实品质等效果,在葡萄生产上有较高的应用价值。成果等研究表明铺设反光膜能增强野酿2号果际光照强度,提高果际的光合总辐射,还能降低果际的昼夜温差、昼夜温湿度等微环境,从而提高果实的可溶性固形物与花色苷含量,提升浆果品质。李志强等研究表明覆膜可改善根际与行间的土壤含水量,促进N、P、K的吸收,提高葡萄叶片净光合速率,促进葡萄植株生长与果实品质提升。王立如等研究表明,葡萄花后20d至成熟期间在葡萄架下铺设反光膜可有效改善叶幕的光照条件,提高果实花色苷与可溶性固形物含量,从而提高品质。
铺设反光膜改善果实品质已有较多报道,但尚缺乏反光膜影响果实着色的机制探讨。本研究以京艳葡萄为试材,在转色前期铺设反光膜,并选取关键时期进行转录组测序。系统研究与花色苷合成、转运相关基因的表达模式,筛选可能参与调控的关键转录因子,充分明晰反光膜促进花色苷积累的调控机理,为生产上反光膜的使用奠定理论依据。
1 材料和方法
1.1 材料及其处理
试验于2022年6月在河北省农林科学院石家庄果树研究所葡萄示范园塑料大棚内进行。试验树为5年生的京艳葡萄,株行距5m*2.2m,高干T型架,V型叶幕。果园土壤均为砂壤土,试验期间果园日常管理(挂果量、肥水)保持一致。反光膜为铝制材料,宽1.5m,厚0.02mm,超强增色反光膜(山东青岛,鸿盛果袋反光膜工厂)。
覆膜时间为6月10日,延行向分别在树的两侧铺设反光膜。每2株葡萄植株作为1组,设3次重复,不铺膜为对照(CK)。铺设时每隔1~2 m用砖头压实。另外,铺设反光膜时,在距葡萄植株根部两侧0. 2m留出走道以免踩踏,也利于田间管理。
1.2 光合指标测定
于覆膜10 d后,在晴天上午10:00左右测定反射光强度与叶片的光合能力。使用照度计测定膛内的反射光强度(LX)测定高度为1.2m,距树干两侧0.4m。使用便携式光合测定仪Li-6400测定葡萄结果枝中下部的成熟叶片净光合速率Pn(µmol/m-2·s-1),每个处理选择9片葡萄叶片进行测定。
1.3 果实糖酸指标测定
果实成熟期,采集成熟度一致的葡萄果实,每处理采集10穗,随机从果穗上、中、下剪取果粒100粒,液氮速冻后,-80℃冰箱保存备用。果实中的可溶性糖、酸物质利用液相色谱仪测定,使用外标法定性定量。
1.4 覆膜对花色苷的转录组分析
1.4.1 样品采集
2个处理果实于处理0d(青果)、7d(转色初)、14d后采集。每处理每次采样100粒果实,注意兼顾果穗的上、中、下各部位,随机选取30粒作为一个重复,设3次重复。剥取果皮,检测花色苷含量。余下锡箔纸包裹,液氮速冻后-80℃保存。
1.4.2 RNA提取与质量检测
采用天根磁珠法植物总RNA提取试剂盒提取各样品的RNA。1%琼脂糖凝胶电泳与Nanodrop 2000分光光度计检测RNA的浓度及纯度,Agilent Bioanalyzer 2100检测RNA的完整性。
1.4.3 转录组测序
将提取的样本总RNA送至上海派森诺生物科技有限公司测序并进行文库构建。采用Illumina Novaseq 6000平台对质量合格的文库进行测序。测序得到的图像文件经平台自带软件进行转化,生成FASTQ的原始数据(Raw Data)。去除原始数据中带有接头序列的与低质量的Reads,得到Clean Reads。下载葡萄参考基因组的序列文件和注释文件(http://plants.ensembl.org/Vitis_vinifera),使用HISAT2软件将Clean Reads与葡萄参考基因组进行比对分析。
1.4.4 差异基因的筛选与功能注释
利用HTseq进行表达水平评估,并采用FPKM值对各处理表达值进行标准化。使用DESeq软件(1.20.0)进行样品组间的差异表达分析。筛选差异表达基因条件为:|log2FC| > 1且P-value<0.05。使用topGO对差异表达基因进行GO富集分析并计算P-value,显著富集标准为P-value < 0.05。使用cluster Profiler(3.4.4)软件进行KEGG 通路富集分析,显著富集标准为P-value < 0.05。
1.4.5 基因荧光定量PCR验证
选取12个差异表达基因,葡萄Actin作为内参基因,以测序同批次采集样品的cDNA为模板,使用ChamQ Universal SYBR qPCR Master Mix(诺唯赞,上海)进行PCR扩增。qPCR 体系为:cDNA模板3.5μL,上下游引物各0.4μL,Mix10μL,ddH2O 5.7μL。qPCR程序为:95℃预变性2min,95℃变性15s,60℃延伸1min,共循环40次,反应结束后分析溶解曲线,每个样品重复3次。基因的相对表达量按ABI7500荧光定量仪使用说明进行分析。使用Origin 9.0软件进行数据分析。
2 结果与分析
2.1 反光膜对光强、净光合速率的影响
由表1可知,铺设反光膜后,CK与反光膜处理(RF)膛内光照强度分别为5635和8345LX,反光膜处理是CK的1.48倍,二者差异显著;叶片的净光合速率也呈现显著提升,增幅为41.1%。结果表明,铺设反光膜能改善葡萄膛内的光照条件,提高葡萄叶片的光合能力。

2.2 反光膜对果实糖酸的影响
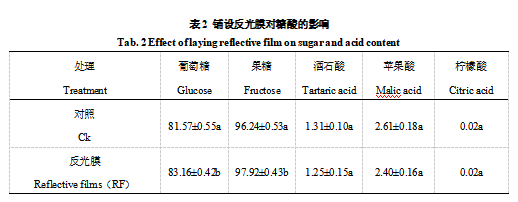
由表2可知,京艳果实糖分物质主要是葡萄糖,果糖。其中果糖含量相对较高,属高果糖型。酸物质中,以苹果酸含量最多,酒石酸次之。铺设反光膜对葡萄果实糖、酸物质有显著影响。铺设反光膜的葡萄果实的可溶性糖(葡萄糖、果糖)含量分别较对照有不同程度的增加,且差异显著。酸物质含量降低,但处理之间差异并不显著。
2.3 反光膜对果实花色苷的影响
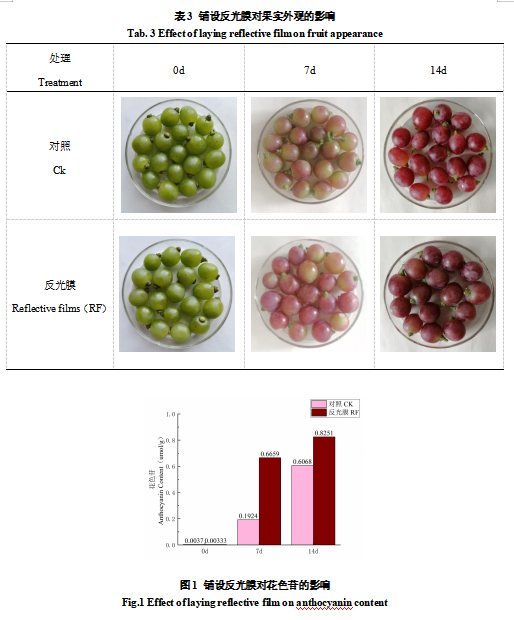
随着果实成熟,果皮的着色加深。由表3所示,铺设反光膜7d时,果实已出现明显的外观变化,覆膜14d时,果皮外观差异程度减小。由图1表明,覆膜7d后葡萄果皮花色苷含量由0.0033umol/g迅速升至0.6659umol/g,是对照(0.1924umol/g)的3.46倍;覆膜14d后葡萄果皮含量升至0.8251umol/g,是对照(0.6068umol/g)的1.37倍。综上所述,铺设反光膜能加速花色苷的积累,提早着色。
2.4 反光膜处理的转录组测序
2.4.1数据质量评估
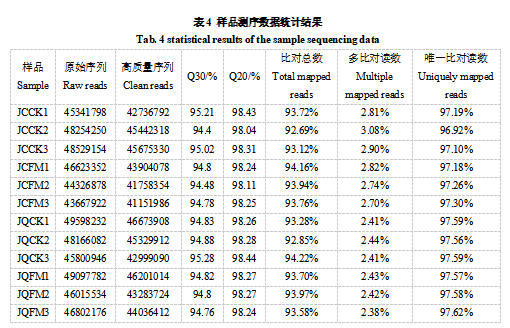
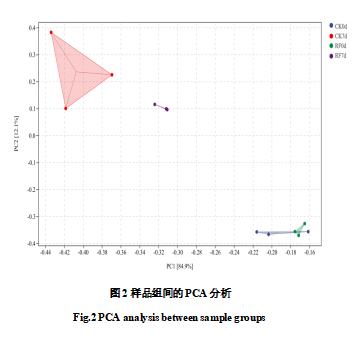
为探究反光膜促进着色的调控机制,将0d与7d的12个样品进行了转录组测序。由表4可知,转录组测序后12个样品分别获得43667922~49598232条原始数据(Raw read)。除去接头序列与低质量的序列后,可得41151986~46673908条Clean Reads。各个样品的N碱基含量均为0,且Q30都在94%以上、Q20在98%以上,可确定测序质量较高,符合进一步的生物信息学分析。将各个样品的Clean reads与葡萄参考基因组比对分析,比对效率在92.69%~94.22%,且比对到唯一位置的reads在96%以上。基于表达量的PCA分析(图2)显示组间存在明显分离,组内重复良好。
2.4.2 差异表达基因的筛选
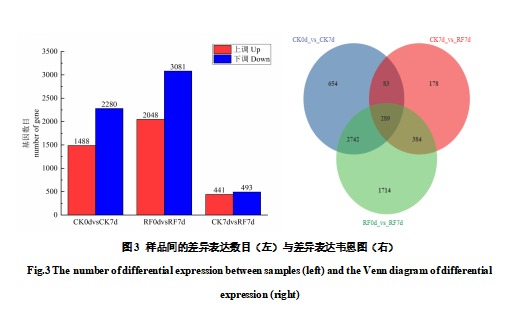
样品进行基因差异表达统计分析,结果如图3所示,CK0d-CK7d差异表达基因数目是3768个,上调基因1488个,下调2280个;覆膜后RF0d-RF7d的差异表达基因的数目是5129个,其中上调表达2048个,下调表达3081个。由此可知,覆膜能够促进基因的差异表达。覆膜7d后,与对照相比,获得934个差异表达基因,上调表达441个,下调表达493个。韦恩图表明,3个比较组共有差异表达基因289个,推测极有可能与覆膜调控花色苷积累的分子机制有关。
2.4.3 差异表达基因的kegg富集分析
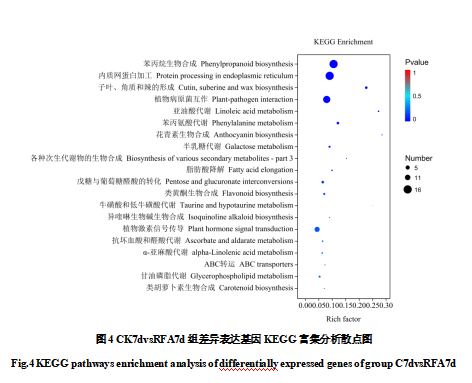
为研究反光膜处理相关差异基因的生物学功能,将CK7d-RF7d的差异基因进行KEGG富集分析。结果显示(图4),在934个DEGs中,共有179个被注释到64条信号通路上,主要富集在代谢、细胞过程、环境信息处理、遗传信息处理和生物系统5大类代谢途径。其中,53条参与代谢进程,2条参与细胞进程,5条参与遗传信息处理,3条参与环境信息处理进程,1条参与生物系统进程。依据p-value值与富集因子大小,取前20个显著富集的代谢途径,主要集中在苯丙烷生物合成(16个DEGs)、内质网蛋白加工(16个DEGs)、植物病菌互作(14个DEGs)、植物激素信号传导(10个DEGs)。
植物体内花色苷的合成大致分为苯丙烷代谢途径、类黄酮合成途径、花青素合成三个阶段。其中苯丙烷代谢途径中,编码苯丙氨酸解氨酶PAL的转录本(VIT_06s0004g02620、VIT_08s0040g01710与VIT_16s0039g01360)显著上调,编码4-香豆酸--CoA连接酶(4CL)的转录本(VIT_11s0052g01090)显著上调;类黄酮合成途径中,编码黄烷酮-3-羟化酶(F3H)的转录本(VIT_18s0001g03430、VIT_03s0063g01310)显著上调;花青素合成通路中,编码花青素3-O-葡糖基转移酶(3GT)的转录本(VIT_11s0052g01580、VIT_06s0009g01990)显著上调。
植物激素对植物的生长发育具有显著的调控作用,同样影响植物体内花色苷的合成。植物激素信号传导通路中,DEGs主要富集于生长素相关的通路,尤其是编码生长素响应蛋白(IAA3、IAA27、IAA13)的4个转录本(VIT_18s0001g03540、VIT_11s0016g03540、VIT_09s0002g04080、VIT_05s0049g01970)均呈显著下调。另外,乙烯受体ERT的转录本VIT_06s0004g05240表达上调。
2.4.4 相关转录因子分析
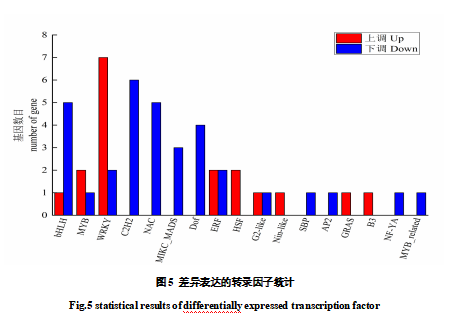
转录因子是转录调控的核心功能蛋白,在植物的发育过程中起主要的调控作用,在果实花色苷的生物合成也充当重要角色。在覆膜处理下,葡萄果皮共有51个转录因子基因差异表达,其分别隶属于17个转录因子家族。差异表达最多的转录因子是WRKY家族,以上调表达为主。其次是bHLH、C2H2、NAC、MIKC-MADS、Dof等,多是下调表达。另外,MYB转录因子是参与花色苷生物合成最广泛、最关键的转录因子之一,覆膜处理致使果皮中MybA3、Myb4基因上调表达,Myb24基因下调表达。
2.4.5 qRT-PCR验证
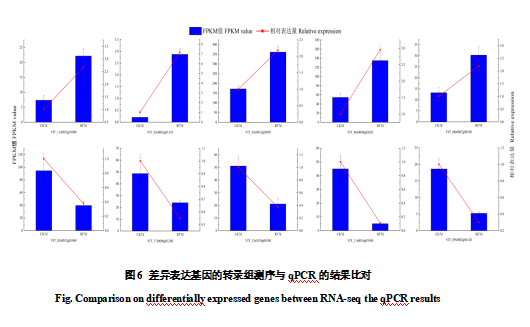
选取10个DEGs进行qRT-PCR验证。与转录组测序相比,10个DEGs的表达趋势一致。其中,覆膜处理下VIT_06s0004g02620(PAL)、VIT_11s0052g01090(4CL)、VIT_03s0063g01310(F3’H)、VIT_11s0052g01580(3GT)等色素合成相关基因的表达出现显著上调。转录因子VIT_02s0033g00450(MYBA3)表达上调,其余差异转录因子呈下调表达的趋势。综上所述,qRT-PCR试验结果与RNA-seq数据一致性良好,表明转录组测序结果可信度高,能作为发光膜促进葡萄着色机理研究的基础数据进行分析。
3 讨论
设施栽培逐渐成为葡萄栽培的重要形式,但因棚膜对自然光线的阻挡,内部光照明显低于露地,光合作用受阻。花色苷的生物合成是依赖光照进行的反应过程,弱光影响花色苷的合成与积累。现有研究表明,铺设反光膜能改善果园下部的光照,有利于中下部叶片与果实的光合作用,提高花色苷的形成与积累,加速葡萄转色。本研究中,覆膜后显著提高了内膛的光照强度与叶片的光合能力,果皮花色苷合成提前,积累更高,颜色更浓。同时,覆膜能显著提升果实的可溶性糖物质含量,但酸物质差异并不显著。
有学者认为反光膜促进着色主要通过以下两种潜在的途径进行:一是反光膜能提高冠层的光合能力与果实对干物质的吸收,从而间接加速花色苷的合成;二是通过提高苯丙氨酸解氨酶(PAL)的活性,加快UFGalT等相关基因的表达,从而促进花色苷合成。苯丙氨酸解氨酶(PAL)是花青苷合成途径中重要酶之一。李云萍等研究表明PAL酶活性越高,花青素的含量越高,甘薯组织着色也较深,呈正相关的线性关系。Chen等在茶树中鉴定出7个CsPAL基因,发现CsPAL4与茶树不同花青素的积累呈高度正相关。同时,PAL酶是重要的光调节酶,酶的含量与活力受到光照的调节。本研究中KEGG富集分析结果显示,差异表达基因显著富集于苯丙烷合成与苯丙氨酸代谢途径,其中编码苯丙氨酸解氨酶PAL的转录本(VIT_06s0004g02620、VIT_08s0040g01710与
VIT_16s0039g01360)表达显著上调,表明覆膜处理改善了光照条件,显著提高了PAL基因表达,正向促进花色苷合成与积累过程,使果皮色泽显现更快速且明显。
糖基转移酶是调控花青素苷合成最后一步的酶,主要负责花青素苷的糖基化过程,从而形成结构相对稳定的花色苷。其中研究最广泛的UDP-葡萄糖:花青素-3-O-葡萄糖基转移酶(3GT)。有研究显示,3GT的表达活性与花色苷的积累呈显著的正相关,例如在荔枝、葡萄风信子、箭叶淫羊藿中,花色苷大量积累的部位同样检测到3GT高表达,而积累少或无花色苷的部位,表达量极低或不表达。本研究中覆膜处理下,3GT的转录本
(VIT_11s0052g01580、VIT_06s0009g01990)显著上调表达,暗示覆膜处理提高了3GT酶的活性,促进花色苷的积累。
转录因子参与植株发育的各种信号传导与代谢合成途径,在花色苷合成、转运中也发挥重要作用。目前,研究最广泛的是MYB、BHLH、WD40家族及其三元复合体实现对花青苷合成的精准调控。在葡萄中,独特的R2R3-MYB转录因子与花青素合成的调控有关,其中有多个MYB基因(MYBA1、MYBA2、MYB5a、MYB5b、MYBC2-L1 )被证明直接参与花色苷的合成。然而,BHLH转录因子往往通过与MYB蛋白互作形成复合体,从而充分发挥调控花青苷合成的作用。葡萄BHLH蛋白VvMYC1通过与VvMYBA2互作,显著增强UFGT启动子的活性促进其表达,从而增加花青苷含量。本研究中共筛选出3个MYB基因(VIT_02s0033g00450、VIT_12s0134g00480、VIT_14s0066g01090)、6个BHLH基因(VIT_19s0014g04670、VIT_09s0002g04120、VIT_03s0038g04760、VIT_18s0001g12970、VIT_17s0000g08150、VIT_11s0016g03560)在覆膜后出现表达差异,推测参与花色苷合成调节。研究表明,其余转录因子(NAC、ERF、C2H2等)同样参与调控花色苷合成。本研究中,覆膜处理筛选出众多差异表达的转录因子,分别隶属于WRKY、NAC、ERF、C2H2等家族,推测其可能在响应覆膜处理促进花青苷生物合成过程中起调控作用,但仍需后续试验验证。