质量安全与营养品质评价岗位
陈铭轩 胡桂仙 王强
赭曲霉毒素是一种由真菌产生的生物毒素,耐高温,化学性质稳定,不易降解包含有19种结构类似的化合物,其中赭曲霉毒素A(OTA)的毒性最强。OTA具有强肾毒性,且有免疫抑制、致癌和致畸毒性,可以引起人类和动物的肾病发生,世界卫生组织将OTA划定为人类致癌物2B组(Group 2B carcinogens)。OTA暴露造成的氧化应激被认为其毒性作用机制之一,此外其毒性作用还有可能与抑制蛋白质合成、影响能量产生、产生DNA加合物(DNA adduct)和阻碍细胞凋亡/坏死和细胞周期有关。OTA可由不同种的真菌产生,并污染谷物、葡萄酒、葡萄汁、咖啡、豆制品、啤酒、坚果以及腌制肉制品等多种食品,1995年第一次在葡萄酒中检测到OTA,此后在葡萄以及葡萄制品中都经常有检出。葡萄酒被认为是食物中仅次于谷物的第二大OTA来源。葡萄和葡萄酒的OTA污染源被认为主要是曲霉属(Aspergillus)的黑曲霉(A. niger)和炭黑曲霉(A. carbonarius)。
咪鲜胺属于麦角甾醇生物合成抑制类杀菌剂,广泛用于防治各种经济作物的病害,并且对于水果贮藏期病害也有很好的防治效果。但是咪鲜胺是否可以抑制采后葡萄中炭黑曲霉和黑曲霉菌落生长目前并不清楚。因此本试验分析咪鲜胺对炭黑曲霉和黑曲霉的菌落生长以及产生赭曲霉毒素A活性的影响,并进一步以OTA产生量为指标研究咪鲜胺在室内环境和冷库环境下对采后葡萄上炭黑曲霉和黑曲霉产生赭曲霉毒素A的抑制效果,为咪鲜胺应用于葡萄保鲜提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 仪器与试剂
Agilent 1260 Infinity液相色谱仪(美国Agilent公司);BS110S电子天平(北京塞多利斯天平有限公司);Vortex Genius 3涡流混合器(德国IKA集团);CQ25-12D超声波清洗机(宁波江南仪器厂);TDL-40B台式离心机(上海安亭仪器有限公司);R-200型旋转蒸发仪(瑞士BUCHI公司);LHS-HC-Ⅰ恒温恒湿箱(上海一恒科学仪器有限公司)。
99.19%咪鲜胺标准品(德国Dr. Ehrenstorfer GmbH);99.0%赭曲霉毒素A标准品(青岛Pribolab公司);乙腈、甲醇(色谱纯,美国TEDIA公司);乙酸(分析纯,天津科密欧化学试剂有限公司);CYA培养基(上海沪震实业有限公司);C18填料(40 μm)(CNEBOND);氯化钠(分析纯,广东西陇化工股份有限公司)。
1.1.2 供试菌株
试验菌株为炭黑曲霉(Aspergillus carbonarius) CICC 40296和黑曲霉(Aspergillus carbonarius) CICC 41702,均由中国工业微生物菌种保藏管理中心提供。
1.1.3 供试作物与种植区
试验地点位于浙江省金华市浦江县。葡萄品种为巨峰葡萄,处于上市采收期。
1.2 OTA检测方法
1.2.1 仪器分析检测条件
液相色谱条件:色谱柱:XBridge C18(4.6×150 mm,5 μm);流速:1 mL·min-1;柱温:35 ℃;进样量:50 μL;保留时间:5.9min;流动相 CYA培养基:乙腈:乙酸:水=48:1:51,葡萄:乙腈:乙酸:水=44:1:55;检测波长:激发波长:333 nm,发射波长:460 nm。
1.2.2 样本的前处理方法
CYA培养基中赭曲霉毒素A的前处理方法:称取1g(精确到0.01g)CYA培养基于50 mL离心管中,加入10mL甲醇,涡旋10 min后, 8000 r·min-1条件下离心5 min,取1 mL上清液于10 mL离心管中,经氮气吹干后,流动相定容至1 mL,过0.22 μm滤膜待测。
葡萄中赭曲霉毒素A的前处理方法:准确称取葡萄样本10 g(精确到0.01g)于50 mL离心管中,加入10mL1%乙酸乙腈,加入4gNaCl,涡旋10 min,然后8000 r·min-1条件下离心10 min;取1.5 mL上清液至10 mL离心管,加入20 mgC18净化。将离心管震荡30 s后,7000 r·min-1条件下离心5min,取1 mL上清液于10 mL离心管中,经氮气吹干后,流动相定容至1mL,过0.22 μm滤膜待测。
1.3 生物活性测定方法
1.3.1 咪鲜胺浓度设置
平板上咪鲜胺浓度梯度设置为0.01、0.02、0.04、0.08、0.16、0.32和0.64 mg·kg-1。
采后葡萄浸泡使用的咪鲜胺浓度根据生产使用的推荐浓度设置为:推荐最低浓度:225 mg·kg-1、最高浓度450 mg·kg-1和推荐最高浓度两倍900 mg·kg-1。
1.3.2 咪鲜胺生物测定
称取13.75 g CYA培养基至500 mL锥形瓶中,加入250 mL去离子水,在灭菌锅内115 ℃灭菌30 min。在无菌环境内,待培养基冷却至45 ℃左右,分别向锥形瓶中加入不同浓度的咪鲜胺溶液,使锥形瓶中培养基的药剂浓度达到设计要求,以灭菌后空白培养基作为对照。将摇匀后培养基分别倒入9 cm一次性无菌培养皿中,每个培养皿倒入约20 mL培养基。将处于对数生长期的炭黑曲霉和黑曲霉的孢子从菌落上用无菌水冲洗至试管内,使用血球计数板进行计数,多次稀释后最终制备成每毫升1·106个孢子的孢子悬浮液。待培养基凝固后,分别在平板中央接种1μL菌液。接种完成后,分别放入设置为20 ℃与28 ℃的培养箱培养,自平板放入培养箱后,共培养15天,每个温度下每种菌的每个浓度重复5个平板。
1.3.3 咪鲜胺对菌丝生长抑制活性测定
自对照组培养基上的菌落直径超过0.5 cm后每天分别3次观察各个浓度平板上菌落生长情况。在对照组培养基上的菌落接近长满平板(菌落直径达到8.5 cm)或一天内无明显生长时,用十字交叉法测量每个菌落的直径记录此时所有平板上的菌落直径。
1.3.4 咪鲜胺对产毒活性测定
在平板培养15天后取出,参考1.2.2中的CYA培养基中OTA提取方法,自菌落中心至菌落边缘,使用打孔器均匀打孔,各浓度分别称取1g厚度均匀的具有菌丝的培养基,测定OTA的含量,每个处理重复三次。
1.4 采后葡萄模拟试验
选取果粒完整、饱满,无掉粒,葡萄表面无病害侵染痕迹、无虫口、无伤口,每串之间质量相差不超过100 g的葡萄,采摘后立刻使用225 mg·kg-1、450 mg·kg-1和900 mg·kg-1浓度的咪鲜胺浸泡葡萄。在保证不损伤葡萄、不让果实掉落的情况下,将葡萄整株浸入咪鲜胺药液1 min,浸泡结束后将葡萄缓慢提出药剂,全程避免葡萄有果实掉落或在果实表面造成伤口,对照组使用无菌水浸泡,同一药剂浓度处理重复12次。将浸泡后的葡萄置通风环境悬挂晾干。
分别制备孢子悬浮液,取等体积的两种菌液,混合均匀,获得具有两种孢子的孢子悬浮液。将三种菌液均匀喷施在葡萄表面。每串葡萄5mL。对照喷施同体积无菌水,同一药剂浓度下,同一菌种处理重复3串葡萄。将葡萄分别悬挂晾干,晾干后分别置于塑料保鲜盒,使其每串葡萄分隔开,分别放置于具有自然光照、通风常温(温度范围19 ℃~28 ℃)的室内环境与冷库(温度范围3.5 ℃~4.5 ℃)中。采样时间为自喷菌后20天。
1.5 样本采集与制备
取整串葡萄,均匀取样,去蒂取完整饱满的果实,整串葡萄取样三个重复,每串取100 g左右,同一药剂浓度共300 g左右样品,混合均匀后,使用匀浆机进行匀浆,装入样品瓶中,冷冻保存。
1.6 样本检测
测定两种温度下,采后浸泡过咪鲜胺的葡萄上,不同菌种产生的OTA产生量。使用1%乙酸乙腈提取,HPLC检测,分析OTA产生量。提取方法与仪器检测条件见1.2.2。
1.7 数据处理
使用Excel 2019和IBM SPSS Statistics 20软件,进行分析与做图。计算EC50与毒力回归方程,并对数据进行方差分析( ANOVA),对有显著差异(P<0.05)的,使用Tukey-HSD法进行多重比较。
2 结果与分析
2.1 咪鲜胺在不同温度下对两种曲霉的毒力
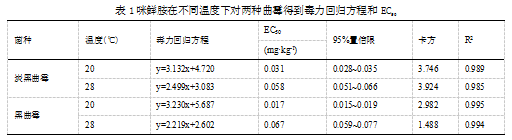
28 ℃和20 ℃时,在CYA平板上咪鲜胺对炭黑曲霉和黑曲霉的毒力回归方程以及EC50见表1。使用spss软件计算,本试验浓度组数设置为8,因此自由度为6,经卡方检测,所有卡方值均小于自由度为6时的卡方值:10.6,所有毒力回归方程的决定系数(R2)均>0.9,毒力回归方程可信。
对于同种曲霉,温度越低,咪鲜胺的活性越高,毒力回归方程的斜率越大,20 ℃时,两种曲霉不仅菌丝生长更慢,并且受咪鲜胺的抑制程度也更大,而个体之间的忍受力差异也较小。而同温度时,两种曲霉的菌丝生长受咪鲜胺的抑制程度相似,个体忍受力水平相似,而黑曲霉在初始浓度下被抑制的程度更高。
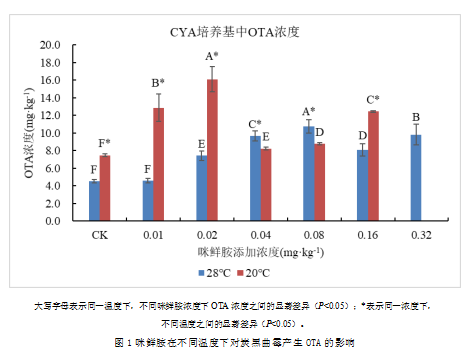
2.2 咪鲜胺在不同温度下对炭黑曲霉产生毒素的影响
在本试验培养条件下,所有温度以及所有浓度下,本试验使用的黑曲霉菌种均未产生OTA。28 ℃和20 ℃时,在CYA平板上咪鲜胺对炭黑曲霉产生OTA的影响如图2。对比对照组OTA产生情况,在20 ℃时,炭黑曲霉产生OTA显著更多。只有28 ℃时,0.01 mg·kg-1的咪鲜胺对炭黑曲霉产生OTA没有任何影响,两种温度下,其余所有浓度的咪鲜胺均然会导致OTA产生量显著增加。
2.2.1 20 ℃时咪鲜胺对炭黑曲霉产生毒素的影响
20 ℃下,所有浓度的咪鲜胺均会导致炭黑曲霉的OTA产生量显著增加。咪鲜胺浓度小于0.04 mg·kg-1时,OTA产生量随着咪鲜胺浓度升高而显著增加,0.02 mg·kg-1时,OTA产生量最高,0.04 mg·kg-1时,OTA产生量显著减少,为所有处理中最低,但仍然显著高于对照,而当咪鲜胺浓度再次升高后,OTA产生量再次显著增加,当浓度为0.16 mg·kg-1时,OTA产生量达到所有处理第三高。20 ℃时,除0.04和0.08 mg·kg-1时的OTA产生量显著低于28 ℃时对应浓度的OTA产生量,其余所有浓度,20 ℃时的OTA产生量显著更高。
2.2.2 28 ℃时咪鲜胺对炭黑曲霉产生毒素的影响
28 ℃时,0.01 mg·kg-1的咪鲜胺对炭黑曲霉产生OTA没有任何影响,其余浓度均会显著刺激OTA产生,当咪鲜胺浓度小于0.08 mg·kg-1时,OTA产生量随着咪鲜胺浓度升高而显著升高,浓度为0.08 mg·kg-1时OTA的产生量达到最高。当咪鲜胺浓度升高至0.16 mg·kg-1时,炭黑曲霉的OTA产生量显著减少,但其仍显著高于对照组。当咪鲜胺浓度升高达到0.32 mg·kg-1时,OTA产生量再次增加,为所有处理中第二高。
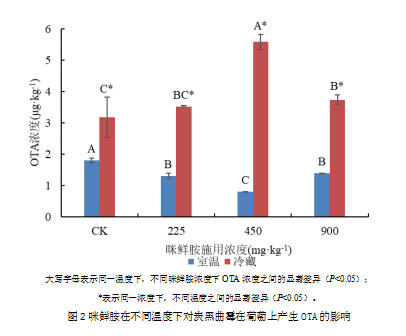
2.3 喷施单一菌种菌液的葡萄上OTA产生的情况
将处于正常采收期的葡萄浸泡过不同浓度的药剂后,分别喷施无菌水、炭黑曲霉菌液、黑曲霉菌液以及两种曲霉的混合菌液模拟生产中的情况,其中,喷施无菌水的对照组,在两种温度及任何浓度下,均没有检测到OTA产生,而在本试验条件下,喷施黑曲霉菌液的葡萄也均未检测到毒素的产生。
在本试验中喷施的菌液孢子量较大,远大于通常情况下葡萄上的菌量,而喷施无菌水的葡萄上未检出OTA,表明本试验中使用的葡萄上没有OTA的污染问题。
喷施炭黑曲霉的葡萄上的OTA产生情况如图5-1。咪鲜胺施用浓度相同时,冷藏条件下的葡萄上OTA检出浓度显著更高。
2.3.1 室温条件下葡萄上OTA产生的情况
在有自然光照、通风常温(温度范围19 ℃~28 ℃)的室温环境中,喷施过炭黑曲霉的葡萄放置20天后,在未浸泡咪鲜胺的葡萄上OTA检出浓度最高,而浸泡了咪鲜胺的葡萄上的OTA检出浓度均显著低于对照组,所有浓度的咪鲜胺都显著抑制了OTA的产生。450 mg·kg-1浓度的咪鲜胺对OTA抑制效果最好,而浸泡了900 mg·kg-1的葡萄上OTA检出浓度升高,显著高于450 mg·kg-1时的OTA,但与225 mg·kg-1的检出浓度无显著差异。
2.3.2 冷藏条件下葡萄上OTA产生的情况
冷藏条件下,OTA产生情况不同,未浸泡咪鲜胺的葡萄上OTA检出浓度最低,咪鲜胺对OTA没有抑制能力,浸泡咪鲜胺浓度为225 mg·kg-1的葡萄上OTA产生量与对照组OTA产生量之间没有显著差异,而450 mg·kg-1浓度的咪鲜胺显著刺激了炭黑曲霉在葡萄上产生OTA,为两种温度条件下所有处理中最高值,900 mg·kg-1相较450 mg·kg-1抑制了OTA产生,但与225 mg·kg-1时无显著差异,而显著高于对照组。
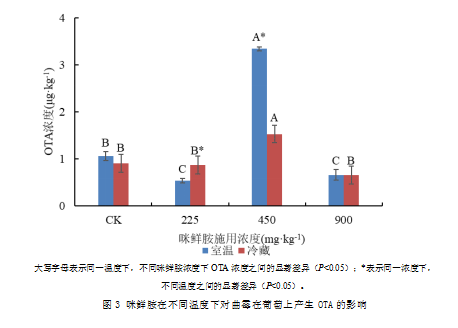
2.4 喷施混合菌液的葡萄上OTA产生的情况
喷施炭黑曲霉和黑曲霉混合菌液的葡萄上的OTA产生情况如图5-2。虽然本试验中使用的黑曲霉本身不产生OTA,但是当两种菌种混合后同时侵染葡萄时,黑曲霉影响了炭黑曲霉产生OTA。两种温度条件下,对照组葡萄上的OTA检出浓度之间没有显著差异。
2.4.1 室温条件下葡萄上OTA产生的情况
在室温条件下,225 mg·kg-1和900 mg·kg-1浓度的咪鲜胺与对照组相比均可以显著抑制曲霉在葡萄上产生毒素,但两种处理之间的OTA产生量无显著差异。但450 mg·kg-1的咪鲜胺显著刺激了曲霉在葡萄上产生OTA,其OTA检出浓度在两种温度条件下所有处理中最高。
2.4.2 冷藏条件下葡萄上OTA产生的情况
在冷藏条件下,225 mg·kg-1和900 mg·kg-1浓度的咪鲜胺抑制了OTA的产生,但是与对照组差异不显著。但450 mg·kg-1的咪鲜胺显著刺激OTA产生。咪鲜胺浓度为225 mg·kg-1时,冷藏条件下的OTA产生量显著高于室温时的产生量,而浓度为450 mg·kg-1时,室温下葡萄上的OTA产生量是两种温度条件下最多的,浓度为900 mg·kg-1时,两种温度条件下,OTA产生量没有显著差异。
3 讨论
抑制真菌生长被认为是阻止真菌毒素产生的最有效的措施[13],大量的实验表明杀菌剂是控制真菌产生毒素的有效手段[14-20],但是,真菌产生毒素等次生代谢产物的机制较为复杂[21-24],某些杀菌剂及其他杀菌活性物质会在特定条件下作为一种胁迫因素[24-28],刺激真菌,尤其是较低剂量的杀菌剂或亚致死剂量的杀菌剂在一定的温度及其他环境条件下可能会导致导致其二次代谢产生毒素以及其他次生代谢产物[29]。
在本试验中,咪鲜胺虽然对两种曲霉的生长活性较高,但是超过EC90的咪鲜胺依然会导致炭黑曲霉OTA产生量与显著增加,并且显著高于一些咪鲜胺浓度较低时的炭黑曲霉的OTA产生量,只有当咪鲜胺完全抑制炭黑曲霉生长时,才能完全抑制OTA的产生,否则对OTA没有抑制能力,还会刺激OTA产生。在两种温度下,炭黑曲霉OTA的产生情况相似,均表现为:OTA产生量随着咪鲜胺浓度的上升,先升高而后下降并再升高,20 ℃时,使OTA产生量趋势出现转折的咪鲜胺浓度为0.04 mg·kg-1,28 ℃则为0.16 mg·kg-1。20 ℃时,炭黑曲霉菌丝的生长速度较慢,但除咪鲜胺浓度为0.04和0.08 mg·kg-1外,所有浓度下炭黑曲霉的OTA产生量均超过28 ℃时的OTA产生量,低温作为一种胁迫,可能导致炭黑曲霉OTA产生量增加。两种温度下,OTA产生情况有相似的趋势,证明两种温度下,OTA产生量发生变化的内在原因可能相同,推测可能的原因是炭黑曲霉存在某种机制,在炭黑曲霉生长没有被咪鲜胺完全抑制的情况下,来应对咪鲜胺的胁迫,经过次生代谢等一系列生理生化反应,最终表现为OTA产生量增加,这种机制的强度随咪鲜胺浓度升高而增强,咪鲜胺浓度越高,对炭黑曲霉产生OTA刺激越强,当咪鲜胺浓度达到一定浓度时,该机制达到最强,OTA产生量最高,而咪鲜胺浓度再升高时,炭黑曲霉的菌丝生长被进一步抑制,但应对胁迫的机制强度已达到最高,因而OTA产生量显著下降,而后咪鲜胺浓度再次升高,炭黑曲霉再次激活其他某些机制,经过一系列的生理生化反应后,同样表现为OTA产生量增加,这种机制同样随着咪鲜胺的浓度升高而增强,OTA产生量增加。在20 ℃时,炭黑曲霉生长更为缓慢,在此温度下,咪鲜胺活性更高,炭黑曲霉的菌丝生长更易受咪鲜胺影响,因此使OTA产生趋势发生改变的咪鲜胺浓度更低。
而对于葡萄上的产生情况:在室温环境下,所有浓度的咪鲜胺均可以显著抑制炭黑曲霉产生OTA,而在温度为4 ℃左右的冷库中OTA产生情况相反,OTA检出浓度均高于室温,咪鲜胺对OTA产生不仅没有抑制效果,还会显著刺激炭黑曲霉在葡萄上产生OTA。在室温下对OTA产生抑制效果最好的450 mg·kg-1浓度,在冷藏条件下,对OTA的刺激作用最强。在室内条件下,低于10 ℃时,炭黑曲霉不能生长 [30, 31],但在本试验中,炭黑曲霉在4 ℃时OTA产生显著更多,造成上述情况的原因可能是:室温时,在葡萄上咪鲜胺本身可以抑制OTA产生,而在4 ℃时,低温胁迫导致炭黑曲霉激活某些应对机制,表现为OTA产生量增加,而炭黑曲霉在低温下激活的某种应对机制同样会应对咪鲜胺的胁迫,同样会表现为OTA产生量增加,因此低温下贮藏的葡萄上对照组以及所有处理的OTA产生量显著更多。在两种环境条件下,咪鲜胺并非浓度越高对OTA的抑制效果越好。室温条件下,OTA产生量随着咪鲜胺的浓度升高,先减少而后增加,450 mg·kg-1的咪鲜胺对炭黑曲霉在葡萄上产生OTA的抑制效果最显著,抑制效果优于900 mg·kg-1;冷藏条件下,OTA产生量随着咪鲜胺的浓度升高,先增加而后减少,450 mg·kg-1的咪鲜胺对OTA的刺激效果最显著。推测原因可能为咪鲜胺浓度升高,炭黑曲霉产生应对机制,表现为OTA产生量增加,但是可能由于此时炭黑曲霉的应对机制强度较低;或者是由于900 mg·kg-1浓度较高,对炭黑曲霉生长的抑制作用较强导致炭黑曲霉生长情况很差,因此OTA产生量较少,与对照组比较仍表现为抑制作用。
虽然黑曲霉本身在葡萄上不产生毒素,但是它在葡萄上影响了炭黑曲霉产生毒素。除450 mg·kg-1外,室温放置的葡萄上,咪鲜胺依然可以显著抑制混合曲霉产生毒素,在冷藏贮藏的葡萄上,原本会显著刺激炭黑曲霉产生OTA的浓度对混合菌种产生OTA没有影响,既不刺激也不抑制,与对照组OTA产生量没有显著差异。而在两种温度下450 mg·kg-1的咪鲜胺都会显著刺激OTA产生。此条件下,两种环境条件下,葡萄上的OTA产生量之间没有显著差异,表明炭黑曲霉和黑曲霉同时侵染寄生葡萄时,两种菌种在侵入前期、侵入期、潜育期和发病期之间的竞争关系,改变了曲霉应对低温胁迫的机制,导致OTA产生量没有显著差异。
杀菌剂浓度与真菌毒素的产生量之间相关性关系复杂,杀菌剂对真菌毒素的抑制效果不仅与杀菌剂本身的性质与浓度有关,还与杀菌剂施用的方式、用药时间、环境条件有关[32,33],本研究中,咪鲜胺在葡萄上,只有在室温下,对炭黑曲霉产生OTA有抑制效果,虽然可以显著抑制OTA产生,但是并不能完全抑制,而在其他条件下,对曲霉产生OTA没有抑制效果,还有可能显著刺激OTA产生,因此在药剂防治真菌产生毒素方面,可能并非是药剂浓度越高防治效果越好。