果实病害防控
葡萄(Vitis vinifera)是我国种植最广的果树,在我国农业产业中占有重要地位,种植面积位居世界第 2 位,产量位居世界第 1 位(穆维松等, 2019)。在葡萄生长过程中,从最深的根系到最接近阳光的叶片,都有微生物的痕迹。微生物除了在葡萄植株上定殖,其也与葡萄的生长息息相关,对于维持葡萄正常生长、改善生产方式等,都具有重要的意义。同时,植物本身代谢物的分泌,也在影响和塑造着相关的微生物群落,建立这些代谢物与微生物之间的联系,有助于更好的了解植物是如何对微生物群进行调控。
1 材料与方法
本次研究选取赤霞珠自根苗(Cabernet Sauvignon, CS),和其分别嫁接 6 种砧木品种(5BB、101-14、110R、5A、Ganzin 和 R5,砧木信息见附录 1)的嫁接苗进行研究。采样用的葡萄植株全部种植于北京市海淀区中国农业大学上庄实验站内,分为 3个小区种植(图 2-1),所有葡萄植株的施肥、施药及其他种植管理措施均保持一致,树龄均为 8 年。
葡萄样品采集于 2019 年 8 月 6 日。每个小区内的同种砧木品种选取 3 棵植株,共采集 90 片叶片和 90 个叶柄作为每个砧木品种的一份重复样本(每棵植株采集 30 片叶片和 30 个叶柄)。对小区 2 和小区 3 进行同样的操作。最终,每个生育时期共获得21 份叶片(不含叶脉)样本和 21 份叶柄样本(图 2-1)。采样回来的叶片和叶柄先用无菌水洗涤 30 s,再在 75%乙醇中浸泡 2 min,后用 2.5%NaClO(含 0.01%的吐温 80)浸泡5 min 后再用 75%乙醇浸泡 30 s,最后使用无菌水洗涤 3 次,视为对叶片和叶柄表面的无菌化处理,最后一次洗涤液取 100 μL 在 TSA 平板上培养,以验证消毒效果。处理后的样本存于-80℃冰箱,用于 DNA 提取。
取 0.1 g 叶片或叶柄组织,放入到有 6 mm 灭菌钢珠的 2 mL EP 管中,液氮速冻后,使用组织研磨仪 55 Hz 击打 15 s 完全破碎后,分别使用 3 种方法进行 DNA 提取(表 2-2),以比较不同方法提取组织总 DNA 的效果。提取的样本总 DNA 用 NanoDrop 2000 进行质量评估。
细菌 DNA 的扩增使用 16S rDNA 的 V5-V7 区,使用引物为 799F:5’-AACMGGATTAGATACCCKG-3’,1193R:5’-ACGTCATCCCCACCTTCC-3’;真菌DNA 扩增使用 ITS1 和 ITS2 序 列 , 使 用 引 物 为 ITS1 : 5’-CTTGGTCATTTAGAGGAAGTAA-3’,ITS2:5’-GCTGCGTTCTTCATCGATGC-3’。细菌使用 TranStart FastPfu Polymerase 进行扩增,扩增体系为:5×FastPfu Buffer 4 µL,2.5 mM dNTPs 2 µL,Forward Primer(5 µM) 0.8 µL,Reverse Primer(5 µM) 0.8 µL,FastPfu Polymerase 0.4 µL,BSA 0.2 µL,DNA 10 ng,ddH2O 补至 20 µL。真菌使用TaKaRa rTaq Polymerase 进行扩增,扩增体系为:10× Buffer 2 µL,2.5 mM dNTPs 2 µL,Forward Primer(5 µM) 0.8 µL,Reverse Primer(5 µM) 0.8 µL,rTaq Polymerase 0.2µL,BSA 0.2 µL,DNA 10 ng,ddH2O 补至 20 µL。扩增条件均为:95℃预变性 3 min,95℃变性 30 s,55℃退火 30 s,72℃延伸 45 s,循环 30 次,72℃后延伸 10 min,4℃保持。用 2%琼脂糖凝胶电泳检测 PCR 产物是否合格。高通量测序由上海美吉生物医药科技有限公司完成,测序平台为 Illumina Miseq中国农业大学硕士学位论文 第二章 砧木品种对葡萄叶内生微生物组的影响PE300。
2 数据处理及分析
利用 usearch 和 vsearch 对原始数据进行前序处理,主要包括:切除引物与质控、去冗余和降噪生成 Amplicon sequence variants (ASVs),并结合 SILVA 数据库去除嵌合体和生成物种信息表(真菌使用 UNITE 数据库),同时移除其中来自植物质体的序列。对所有样本随机抽样标准化后,利用 R 3.6.3 的 vegan 包生成 6 种 α-多样性指数(richness,shannon,chao1,simpson,invsimpson,ACE),并用单因素方差分析(oneway ANOVA)、Kruskal-Wallis 检验和 Tukey HSD 多重比较分析各因子对 α-多样性的影响;基于 Bray-Curtis 距离和置换多元方差分析(permutational multivariate analysis of variance, PERMANOVA)评价各因子对 β-多样性的影响,并进行主坐标分析(principal co-ordinates analysis, PCoA);使用线性判别分析(linear discriminant analysis effect size, LefSe)检验每种砧木品种富集的微生物类别;使用 venn 包观测相对丰度≥0.1%的 ASV在各样本之间的存在情况;使用 Cytoscape 的内置软件 CoNet (ensemble-based)对平均相对丰度≥0.01%且出现频率≥50%的 ASVs 构建微生物共发生网络并利用 Gephi 进行可视化。涉及到的显著性检验均使用 FDR 校正 p 值,FDR≤0.05 认为 p 值可信。
3 结果与分析
3.1 不同 DNA 提取方法比较分析
本试验使用 3 种 DNA 提取方法进行比较。3 种方法中,CTAB 法提取的浓度最高,但纯度较差,这可能是由于叶组织含有较多酚类及糖类物质(王军等, 2006),该法提纯效果不佳。而两种试剂盒提取的纯度较好,其中,FastDNA SPIN for Soil Kit 试剂盒提取的 DNA 浓度及纯度综合效果较好(图 2-2)。
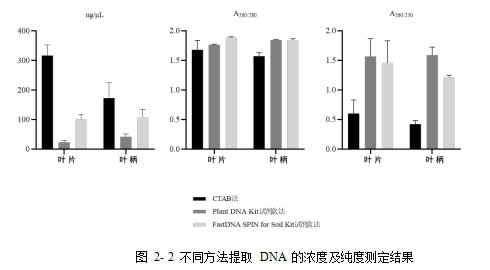
为了得到高质量的 DNA 样本,以进行接下来的 PCR 扩增,本试验最终选用FastDNA SPIN for Soil Kit 试剂盒进行叶片及叶柄样本 DNA 提取。
3.2 ASV及α-多样性分析
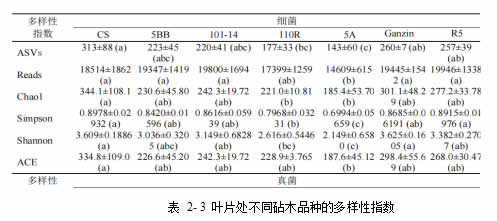
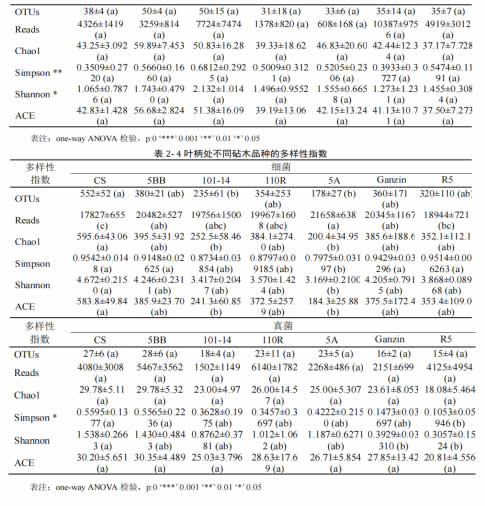
本试验将赤霞珠自根苗及嫁接 6 种砧木的葡萄叶片及叶柄样本进行 16S rDNA 及ITS 序列高通量测序分析。其中,16S rDNA 得到 19146±2069 条 reads,2475 个 ASV,ITS 得到 4695±4167 条 reads,264 个 ASV。经过 α-多样性分析,不同砧木品种的样本间,细菌多样性指数间不存在显著性差异(ANOVA, p>0.05),而真菌多样性在不同砧木品种间存在差异,其中叶片样本间的Simpson 指数(ANOVA, p<0.01)及 Shannon 指数(ANOVA, p<0.05),和叶柄样本间的Simpson 指数(ANOVA, p<0.05)均检验出显著差异。
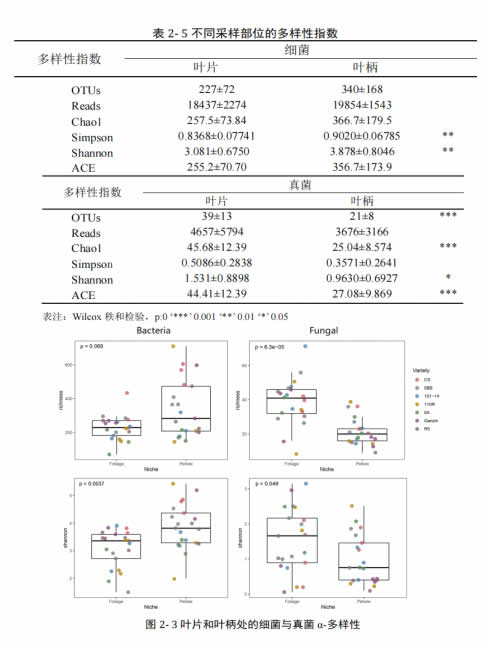
通过比较叶片及叶柄处的α-多样性指数,发现细菌群落在叶柄中显著丰富于叶片(表 2-5,图 2-3),而真菌群落则相反,叶片处的多样性显著高于叶柄处。该结果可能是由于叶柄具有比叶片更不利于真菌生存的生理环境造成的。
3.3 叶内生微生物组的群落结构
经过参考数据库的注释,来自叶片和叶柄的样本的细菌 ASV 共归为 22 个门,55个纲,107 个目,209 个科,400 个属。其中,在门水平上,所有 ASV 主要来自变形菌门(Proteobacteria, 73%),放线菌门(Actinobacteria, 14%),拟杆菌门(Bacteroidetes, 7%),厚壁菌门(Firmicutes, 5%)。在属水平上,丰度最高的 10 个属为劳尔氏菌属(Ralstonia, 22%),马赛菌属(Massilia, 17%),假单胞菌属(Pseudomonas, 9%),甲基杆菌属(Methylobacterium, 7%),短小杆菌属(Curtobacterium, 4%),鞘氨醇单胞菌属(Sphingomonas, 3%),红球菌属(Rhodococcus, 2%),短波单胞菌属(Brevundimonas, 2%),伯克氏菌属(Burkholderia, 2%),金黄杆菌属(Chryseobacterium, 2%)。
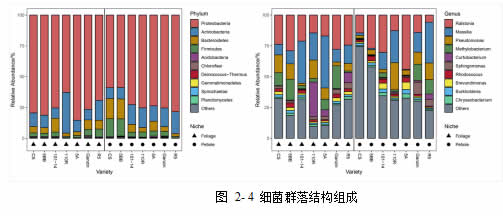
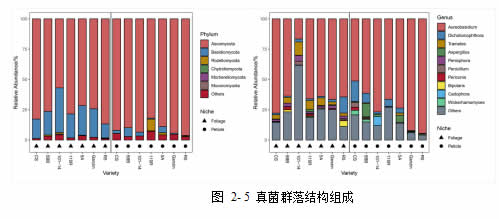
真菌 ASV 共归为 6 个门,13 个纲,26 个目,40 个科,51 个属。其中,在门水平上,所有 ASV 主要来自子囊菌门(Ascomycota, 83%),担子菌门(Basidiomycota, 12%),罗兹菌门(Rozellomycota, 1%)。在属水平上, 所 有 ASV 主 要 来 自 黑 酵 母 属 (Aureobasidium, 67%) ,Dichotomophthora(4%),栓菌属(Trametes, 3%),曲霉菌属(Aspergillus, 2%),隔孢伏革
菌属(Peniophora, 1%),青霉菌属(Penicillium, 1%)。
3.4 不同砧木品种的叶内生微生物组
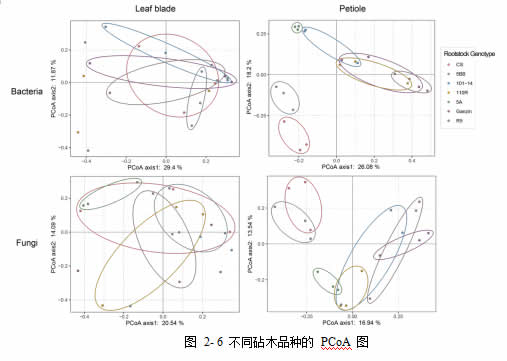
基于 Bray-Curtis 距离对各样本进行 PCoA 分析及 PERMANOVA 分析后,发现对于 叶 片 处 , 无 论 是 细 菌 (F.Model=0.845, R2=0.266, p=0.791) 还是真菌群落(F.Model=1.225, R2=0.344, p=0.087)均未检测到砧木品种间的显著差异。而与之相反的,在叶柄处,细菌群落(F.Model=2.396, R2=0.507, p<0.001)与真菌群落(F.Model=1.455,R2=0.384, p<0.005)均表现出了砧木品种间的显著差异(图 2-6)。该结果表明,砧木的基因型的选择会影响叶柄处的微生物群落结构。
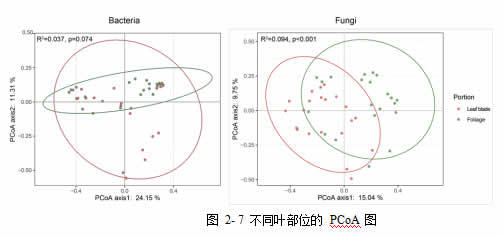
与此同时,对叶柄和叶片处的微生物群落进行 PERMANOVA 分析发现,细菌群落在叶柄与叶片两个部位之间,组成无显著性差异(F.Model=1.557, R2=0.037, p=0.074),而真菌群落则表现出在叶柄与叶片两部位间显著不同(F.Model=4.163, R2=0.094, p<0.001,图 2-7)。
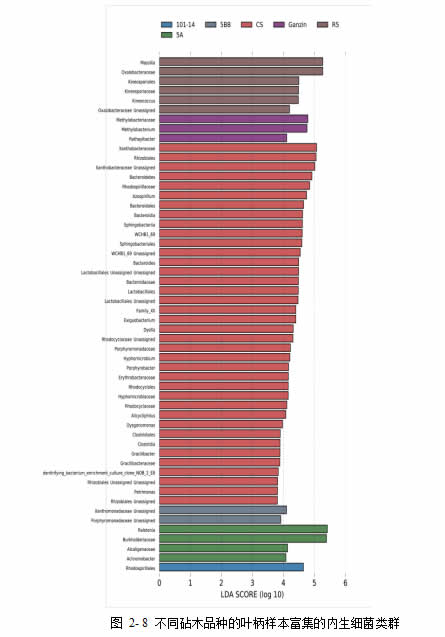
经过 LefSe 分析,在叶柄和叶片组织中,除了叶片内生细菌群落,叶柄内生细菌群落、叶片及叶柄内生真菌群落均在不同的砧木品种检测到显著富集的微生物类群(p<0.05, LDA>2.0),又称为生物标记物。其中,叶柄内生菌群在不同砧木品种间均有显著多余其他样本的微生物类群(图 2-8),特别是赤霞珠自根苗的叶柄内生细菌具有最多的生物标记物。
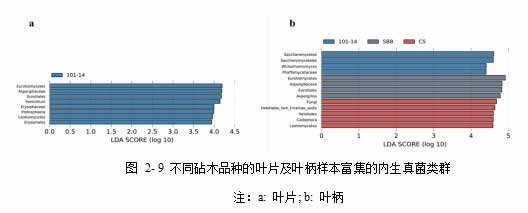
对于内生真菌群落,叶片及叶柄样本中均检测到了部分砧木品种的生物标记物(图2-9)。其中,101-14 样本在叶片及叶柄组织中均有丰度显著高于其他砧木品种的微生物类群,而对于叶柄样本,5BB 及赤霞珠自根苗也有部分富集的微生物类群。
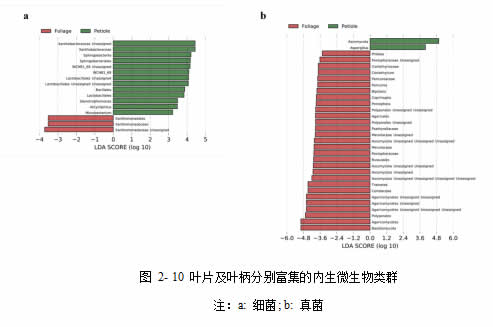
在对叶柄样本与叶片样本的比较当中,也发现了叶柄与叶片的内生细菌和真菌群落均有属于不同组织的生物标记物(图 2-10&图 2-11),这再次表明了葡萄叶柄与叶片具有不同的内生菌群特点。
3.5 叶内生微生物组的核心菌群
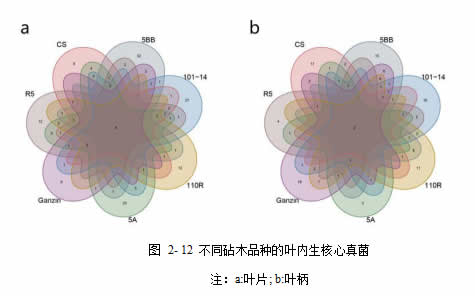
本试验中,将不同砧木品种中均稳定存在的核心 ASV 定义为:1)丰度≥0.1%;2)在所有样本中均存在。细菌群落中,有 17 个 ASV 存在于所有叶片样本中,有 15 个ASV 存在于所有叶柄样本中,有 14 个 ASV 存在于所有样本(图 2-111c),这些 ASV来自伯克氏菌科(Burkholderiaceae),柄杆菌科(Caulobacteraceae),丛毛单胞菌科(Comamonadaceae),棒状杆菌科(Corynebacteriaceae),黄杆菌科(Flavobacteriaceae),微杆菌科 (Microbacteriaceae) , 诺 卡 氏 菌 科 (Nocardiaceae) , 丙 酸 杆 菌 科(Propionibacteriaceae),假单胞菌科(Pseudomonadaceae),红细菌科(Rhodobacteraceae),黄色单胞菌科(Xanthomonadaceae)。
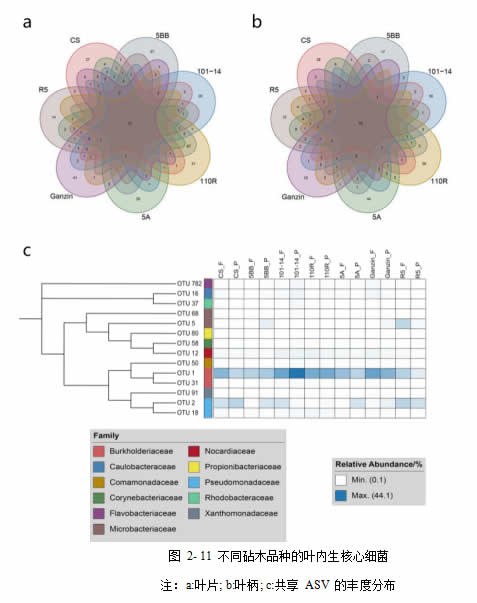
真菌群落中,有 4 个 ASV 存在于所有样本中,有 2 个 ASV 存在于所有叶柄样本中,有 2 个 ASV 存在于所有样本(ASV1 和 ASV3),它们属于子囊菌门的Aureobasidiaceae 以及多孢菌科(Pleosporaceae)。
3.6 叶内生微生物组的共生网络分析
通过相关性分析,发现叶柄具有比叶片处具有更强的内生细菌互作网络。如图 2-13 所示,叶柄处的共发生关系远多于叶片,在这些共发生关系中,以变形菌门细菌为主导。这样一种较强的内部互作关系,可能使叶柄处较叶片处拥有更加稳定存在的菌群结构,从而使不同砧木品种间因为内生细菌间的互作关系而存在稳定的差异。
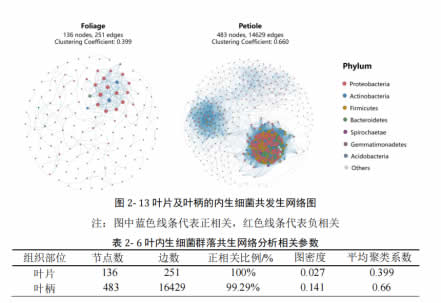
而真菌群落与之相反,在叶片处具有较叶柄处更多的共发生关系(图 2-14),但整体而言,真菌群落间的互作关系较弱。

4 小结
本章主要围绕砧木品种对葡萄叶片及叶柄内生微生物群落的影响进行探究。试结果表明,叶柄与叶片处的内生微生物群落组成特点和多样性均存在显著差异,砧品种对叶柄的内生细菌及真菌群落有显著影响。同时,不同砧木品种的叶片及叶柄有各自的富集微生物类群,也有一些微生物类群作为核心菌群存在于葡萄叶内。同时叶柄相较叶片处,内生菌群具有更强的共发生关系。该研究结果阐明了砧木品种对萄叶片及叶柄处内生细菌及真菌群落的影响,进一步明确了砧木品种在塑造葡萄微生物组中发挥的作用。