病毒病防控岗位
胡国君 董雅凤 张尊平 范旭东 任芳
摘要:以感染葡萄卷叶伴随病毒3(GRLaV-3)的“香宾尼”葡萄试管苗为试材,分别采用热处理(37 °C, T)、化学处理(15 μg/mL和25 μg/mL病毒醚,R15 and R25)、热处理结合化学处理(R15+T和R25+T)的方法对其进行脱毒处理。处理30d后,R15和R25处理植株的药害开始显现;T、R15+T和R25+T处理植株表现出热损伤,此外,高温对植株的生长有一定的促进作用。处理结束后切取1mm的茎尖进行再生。热处理(T)再生植株的成活率最低,仅为23.3%,而化学处理(R15和R25)及热处理结合化学处理(R15+T和R25+T)的成活率分别为47.0%(31/66)和41.0%(50/122)。采用RT-PCR和荧光定量PCR的方法对再生植株进行病毒检测,结果表明两种方法相结合可有效提高GLRaV-3的脱除效率。所有R15和 R25处理40d的再生植株中均携带GLRaV-3,而R15+T和R25+T处理20d的再生植株中GLRaV-3的脱除效率均超过80%;T处理再生植株中GLRaV-3的脱除率为42.9%。
关键词:葡萄试管苗;葡萄卷叶伴随病毒3;病毒醚;热处理;病毒脱除
葡萄(Vitis spp.)主要通过无性方式进行繁殖,经过几个世纪的繁衍,它们的后代遍布世界各地(This et al., 2006)。这种繁殖方式使得葡萄体内的病毒等细胞内专性寄生物在各葡萄产区广泛传播,给葡萄产业带来严重危害。葡萄卷叶病是重要的葡萄病毒病,在世界范围内的葡萄产区均有发生。主要症状为叶片反卷,感病后可降低幼芽活力和果实产量,同时导致果实糖分和花青素含量下降、酸度增加,进而改变用此葡萄酿制的葡萄酒的品质(Alabi et al., 2016; Halldorson and Keller, 2018)。
研究表明,长线形病毒科(Closteroviridae)的许多病毒均与葡萄卷叶病的发生有关,故将这一类病毒命名为葡萄卷叶伴随病毒(grapevine leafroll-associated viruses,GLRaVs)(Naidu et al., 2014)。其中,GLRaV-3几乎在所有葡萄产区均有发生,可造成严重的经济损失。该病毒为韧皮部限制性病毒,可通过粉蚧传播,影响光合作用和呼吸过程中的碳平衡,导致产量、植株大小和枝条木质化程度显著下降(Montero et al., 2016)。由于田间缺少有效的防治方法,目前使用无病毒的繁殖材料是防控该病毒最有效的措施。热处理、化学处理、茎尖培养、体细胞再生等方法均可脱除GLRaV-3,而不同方法间的脱毒效率存在差异。本研究主要以感染GLRaV-3的葡萄试管苗为研究材料,明确了热处理结合化学处理对该病毒的脱除效率,同时与单独化学处理、单独热处理的脱除效率进行比较。
1 材料与方法
1.1 待处理材料
实验室保存的来源于中国农业科学院果树研究所的“香宾尼”葡萄试管苗,样品经RT-PCR检测携带GLRaV-3。
1.2含病毒醚的MS培养基配制
先配制浓度为1,000 μg/mL的病毒醚母液,然后将母液加入到经高温灭菌后冷却至60~70°C的MS培养基中,使其终浓度为15 μg/mL和25 μg/mL,加完后迅速混匀,然后置于室温条件下备用。
1.3 离体植株的继代培养
葡萄试管苗一般培养40-50d后需进行继代,每次继代切取1.5~2.0 cm左右的茎尖或茎段转到新鲜的MS基本扩繁培养基中,每次继代的离体材料需抽样进行RT-PCR检测,以便确保带毒。当离体材料扩繁到所需数量后,选取长势一致的植株,切取1 cm的茎尖进行脱毒处理。
1.4 总RNA的提取
称取0.1 g样品,液氮研磨,加入0.5 ml提取缓冲液,充分震荡混匀;向匀浆液中加入25 μL 20% SDS混匀,65 °C 20 min;加入125 μL 5 M KOAc,震荡混匀后冰上放置20 min,4 °C,12,000 g离心15 min;吸上述上清液400 μL加入2倍体积的无水乙醇,冰上放置10 min后,4 °C,1,2000 g离心10 min;沉淀用75%乙醇洗涤两次,加入50 μL DEPC处理的去离子水。
1.5 RT-PCR检测
取上述总RNA 2 μL、6碱基随机引物1 μL、DEPC处理的去离子水7 μL于一离心管中,沸水变性6 min,冰上3 min。依次加入:5× RT buffer 2 μL、dNTPs(10 mmol/L)1 μL、M-MLV(200U/µL)0.5 μL、Rnasin(40U/μL)0.5 μL,用去离子水补足至20 μL。混匀后37 °C水浴1 h,70°C灭活5 min,冰浴3 min,-20 °C备用。
取上述cDNA 2 μL,依次加入10× RCR buffer 2.5 μL、dNTPs(10 mmol/L)2 μL、同源和互补引物(表1)各0.5 μL、 rTaq DNA聚合酶 1 U,最后定容至25 μL。扩增条件为:95 °C预变性3 min,94 °C 30 s,57 °C 45 s,72 °C 45 s,共35个循环,72 °C 7 min。扩增结束后取6 μL PCR产物和1 μL 6× Loading buffer 在1.2%的琼脂糖凝胶中进行分离,经0.5 mg/L EB溶液染色后在BIO-RAD凝胶成像系统中,观察扩增结果。

1.6 荧光定量PCR检测
利用去基因组DNA试剂盒进行反转录,然后用SYBR染料进行定量PCR扩增,实验操作参照试剂盒说明书。将Cq > 35的检测样品作为GLRaV-free,每个样品三次重复。Vivi-18Sf/r 作为内参引物(表1)。
1.7 脱毒处理方法
1.7.1 化学处理
将切取的茎尖移入病毒醚终浓度分别为15 µg/mL和25 µg/mL的MS培养基中,每个处理设3次重复,然后在室温24 °C条件下进行培养,处理40d。
1.7.2 热处理
将切取的茎尖移入基本的MS培养基中,设3次重复,先在室温24 °C下放置10d,然后移入光照培养箱内,逐渐升温至37 °C,处理20d。
1.7.3 热处理结合化学处理
将切取的茎尖移入含病毒醚终浓度分别为15 µg/mL和25 µg/mL的MS培养基中,每个处理设3次重复,先在室温24 °C下放置10d,然后移入光照培养箱内,逐渐升温至37 °C,处理40d。
1.7.4 对照的设置
将切取的茎尖移入基本的MS培养基中,设3次重复,室温24 °C下进行培养。
1.7.5 培养条件及数据的记录
所有处理组中的植株每天光照培养16 h,黑暗培养8 h,光照强度为40 μmol· s-1 · m-2。每5d记录一次处理过程中植株的生长状况,统计新生的侧枝(≥ 5 mm)数,并测量植株的株高。当处理到25d、30d、35d、40d时分别切取1.0 mm茎尖(主芽和侧芽),移入新鲜的基本MS扩繁培养基中,记录再生植株的成活率,再生植株继代5次后采用RT-PCR的方法对再生植株中的GLRaV-3进行检测,对检测无毒的样品采用荧光定量PCR技术进行进一步确认。
2 结果与分析
2.1 病毒醚和高温对葡萄试管苗株高和增殖的影响
处理20d时,含病毒醚(R15和R25)的处理未表现药害,处理植株与对照组(CK)几乎一样;处理30d时,R15和R25的植株叶片开始变黄变褐,且株高开始受到影响,明显比CK植株矮小(表2)。热处理(T)和热处理结合化学处理(R15+T和R25+T)的植株在处理过程中明显高于CK、R15和R25。此外,T、R15+T和R25+T植株从开始处理到结束均受到不同程度的热损伤,主要表现为褪绿、黄化、褐化、萎蔫或坏死。所有处理组植株的增殖均未表现明显差异。
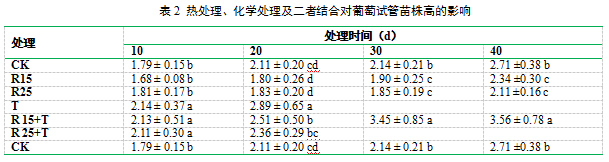
2.2 病毒醚和高温对葡萄试管苗再生成活率的影响
处理结束后,各处理组的植株均未出现死亡的现象。各处理组在不同的处理时期切取1.0 mm的茎尖进行再生。当茎尖分化成植株并稳定生长后进行继代,继代5次后对成活率进行统计(表3)。所有处理的平均成活率为43.1%。T组再生植株的成活率最低,四分之三的茎尖死亡。化学处理和化学处理结合热处理总成活率分别为47.0%和41.0%。抗病毒剂的浓度对再生植株的成活率未表现出影响。R15和R25的成活率分别为52.8%和40.0%,而处理20d的R15+T和R25+T再生植株成活率分别为35.5%和53.5%(表3)。
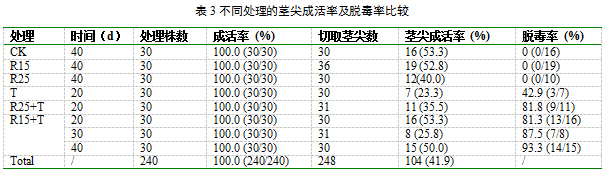
2.3 GLRaV-3的脱除效果分析
茎尖成活后进行5次继代培养,然后采用RT-PCR和荧光定量PCR技术进行病毒检测。结果表明:R15和R25处理40d均不能脱除GLRaV-3,但是结合热处理后脱除率显著提高。处理20d后R15+T和R25+T再生植株的GLRaV-3脱除率均在80%以上,而同一时期T组中的脱除率为42.9%。此外,GLRaV-3的脱除率随着处理时间的延长而增加。R15+T处理20d、30d和40d的脱毒率分别为81.3%、87.5% 和93.3%(表3)。
3 讨论
病毒醚为植物常用病毒抑制剂,在植物病毒的脱除研究中已被广泛应用,但在本研究中单独病毒醚处理对植株中的GLRaV-3未表现出抑制作用,该结果与前人的研究一致(Kim et al., 2003; Panattoni et al., 2011)。在结合热处理后GLRaV-3的脱除率明显增加,15ug/mL病毒醚结合37℃处理40d,GLRaV-3的脱除率可达93.3%。此外,两种方法的结合也有利于植株的生长。因此,该方法对葡萄病毒的脱除具有较好的应用前景。然而,需要指出的是本研究选用的材料为GLRaV-3单毒原,在自然条件下,葡萄是多种病毒混合侵染的,因此,明确GLRaV-3与其他病毒混合感染的脱除效率将对生产具有重要的指导意义。