酿酒微生物岗位
刘延琳团队
工业发酵的目标是以最小的成本获得最大的产值和最高的利润,而这一目标实现的工程手段则是针对特定过程建立出高效的发酵模式,高密度培养技术因运而生。
1 高密度培养的概念和意义
高细胞密度发酵(High CellDensity Fermentation,HCDF),或高细胞密度培养(High Cell DensityCultivation,HCDC),简称高密度发酵,指的是在给定的体积和时间内,通过优化培养条件,获得尽可能多的细胞数量,从而提高单位体积生产率的一种细胞培养方式。山根恒夫(1992)以面包酵母细胞为例,对高密度培养发酵液中细胞所占的体积分率进行说明。将酵母细胞假设为圆球形,且细胞呈紧密堆积状态的情景下,菌体浓度可达到280gDCW/L(Dry CellWeight,DCW)的水平,这一细胞干重的数值也被认为是酵母高密度培养理论值的上限。实际的生产中,当发酵液中的酵母细胞干重达到20g~30 g/L以上,即可称为高密度发酵。
比较于常规的细胞培养方式,高细胞密度培养在发酵工业中更具优势,其主要的优点有:①提高单位体积培养液中菌体的数量,进而细胞产率;②缩小生物培养容器体积,降低生产成本投入;③强化下游产物的分离提取,提高产物利用率;④综合提高比生产速率,加速产品商品化的进程,提高产品的市场竞争力。
高细胞密度培养也存在其缺点与不足。高细胞密度培养过程中,其代谢产物变得复杂多样,控制难度变大;细胞生长代谢旺盛,需氧量增大,容器中提高氧的溶解浓度成为一个大的挑战;抑制性代谢物积累至较高的水平,从而影响细胞的进一步增殖;随着细胞密度增加,呼吸速率变快,CO2的去除变得困难;细胞生长的高代谢热负荷使得培养过程中温度的控制存在困难,这一系列的问题导致一般的酵母培养法所得的酵母细胞干重浓度低于30 g/L,因此,要想达到细胞高密度的培养并非易事。虽然,高密度培养存在许多困难,但是,就其成本效益和生产效率而言,它仍然是目前发酵行业最具优势的工业化生产方式。
2 高密度培养的影响因素
通过高密度培养技术以达到理想的生物质产量,需要对发酵过程中的一系列相关工艺参数进行优化控制,进而得到合适的培养方案用于实际操作。
高密度培养过程中的影响因素很多,大致可分为营养性培养因素和非营养性培养因素。
(1)营养性培养因素
酵母菌在生长过程中受到巴斯德效应(The Pasteur Effect)和克雷布特效应(The Crabtrec Effect)的双重调节,严格优化培养基成分和含量对高生物量的获得十分关键。
A.碳源和氮源
碳源是细胞的能量来源,在微生物体内经过一系列复杂的化学变化后转变为其自身细胞用于生长的物质和不同形式的代谢产物。不同的微生物生长代谢过程中所利用的碳源物质存在差异,有的以糖类如单糖、双糖作为能源物质,有的则以有机酸、氨基酸和CO2等作为其生长繁殖的供能物质。氮源作为细胞生长代谢的必需物质其利用也因微生物的不同而有所区别,多数微生物将无机含氮化合物作为其生长代谢所利用的氮源,也有小部分的微生物利用分子态的氮作为其氮源。碳源和氮源之间的比例数值也是影响细胞进行高密度培养的一个重要因素。碳氮比偏小会导致菌体生长过于旺盛,造成菌体的提前衰老和自溶现象的产生;碳氮比过大,增殖形成的细胞数量少,容易造成细胞代谢平衡失控,影响产物的生成。现有的研究中多采用正交试验、响应面优化试验等方法对酵母高密度培养过程中培养基中的碳源和氮源之间的比例关系进行优化。
王纪等(1998)研究发现不同的C源所培育获得的菌体生物量存在很大的差异,酵母在以麦芽糖作为碳源的培养基条件下生长最优,并且,他们发现随着糖浓度的升高,菌体的生物量会有所提高,但两者之间的关系并不呈现简单的比例关系。张博润等(1999)研究了葡萄糖浓度对试验酵母工程菌生长的影响,发现8%的糖浓度可获得最高的生物量。孙占敏等(2009)利用均匀正交试验进行培养基中氮源的优化最终可使细胞干重达到12.74 g/L。
B.无机盐
无机元素是构成细胞组织的成分,具有维持细胞酶活性、渗透压和氧化还原电位的作用。如,磷离子是酵母生长和增殖所必需的无机元素,对于酵母细胞的培养必需供给适量的磷酸盐。大多数的酵母菌种都需要从硫酸盐中吸收硫离子用于自身生长,而K+的存在能够提高其细胞的缓冲能力,进而增强细胞对于硫酸根离子的吸收。在细胞新陈代谢过程中,Mg2+通过影响糖酵解酶的活性从而对酵母的新陈代谢进行调节;Na+可使细胞膜的通透性发生改变,从而对酵母的生长产生影响。添加适量的维生素和微量元素,能显著提高酵母菌的生物量,因此,无机盐离子的添加应在极限值范围内进行合理添加,常用的无机盐离子极限指标是:铵盐5 g/L,磷酸盐10 g/L,氯化钠10 g/L~20 g/L。
(2)非营养性培养因素
A.种子液
种子液的培养是高密度发酵的基础,菌体接种的浓度和所处的生长时期等都会对接种后的培养效果产生影响。接种量小时,菌体的生长迟缓,培养周期延长;接种量大时,菌体对基质的利用速度加快,生长延滞期缩短,可迅速繁殖形成种群优势,降低杂菌沾染的风险,但过高的接种量会使培养基中的营养物质消耗过快,不利于后期细胞的增殖培养。
B.溶解氧
分子态的氧对好氧性微生物的生长是必需的。溶氧浓度(Dissolved Oxygen,DO)是指单位体积培养液中氧溶解的含量。在好氧菌种的高密度培养的过程中,随着菌浓度的增大,单位体积内培养物的摄取氧的速率会加快,使得发酵罐内氧的浓度逐渐降低,当溶氧浓度低于临界值时就会对菌体的生长产生抑制作用,通常通过增大搅拌转速和增加空气流量来维持DO水平在20%~50%范围内,以获得较高水平的菌体细胞生物量。然而,在大规模发酵过程中,好氧菌的高密度发酵溶氧浓度并不是越高越好,纯氧的使用更是容易造成微生物氧中毒。适当的溶氧水平有利于菌体生长和产物合成,溶氧过高或过低对于菌体的生长代谢均有一定的抑制作用,因此,为了正确控制溶解氧浓度,有必要对微生物高密度培养过程中的最适DO值进行探究。
C.温度
微生物的生长的必要条件之一是适宜的温度。对大多数的酿酒酵母而言,菌体生长的适宜温度为28~30℃。一般情况下,当培养温度较低时,酵母细胞内酶的活性也很低,导致菌体生长代谢缓慢,不利于细胞的增殖培养;随着培养温度的升高,细胞中酶的活性增强,酵母生长代谢的速率会随之加快,有利于对其进行培养,但当温度升高至一定限度时,酶的活性则会随之降低至失去活性,而蛋白质、核酸以及其它的细胞组分也都会遭受不可逆的破坏和损伤,从而导致菌体的衰老、死亡。
D.pH
微生物生长代谢需要适宜的酸碱环境,大部分微生物能够在pH5~9的范围内正常生存。在细胞培养过程中,菌体利用营养物质进行自身的生长并产生代谢产物,而代谢产物的积累会导致培养液的pH发生改变,进而致使菌体细胞内酶的活性发生变化,从而对菌体的生长以及产物的合成产生影响,甚至最终改变细胞的代谢途径。对于酿酒酵母来说,pH的适宜范围在4~6之间,当其处于偏碱性环境时,细胞的代谢则会发生异常,发酵的产物中会出现乙酸等抑制酵母生长的物质。
E.生长抑制性物质
酵母菌的有氧培养过程中,如果出现供氧不足、比生长速率过大或者C源供给量比酵母自身所能吸收同化的速率高等情况时,细胞就会产生乙醇等代谢副产物,阻碍菌体的生长和增殖。
CO2是高密度培养中一个重要的抑制因素。一般情况下,培养液中溶解的CO2高于4%,菌体生长就会下降,CO2的溶解量为7%就会对菌体的生长产生抑制。Chen和Gutmanis的研究表明,发酵培养液中的CO2的溶解度控制在1%~3%之间,对酵母生长较为有利。
另外,在高密度发酵的过程中,泡沫的大量产生和消泡剂的不恰当使用也会对高密度培养的结果产生很大的影响。酵母菌在生长繁殖的过程中,会分泌一些蛋白质等的表面活性物质,这些物质会被相间界面吸附,致使发酵液液体的表面张力减小,从而导致单位体积中的相间界面a增大;但当液体的表面活性物质在相间界面上聚集而超过一定的浓度时,则会引起液膜传质系数KL的剧烈下降,导致氧的溶解浓度降低,伴随着酵母增殖过程中呼吸作用的增强,发酵培养液内的DO迅速降到临界水平以下,若此时再加消泡剂或进行补料,而使得DO较长时间地停留在在临界值以下,容易导致菌体的呼吸停止或者发生厌氧生长的情况,并有可能造成菌体自溶现象的产生,进而产生大量的蛋白质和核酸类物质,形成乳化现象,致使高密度发酵失败。
3 高密度培养的方式及研究进展
培养方式对于酵母高密度发酵的成功运作至关重要。高细胞密度的培养方式主要有:分批培养、连续培养和补料分批培养。在酵母的高密度细胞培养的过程中,为了获得高的生物量,需要投入高于生物量几倍的基质,而通过简单地增加基础培养基中的营养成分,当其超过一定的限度时,反而会对细胞的生长产生抑制作用。在实际培养过程中,当培养基中的葡萄糖或其他糖类物质浓度高于酵母生长所需的上限时,即使在氧气充足的情况下,酵母细胞依旧会代谢生成乙醇,这种现象被称为克雷布特效应。乙醇是酵母生长的抑制性物质,既消耗糖类物质又不利于细胞的生长增殖,因此,酵母高密度培养的难点主要集中在如何有效控制糖浓度,在保证酵母正常生长的同时减少溢流代谢,提高原料利用率,实现酵母的高得率、高密度生长。为了能够达到高的细胞密度,必须最小化生长抑制性副产物如乙醇的形成,这可以通过补料分批过程中将糖浓度控制在4~150 mg/L临界值左右来实现,而在实际操作中,临界糖浓度的值的测量和控制都具有一定困难,并且很难达到,因此,实际生产中,糖浓度通常控制在1~2 g/L的水平以达到消除底物抑制作用的目的。
补料分批培养(Fed-BatchCulture),又称流加培养,是根据菌株的生长情况和初始培养基的组分特点,以分批培养为基础而进行的新鲜培养基的间歇性或连续性地补加,使菌体的生长时间和其代谢产物的生产时间延长的培养方式。由于可以最大程度地减小底物对菌体生长代谢的抑制作用,因此,在高密度发酵中补料分批培养较其他培养方法更具优势性。
Yohsdia等(1973)研究者首次提出了“Fed-Batch Culture”的概念,并从理论上建立了第一个数学模型,补料分批培养的方式开始进入理论研究的阶段。
流加培养的关键在于对培养条件和补料方式进行探究优化,以保证培养过程始终处在最佳的状态。补料的流加方式可以分为两大类型:开环式和闭环式。开环式流加方式控制的性能强烈依赖于描述发酵过程动力学模型的精准程度而无需对培养过程的状态变量进行监测,因此,若所建立的动力学模型准确程度低,则会导致控制效果的恶化。闭环式补料分批培养是反馈类型的控制方式,反馈类型分为直接反馈控制和间接反馈控制。直接反馈控制的对象是底物的浓度(葡萄糖浓度、乙醇浓度等),根据对底物浓度的实时监测而对流加速率进行的调控,但由于底物浓度检测的滞后性,使得直接反馈控制方式存在一定的延迟性;间接反馈控制的对象是与菌体生长存在一定关系的发酵状态参数,如溶氧、温度、pH、氧化还原电位、呼吸熵等,这些参数指标可利用发酵罐自身检测系统进行实时在线监测进而间接对培养过程进行调控,在这种控制形式中,进料速率由培养过程中的在线测量参数所控制,而不是底物浓度,这能够较为精确并及时地对培养过程进行有效控制以达到细胞生长要求,有利于细胞的增殖培养。不同的流加补料策略都有其优点和不足之处,下面,就高密度补料的方式进行简略概述。
(1)开环式补料方式
A.恒定速率补料
恒定速率补料,是指浓缩营养物质始终维持恒定的流速进行的补料方式。其流速完全依赖于前期试验所得到的发酵动力学模型,因此,若发酵动力学模型建立准确,则恒定速率补料可以提高菌体密度而达到培养目的,反之则不然。Vu等(2009)通过实验探究酿酒酵母KV-25的生长动力学模型,得到最佳进料速率为22 mL/h,并由此进行高密度细胞培养得到最大酵母干重为187.63 g/L;洒荣波等(2010)研究5 L发酵罐中葡萄糖补料方式对重组毕赤酵母高密度培养的影响,结果显示采用恒速流加补料方式培养酵母,发酵结束菌体干重可达41.5 g/L的水平。
B.指数速率补料
指数速率补料是指依据酵母菌体的生长特点,即利用其呈现指数方式进行增殖的特性,控制进料量也随时间以指数的形式进行增加的一种补料流加的方式。通过改变进料速率,满足菌体在不同生长阶段对营养物质的需求,以达到细胞的高密度培养。指数速率补料的质量流速可以通过以下公式进行计算:
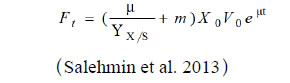
其中,F t :t时刻的进料速率(质量流速);
μ:微生物特定生长速率;
YX/S:基质中的生物量;
m:保留系数;
X0:生物质初始浓度;
V0:培养基初始体积;
t:培养时间。
通过微生物的特定比生长速率对细胞生长增殖进行控制的实例已经有许多的报道,如谢婷等(2015)采用指数流加方式对酵母进行流加培养比分批培养的细胞周期缩短了12 h,最大生物量提高了19.29%,达到了指数流加补料的目的;冯年群(2013)考查了分批培养、恒定速率流加和指数速率流加方式对酵母细胞生长的影响,结果表明指数速率流加是获得高密度细胞培养的最佳选择,细胞干重可达75 g/L。童群义等(2003)比较了几种不同补料分批方式对酿酒酵母生产谷胱甘肽量的效果,得到的结果显示指数速率流加可获得最大的细胞干重,为35.96 g/L。指数速率流加的补料方式比起恒速补料更多地考虑到菌体生长的实际情况,通过比生长速率确定流加速率,因此更加贴合补料需求,在一定程度上更有利于高密度培养的实现。
(2)闭环式补料方式
A.间接反馈控制
间接反馈控制的方式为预先给定一个控制的设定数值,当控制变量的实测值与预设值出现偏差时,反馈控制系统就会根据设定的控制规则自动对操作变量进行调整或者修改,从而使控制变量的实测值较为迅速地回归到设定值的附近。基于DO-stat控制策略的进料方式依赖于在线测量的培养液中的溶解氧的浓度。酵母菌体在生长增殖过程中发酵底物逐渐被消耗,生物量随之增加,细胞的呼吸速率亦随之加快,这时,可以通过逐步增大通气比或者提高搅拌转度的方式增大发酵体系内的传氧系数,确保将溶氧水平控制在最低临界值之上。
随着细胞的进一步生长增殖,培养基中的基质几乎被消耗完毕,此时菌体细胞的呼吸作用会减弱,进而使得发酵培养液中的溶氧量迅速上升,此时,若以溶氧的快速上升作为细胞培养过程的反馈控制指标,则应及时将发酵底物(如葡萄糖)添加到发酵体系中,以使菌体恢复正常呼吸代谢,溶氧恢复至原来的控制水平。经过一段时间后,流加的发酵底物再次被菌体消耗殆尽并引起发酵液中溶氧的又一次上升,重新进行补料的添加后溶氧再度迅速下降至预设值左右。如此周而复始,发酵液中的溶氧形成规律的振动,这种以溶氧迅速上升作为底物流加依据的反馈控制方式称为DOstat流加策略。高烨等(2001)采用控制溶氧脉冲式流加的方式使得酿酒酵母干重达到120 g/L;何向飞等(2008)通过将溶氧浓度控制在合理的水平,使酵母菌体密度达到了5.5~6亿个/mL的水平;Wang等(2010)通过乙醇和溶解氧浓度的反馈控制葡萄糖进料速率,对酿酒酵母GS2进行高密度培养,在培养30 h后获得了122±0.5 g/L的细胞干重。可见,DO-stat控制策略的进料方式可切实提高细胞培养密度,对于高密度培养的实际实施具有一定参考价值。pH-stat控制策略的进料原理与DO-stat方式较为相似,通过细胞增殖过程中代谢酸碱的变化而对进料速率进行调控,同样可应用于高密度培养过程,但实际控制效果较DO-stat控制方式略差。
由于CO2的释放速率与C源的消耗速率大致成比例,可对CO2进行在线测量而对进料速率进行有效控制,而CO2释放速率(CER)与氧气摄入速率(OUR)之比为呼吸熵(RQ),研究表明,如果将RQ控制在1~1.2之间,则不形成乙醇,可以利用该参数对流加过程进行间接控制,因此,采用呼吸熵流加策略也是高密度发酵一种行之有效的策略。
B.直接反馈控制
高密度培养过程中通过对与细胞增殖直接相关的参数进行测定而对补料过程进行控制,是一种较为简单的补料方式。Shang等(2006)通过直接对乙醇浓度进行实时监测的反馈系统控制葡萄糖的流加速率,在5 L发酵培养罐中,控制乙醇浓度低于1%并保持呼吸熵(RQ)约为1,获得酿酒酵母干重高达120 g/L。荣博涵等(2015)以酿酒酵母为发酵菌株,采用残糖反馈分批补料方式优化工艺发酵条件以提高发酵液中菌体密度,最终探究结果为:控制对数期发酵液中残糖含量为0.5~1.5%,可使菌体在培养24 h后达到最大生物量28.88g/L。直接反馈方式的操作相对简易,但由于无法实时对培养过程进行监测调整,因此,在现代的工业化生产中多通过将一些可行的检测值与数学模型耦合来实现对进料速率的控制,以此来补偿某些分析指标无法使用在线传感器进行监测的不足。
高细胞密度培养是酵母工业的发展趋势,实现高浓度、高产率是其目标和方向。补料分批培养方式可以通过控制培养基营养的流加达到生物量和产率的最大化。近年来,随着新型技术的不断更新以及对补料分批培养方式的不断研究,一些更为复杂的数学模型和人工智能技术被应用,补料策略逐渐变得复杂化、精确化。
Gao和Tan(2003)采用不同补料策略对进料进行控制,最终结果表明DO控制与脉冲系统相关联能最大化生物质量,酿酒酵母细胞干重可达51.2 g/L;张许等(2016)将差分进化算法与传统的PID控制策略相结合,构建出了可用于酿酒酵母流加培养过程的在线自适应控制策略,成功将乙醇浓度稳定在设定值(1 g/L)附近,进而达到高密度培养的目的,使酵母细胞的最终浓度达到34.45 g/L的水平。Klockow等(2008)运用流动注射分析(FIA)控制系统在线监测葡萄糖含量,并运用PI前反馈控制器对葡萄糖含量作出准确计算和补充,以达到准确控制培养过程中基质残糖稳定在设定值处,进而实现对培养过程的精确控制。Chopda等(2015)通过采用基于TCP/IP协议的解耦输入-输出线性化控制器(Decoupled Input–OutputLinearizing Controller,DIOLC)实时监测残糖浓度和溶解氧浓度,进而实现酵母生物量的最大化,与使用PID控制器的培养结果相比,DIOLC的培养结果更具优势性,平均生物量提高了23%。