酿酒微生物岗位
刘延琳团队
摘要 目的:为了降低在葡萄酒酿造过程中酿酒酵母的乙醇产量。方法:将编码NADH氧化酶的Spnox 基因过量表达于酿酒酵母T73中,构建胞内异源NADH氧化途径。结果:与出发菌株酿酒酵母T73/pY26相比较,重组菌株酿酒酵母T73/pY26-Spnox胞内总NADH 氧化酶活性提高49%,胞内NADH/NAD+比率降低了9%;酿酒酵母T73/pY26-Spnox发酵模拟葡萄汁所获得的乙醇产量及醇类物质总量分别降低了7%和13%,挥发酸增加了4.5%,挥发性物质种类和含量略有增加。结论:过量表达NADH氧化酶可使葡萄酒在发酵条件下,酿酒酵母合成乙醇或其它醇类物质的能力降低,为进一步优化葡萄酒发酵条件生产降醇葡萄酒打下基础。
普通葡萄酒酒度较高(体积分数12%左右),限制了青少年、育龄妇女、老人、病人等特殊消费群体对葡萄酒的饮用。此外,较高的乙醇浓度有时会严重破坏葡萄酒的香气构成,掩盖有益风味化合物的挥发,增加单宁苦味感等,对葡萄酒的感官质量有显著损伤。如何在葡萄酒的酿造过程中降低其乙醇浓度逐渐成为现代葡萄酒工业关注的热点。当前葡萄酒工业常采用发酵后蒸馏、蒸发、渗析或反渗透等分离措施除去葡萄酒中的乙醇,使之达到降醇、低醇或无醇的要求。然而,这些方法存在设备昂贵,工艺操作复杂,风味物质损失严重等缺陷。基于代谢工程理念构建乙醇合成能力弱化的酿酒酵母菌株,是实现降低葡萄酒酒度最简单、经济和有效的方法。
乙醇合成途径是一条依赖NADH的代谢途径,胞内的NADH可利用性影响细胞的乙醇合成能力,降低胞内的NADH水平,可能使酿酒酵母合成乙醇的能力下降。调节微生物胞内NADH浓度的方法包括生化工程和基因工程两个方面,其中,生化工程方法有补加乙醛或富马酸等外源电子受体,补加不同氧化态的碳源和NAD+合成前体等。此外,调节培养环境,如溶氧或/和培养体系的氧化还原电位也被证实为有效的生化工程方法。基因工程方法包括:过量表达NADH代谢相关酶,删除NADH竞争利用途径和引入异源NAD+再生系统等。
本研究将编码NADH氧化酶的Spnox 基因过量表达于酿酒酵母(S. cerevisiae )T73中,引入了一条异源NADH竞争利用途径,降低胞内NADH水平,从而弱化乙醇合成能力,为生产降醇或低醇葡萄酒提供一种工艺操作简单的新型备选方案。
1 材料与方法
1.1 材料与设备
(1)菌株和质粒 酿酒酵母(S. cerevisiae )T73(△ura3 ),中国农业大学燕国梁副教授惠赠;大肠杆菌JM109,大连宝生物公司;质粒pY26,江南大学刘立明教授惠赠。
(2)主要试剂与仪器
细菌质粒提取试剂盒、酵母质粒提取试剂盒、DNA胶回收试剂盒、酵母快速转化试剂盒,美国Omega生物技术公司;辅酶ⅠNAD(H)含量试剂盒、辅酶ⅡNADP(H)含量试剂盒、NADH氧化酶检测试剂盒,苏州科铭生物技术有限公司;蛋白胨、酵母膏、酵母浸粉、酸水解酪蛋白,北京奥博星生物技术有限责任公司。
(3)主要设备
MJX智能霉菌培养箱,宁波江南仪器厂;ELX800酶标仪,美国BioTek公司;MB100微孔板恒温振荡器,杭州奥盛仪器有限公司;SBA生物传感分析仪,山东省科学院生物研究所;PTC-200DNA Engine Cycler PCR扩增仪,美国Bio-Rad 公司;DYY-6C核酸电泳仪,北京六一仪器厂;Gel.Doc2000 UVP 凝胶成像仪,美国Bio-Rad公司;120150-T230L型气相色谱法-质谱联用仪,美国ThermoFinnigan公司。
(4)培养基
LB培养基;YPD培养基;SDUra培养基;模拟葡萄汁。
1.2 试验方法
(1)菌株培养方法
酿酒酵母T73的活化:将-20℃保藏的酿酒酵母T73接种于SD-Ura培养基,置于2 5 ℃恒温摇床,200r/min活化24 h。模拟葡萄汁发酵: 将活化好的菌株, 按照2%的接种量,接种至装有250mL模拟葡萄汁的500mL三角瓶中,置于25℃条件下静置发酵,并在发酵过程中检测OD560nm、糖的消耗、乙醇的合成,在发酵中期(第7天)取样检测细胞内NADH、NAD+、NADPH和NADP+的含量。
(2)表达载
根据NCBI数据库中肺炎链球菌(Streptococcus pneumoniae )基因(以下简称Spnox )序列,利用primer premier 5.0软件设计引物Spnox P1和Spnox P2。引物委托宝生物工程(大连)有限公司合成,序列如下:Spnox P1: 5’-TCCCCTACTTGACTAATAAG- 3 ’ , S p n o x P 2 : 5 ’ -CCCAAAACCTTCTCAAGCAA-3’。Spnox 的PCR产物和载体pY26分别用Bam H I和Sac I双酶切,酶切产物电泳纯化后,16℃,T4 DNA连接酶连接,连接产物转化大肠杆菌(E. coil )JM109 感受态细胞,氨苄青霉素筛选阳性克隆子,并用Bam H I和Sac I双酶切方法验证重组质粒pY26-Spnox。
(3) 重组菌株T7 3 /pY26-Spnox的构建及验证
将质粒pY26及pY26-Spnox利用酵母快速转化试剂盒转化酿酒酵母T73(△ura3 )感受态细胞,将转化液分别涂布在SD-Ura平板上,30℃培养4 d后挑转化子于新的液态SD-Ura平板上30 ℃培养32 h,使用酵母质粒提取试剂盒挑单菌落(转化子)提取质粒,并进行菌落PCR验证。
构建及验证根据NCBI数据库中肺炎链球菌(Streptococcus pneumoniae )基因(以下简称Spnox )序列,利用primer premier 5.0软件设计引物Spnox P1和Spnox P2。引物委托宝生物工程(大连)有限公司合成,序列如下:Spnox P1: 5’-TCCCCTACTTGACTAATAAG- 3 ’ , S p n o x P 2 : 5 ’ -CCCAAAACCTTCTCAAGCAA-3’。Spnox 的PCR产物和载体pY26分别用Bam H I和Sac I双酶切,酶切产物电泳纯化后,16℃,T4 DNA连接酶连接,连接产物转化大肠杆菌(E. coil )JM109 感受态细胞,氨苄青霉素筛选阳性克隆子,并用Bam H I和Sac I双酶切方法验证重组质粒pY26-Spnox。
(4) 重组菌株T7 3 /pY26-Spnox的构建及验证
将质粒pY26及pY26-Spnox利用酵母快速转化试剂盒转化酿酒酵母T73(△ura3 )感受态细胞,将转化液分别涂布在SD-Ura平板上,30℃培养4 d后挑转化子于新的液态SD-Ura平板上30 ℃培养32 h,使用酵母质粒提取试剂盒挑单菌落(转化子)提取质粒,并进行菌落PCR验证。
1.3 参数测定方法
酿酒酵母生物量(OD值)的测定,利用ELX800酶标仪对样品在560 nm波长下进行OD值检测。还原糖的测定,采用DNS法;挥发酸的测定,参照GB15038-2006T进行;挥发性物质的检测,利用GC/MS进行检测分析;乙醇的测定,SBA生物传感分析仪测定;NADH、NAD+、NADPH和NADP+的提取和测定,按照试剂盒说明书;细胞内总NADH 氧化酶(TDH)活性测定,按照试剂盒说明书。
2 结果与分析
2.1 重组质粒及重组菌的构建及验证
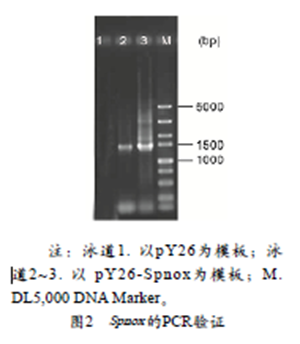
将人工合成的肺炎链球菌 nox基因(Spnox )与经过Bam HI和SalI双酶切的质粒pY26进行连接,获得含有Spnox 基因的酵母表达质粒pY26-Spnox(图1)。对重组质粒pY26-Spnox进行DNA测序,结果证明Spnox 基因正确插入了质粒pY26中,并且在此过程中Spnox 基因没有产生突变。将质粒pY26-Spnox转化酿酒酵母T73(以下简称T73),挑选SD-Ura培养基上的克隆子并提取质粒,并以Spnox P1/P2为上下游引物,对Spnox 基因进行PCR扩增验证。结果如图2所示,在1000~1 500bp之间有一清晰条带,条带大小符合预期,验证结果表明质粒pY26-Spnox已经成功转化到T73中,即成功构建了酿酒酵母T73/pY26-Spnox工程菌株(以下简称T73/pY26-Spnox)。
2.2 异源NADH氧化酶在酿酒酵母T73中有活性表达
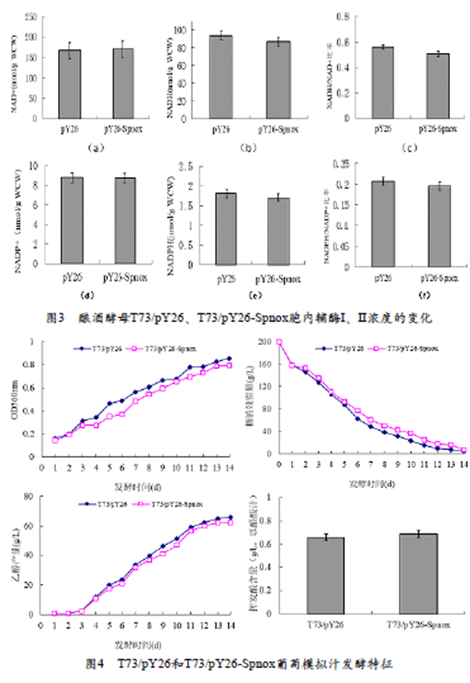
将T73/pY26和T73/pY26-Spnox分别接种到模拟葡萄汁中,待发酵到第7天时,利用NADH氧化酶检测试剂盒,测得T73/pY26和T73/pY26-Spnox中NADH氧化酶的活性分别为1.5 U/mg蛋白和2.9 U/mg蛋白,T73/pY26-Spnox较T73/pY26提高了49%,表明异源NADH氧化酶成功表达于T73中,并具有活性。与T73/pY26相比,同时期T73/pY26-Spnox胞内NADH含量、NAD+含量、NADH/NAD+比率、NADPH含量、NADP+含量、NADPH/NADP+比率,分别变化-7%,+2%,-9%,-6%,-0.4%,-5%(图3),然而,变化不显著。
2.3 过量表达NADH氧化酶对酿酒酵母乙醇产量的影响
分别将T73/pY26和T73/pY26-Spnox接入模拟葡萄汁中进行发酵,测定其OD560nm、糖、乙醇的含量变化,并在发酵结束后检测酒样挥发酸含量(图4)。结果显示:
(1)T73/pY26和T73/pY26-Spnox均能在14 d时顺利完成发酵;(2)发酵结束时,与T73/pY26相比,T73/pY26-Spnox的乙醇产量降低了7%(酒度约0.6%vol),T73/pY26-Spnox的挥发酸产量增加了4.5%。
2.4 过量表达NADH氧化酶对挥发性物质的影响
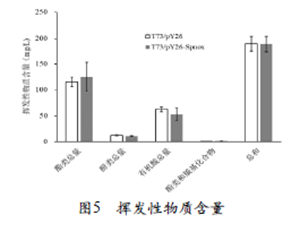
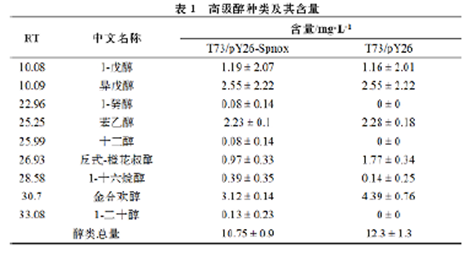
对T73/pY26-Spnox和T73/pY26发酵的模拟酒挥发性物质进行GC/MS分析,共测得55种挥发性物质。其中,酯类28种,醇类9种,有机酸类15种,酚类和羧基化合物3种。与T73/pY26比较,T73/pY26-Spnox的酯类物质总量增加了8%,有机酸总量降低了16%,醇类物质总量减少了13%(图5),而常见的高级醇如1-戊醇和异戊醇的含量无显著变化(表1)。其中,T73/pY26-Spnox和T73/pY26的发酵样品中都能检测到的醇类物质有6种,含量大小排序为:具有铃兰花香和青草香的合欢醇(T73/pY26>T73/pY26-Spnox),具有苦杏仁味和涩味的异戊醇( T 7 3 / p Y 2 6 -Spnox>T73/pY26),具有玫瑰花香、蔷薇香气、花粉味的苯乙醇(T73/pY26>T73/pY26-Spnox),具有醇香、涩味的1-戊醇(T73/pY26-Spnox>T73/pY26);具有玫瑰、铃兰和苹果花香的反式-橙花叔醇(T73/pY26>T73/pY26-Spnox)。此外,1-二十醇、1-癸醇和十二醇只在T73/pY26-Spnox发酵的模拟酒中检测到。
3 讨论
降低葡萄酒酒度是葡萄酒工业亟需解决的问题,开发乙醇合成能力较低的酿酒酵母,是实现降低葡萄酒酒度最简单和经济的方法。NADH作为一种重要的辅因子参与微生物细胞至少300个氧化还原反应,其胞内含量对依赖NADH的相关代谢途径产生重要影响。
本文在酿酒酵母T73中,过量表达由Spnox 基因编码的NADH氧化酶,加速细胞内的NADH氧化,降低胞内NADH水平,进而实现降低酿酒酵母合成乙醇的目的。将编码NADH氧化酶的Spnox基因过量表达于酿酒酵母T73中,构建一株胞内总NADH氧化酶活性提高49%的重组菌株酿酒酵母T73/pY26-Spnox。与酿酒酵母T73/pY26比较, 重组菌株酿酒酵母T73/pY26-Spnox胞内NADH含量下降了7%,NAD+水平提高了2%,NADH/NAD+比率降低了9%,表明Spnox 基因的表达促进了胞内NADH快速氧化为NAD+,使乙醇合成量降低了7%,然而,降低幅度并不显著。在有氧条件下,Heuxa等在酿酒酵母中表达来自乳酸乳球菌的编码NADH氧化酶的noxE 基因,使乙醇产率减少了13%;Vemuri等同样在酿酒酵母中过量表达Spnox 基因,结果将乙醇产率降低了16%;而Qin等在非酿酒酵母(Torulopsisglabrata )中过量表达NADH氧化酶,可使乙醇产量降低33%。上述研究显示,酵母细胞内过量表达NADH氧化酶,在有氧条件下可显著降低乙醇产量。
本研究的乙醇产量降低不显著,可能由于在葡萄酒发酵过程中,发酵液中的溶氧不足以支撑NADH氧化酶功能的完全发挥,而NADH氧化酶的催化过程需要氧作为电子受体。在后续研究中可以采用微氧装置来控制发酵过程中的氧含量,进而实现显著降低酿酒酵母乙醇合成能力的目标。