土壤和产地污染管控与修复岗位
摘要:镉对葡萄生长发育和品质危害显著,我国果园低浓度镉污染问题突出,砧木嫁接可提升葡萄镉胁迫适应能力,但嫁接后葡萄响应镉胁迫的转录 - 代谢协同调控机制尚未明确。本研究以 SM/SO4、SM/5BB、SM/3309C 三种砧穗组合的阳光玫瑰葡萄二年生苗为材料,采用不同浓度镉处理土壤,通过 RNA-Seq 和非靶向代谢组技术,结合转录组与代谢组 KEGG 富集联合分析,探究低镉胁迫下葡萄叶片基因表达与代谢产物的协同变化规律。结果表明,三种砧穗组合在转录 - 代谢联合层面的响应存在显著差异:SM/SO4 组在 0.4mg/kg 镉胁迫下,甘氨酸 - 丝氨酸 - 苏氨酸代谢、乙醛酸和二羧酸代谢通路中基因与代谢物协同富集;SM/5BB 组在 0.8mg/kg 镉胁迫下,类黄酮生物合成、植物激素信号转导通路的基因 - 代谢物关联显著;SM/3309C 组在 0.4mg/kg 和 0.8mg/kg 镉胁迫下,ABC 转运蛋白通路均呈现基因与代谢物协同响应特征。联合分析揭示,氨基酸代谢、碳水化合物代谢、ABC 转运蛋白及次级代谢物生物合成通路是葡萄响应低镉胁迫的核心协同通路。本研究为阐明嫁接葡萄响应镉胁迫的分子调控网络提供了新视角,也为阳光玫瑰葡萄砧木选择和抗镉栽培提供了理论支撑。
1 引言
葡萄是全球广泛种植的经济果树,阳光玫瑰作为优质鲜食品种,市场需求持续增长。镉作为毒性强、迁移性高的重金属污染物,已成为果园土壤主要环境胁迫因子,即使低浓度也会影响葡萄生理代谢和果实品质。嫁接技术通过砧木与接穗的协同作用,可有效提升植物抗逆性,但其调控葡萄响应镉胁迫的分子机制仍需深入解析。
镉对于植物来说是非必需的生理元素。与其他重金属相比,Cd是一种相对可移动的元素,极易被植物根系吸收和转运,即使很低浓度的Cd也会对生物体造成危害(Chen and Kao, 1995)。Yang等(2018)调查发现,36.7%的土壤样品中Cd浓度超出了中国土壤环境质量标准(GB15618-1995)的II级值(0.3 mg/kg)。因此,研究植物如何应对镉胁迫是十分必要的。李小红(2018)发现嫁接可以提高矢富罗莎葡萄植株对Cd胁迫的耐受性,但葡萄植株对Cd胁迫的响应机制不仅与Cd处理的浓度和时间相关,还与品种密切相关,而Cd对阳光玫瑰鲜食葡萄的影响,还未见报道,同时,不同砧木嫁接阳光玫瑰葡萄对Cd的富集和抗性特点、嫁接后阳光玫瑰葡萄在Cd胁迫下的生理生化反应以及转录和代谢水平的变化,尚不清楚。
转录组与代谢组联合分析能从基因表达和代谢产物两个层面揭示生物胁迫响应的协同调控网络,已在植物抗逆研究中广泛应用。此前研究已明确不同砧木嫁接葡萄在抗氧化系统、转录组和代谢组层面的单独响应特征,但低镉胁迫下基因表达与代谢产物的协同变化规律,以及不同砧穗组合的协同调控差异尚未明确。因此,本研究通过转录组与代谢组联合分析,探究三种砧穗组合响应低镉胁迫的核心协同通路和关键调控节点,为完善葡萄抗镉机制研究和指导生产实践提供科学依据。
2 材料与处理
2.1 试验材料与方法
本研究中使用的葡萄材料为嫁接一致的一年生阳光玫瑰,所选的砧木品种分别为SO4、5BB和3309C三种常见的阳光玫瑰砧木品种,嫁接苗采用简写形式分别为SM/SO4、SM/5BB和SM/3309C。
葡萄园土过筛,每盆称重20kg,将CdCl2按需换算为Cd浓度梯度。Cd浓度梯度为0 mg/kg、0.2 mg/kg、0.4 mg/kg、0.8 mg/kg、1.6 mg/kg、3.2 mg/kg,后将每盆所需CdCl2溶于500 ml蒸馏水,边铺土边喷含Cd溶液,最后搅拌3-5次,保证充分混匀。每个Cd浓度处理的每种砧木设置3个生物学重复,以0 mg/kg的为对照组,共计54盆。定植28天后,待叶片长到6-8片叶时,取长势好、成熟、完整的葡萄叶片于12 小时收集样品,立即在液氮中冷冻,并储存在-80℃冰箱,用于转录组和非靶向代谢组分析。
本研究使用0 mg/kg、0.4 mg/kg、0.8 mg/kg、3.2 mg/kg镉胁迫28天后的三种砧穗组合的葡萄叶片,分为12组,每组两个生物学重复,共计24个样品进行转录组测序。
2.2 转录组测序及分析
2.2.1 基础生信分析
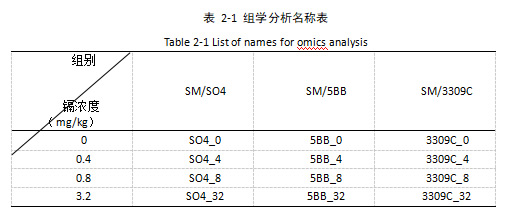
本研究使用0 mg/kg、0.4 mg/kg、0.8 mg/kg、3.2 mg/kg镉胁迫28天后的三种砧穗组合的葡萄叶片,分为12组,每组两个生物学重复,共计24个样品进行转录组测序。文库构建和测序均在美吉生物技术有限公司(中国上海)完成。其中组学分析样本名称采用简写,如表2-1所示。
数据初步分析,包括使用HISAT2将筛选后的RNA-seq数据与参考基因组进行比对;利用表达定量软件RSEM将测序读长进行组装并评估其表达量;采用FPKM计算公式计算基因转录水平的相对表达量等均在美吉生物云平台(https://cloud.majorbio.com/)完成。用DESeq2分析葡萄叶片样品组内及组间的差异表达,然后差异基因的GO注释、KEGG富集分析、转录因子家族统计以及WGCNA分析均在美吉生物云平台完成。具体分析软件详情如下表所示:

2.2.2 差异表达基因的实时荧光定量PCR
本试验挑选30个差异基因进行qRT-PCR 分析。利用qPrimerDB 网站和Primer 5 软件查找和设计引物,引物序列如表2-3所示,反应条件为:95℃预变性3min 之后,95℃变性10s,55℃退火30s,后二步进行40 个循环。以VvGAPDH为内参基因,∆∆CT方法进行数据分析。
2.3 代谢组分析
2.3.1 样本制备与上机分析
代谢组样本与上述转录组相同,分为12 组,每组有6 个生物学重复,共计72个样品进行代谢组样本制备,上述过程由上海美吉生物有限公司完成。具体设备、试剂及参数如下表所示:
2.3.2 差异代谢物分析
本试验中差异代谢物的选择是在美吉生物云平台上根据OPLS-DA模型所得变量权重值(VIP)和student's t检验p值来确定,即P<0.05且VIP>1的代谢物为差异代谢物。获得的差异代谢物通过比对HMDB 4.0数据库,进行分类与统计,用Python软件包scipy.stats进行通路富集分析,并通过Fisher精确检验获得与镉胁迫相关的生物学途径。具体分析软件详情如下表所示:
3.结果与分析
3.1 转录组与代谢组数据质量评估
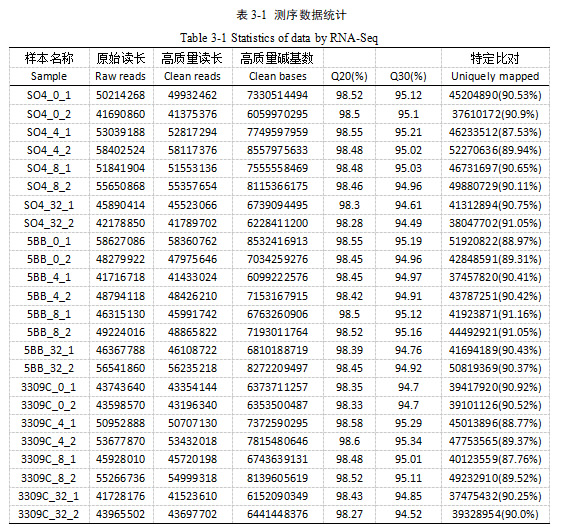
本试验采用Illumina测序完成了葡萄叶片24个样品的转录组测序,构建了Illumina PE文库,对获得的原始测序数据进行质量控制,以保证后续分析的顺利进行。如表3-1 所示转录组测序共获得 171.59Gb Clean Data,各样品 Q20≥98%、Q30≥94%,与葡萄参考基因组的比对率≥87%,表明测序数据质量可靠。
样本经液相色谱分离条件得到的数据, 采用主成成分分析,观察各样本之间整体分布趋势。如图3-1,代谢组检测共鉴定出 742 个代谢物,其中正离子模式 426 个、负离子模式 316 个;PCA 分析显示 QC 样品聚集良好,12 组样品分离明显,生物学重复稳定性高,满足联合分析要求。
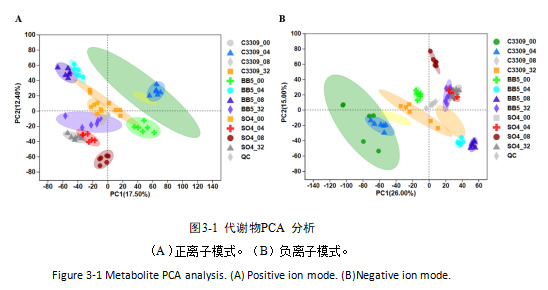
3.2 差异基因与差异代谢物筛选
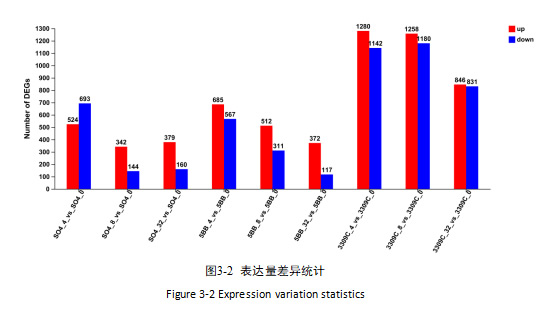
本试验中,我们以p-adjust<0.05且|log2FC|≥1,对葡萄叶片不同浓度镉胁迫的基因进行筛选。由图3-2可知,与对照组相比,SM/SO4 组在 0.4mg/kg、0.8mg/kg、3.2mg/kg 镉胁迫下分别筛选出 1217、486、539 个 DEGs;SM/5BB 组分别筛选出 1252、823、489 个 DEGs;SM/3309C 组分别筛选出 2422、2438、1677 个 DEGs。
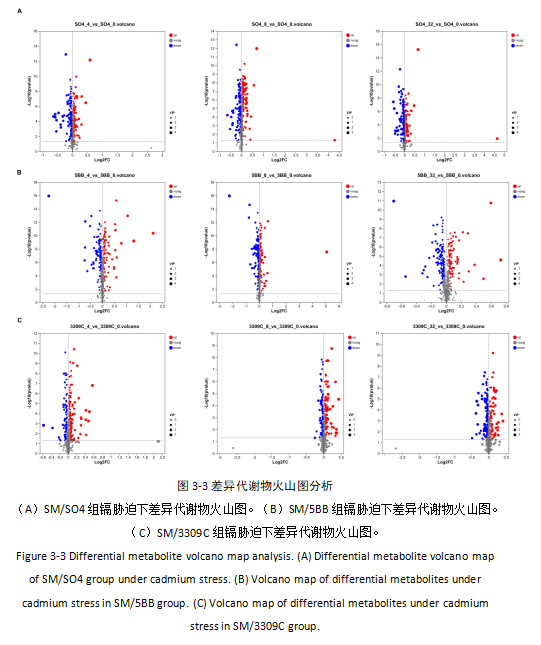
基于LC-MS检测平台和自建数据库共检测到742个代谢物。其中正离子模式下共检测到426个代谢物、负离子模式下共检测到316个代谢物。以P<0.05、fold change>1 或fold change<1和VIP(Variable Importance InProjection)>1为标准进行差异表达代谢物(Differentially expressed metabolites、DEMs)的筛选。如图3-3可示,SM/SO4 组在上述镉浓度下分别鉴定出 190、206、189 个 DEMs;SM/5BB 组分别鉴定出 185、191、199 个 DEMs;SM/3309C 组分别鉴定出 201、159、168 个 DEMs,差异代谢物主要涉及氨基酸、碳水化合物、脂类等类别。
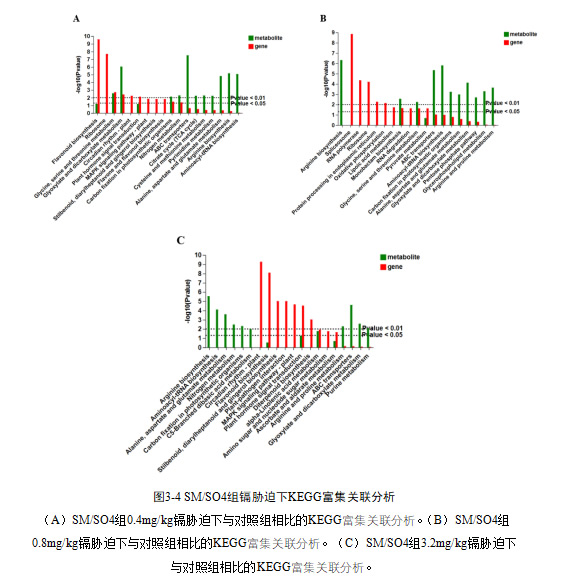
3.3 三种砧穗组合转录组和代谢组KEGG富集联合分析
SM/SO4组在0.4mg/kg的镉胁迫下有11个基因和3个代谢物显著富集到甘氨酸、丝氨酸和苏氨酸的代谢,11个基因和6个代谢物显著富集到乙醛酸和二羧酸代谢,8个基因和2个代谢物显著富集到光合生物中的碳固定,5个基因和2个代谢物显著富集到氮代谢(图3-4A);在0.8mg/kg的镉胁迫下有23个基因和3个代谢物显著富集到黄酮类生物合成,4个基因和2个代谢物显著富集到丙氨酸、天冬氨酸和谷氨酸的代谢(图3-4B);在3.2mg/kg的镉胁迫下有5个基因和2个代谢物显著富集到亚麻酸代谢(图3-4C)。

SM/5BB组在0.4mg/kg的镉胁迫下有16个基因和2个代谢物显著富集到谷胱甘肽代谢(图3-5A);在0.8mg/kg的镉胁迫下有39个基因和3个代谢物显著富集到类黄酮生物合成(图3-5B),15个基因和2个代谢物显著富集到植物激素信号转导通路;在3.2mg/kg的镉胁迫下转录组和代谢组没有共同显著富集的通路(图3-5C)。
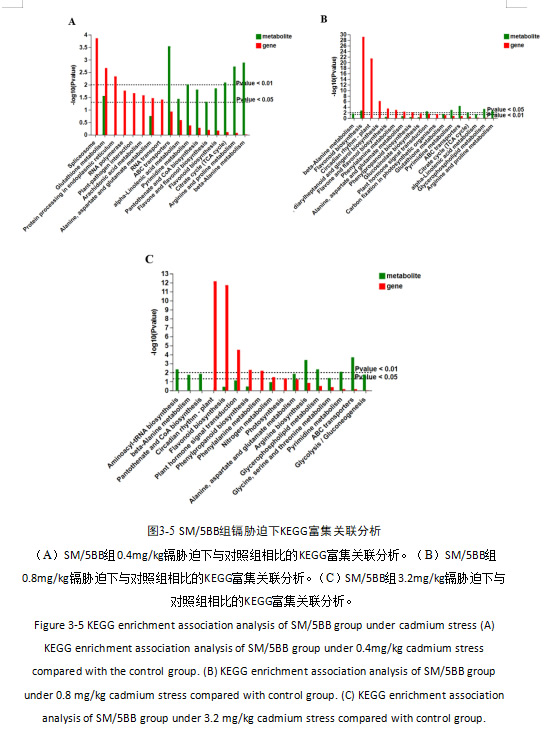
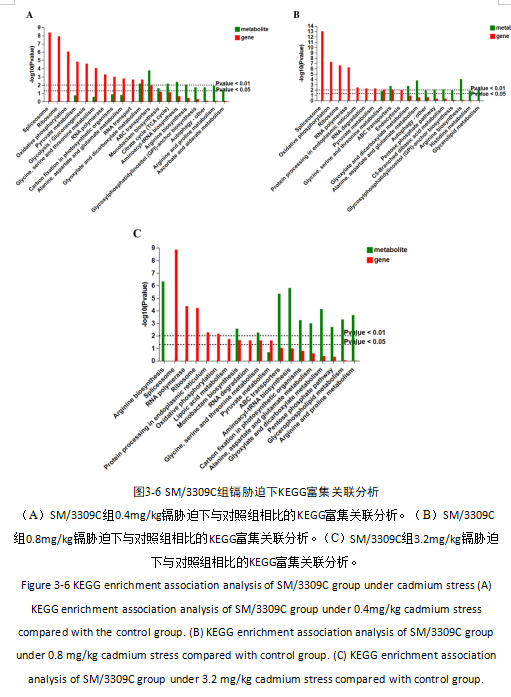
SM/3309C组在0.4mg/kg的镉胁迫下有19个基因和3个代谢物显著富集到乙醛酸和二羧酸的代谢,14个基因和6个代谢物显著富集到ABC转运蛋白(图3-6A);在0.8mg/kg的镉胁迫下有16个基因和2个代谢物显著富集到甘氨酸、丝氨酸和苏氨酸的代谢,14个基因和4个代谢物显著富集到ABC转运蛋白(图3-6B);在3.2mg/kg的镉胁迫下有3个基因和3个代谢物显著富集到单巴坦生物合成,11个基因和3个代谢物显著富集到甘氨酸、丝氨酸和苏氨酸的代谢(图3-6C)。
综上所述,转录组和代谢组联合分析表明,镉胁迫下不同砧木和不同镉浓度均会影响基因和代谢物的通路富集。镉胁迫影响了葡萄植株的氨基酸代谢,能量代谢,碳水化合物代谢,次级代谢物生物合成,信号转导,膜运输及脂类代谢等途径,这些代谢通路在嫁接阳光玫瑰葡萄响应镉胁迫中可能发挥着重要作用。
4 结论
本研究通过转录组与代谢组联合分析,揭示了三种砧穗组合响应低镉胁迫的协同调控差异。SM/SO4 组依赖氨基酸代谢和碳水化合物代谢的协同作用应对镉胁迫,SM/5BB 组以抗氧化代谢和信号转导通路协同调控为主,SM/3309C 组则通过转运蛋白和能量代谢通路协同响应。氨基酸代谢、碳水化合物代谢、ABC 转运蛋白及次级代谢物生物合成通路是嫁接阳光玫瑰葡萄响应低镉胁迫的核心协同通路。研究结果为深入解析嫁接葡萄抗镉的分子调控网络提供了新依据,也为生产中根据土壤镉污染程度选择适宜砧木提供了科学参考。