鲜食葡萄栽培岗
马瑞阳 陶建敏 郑焕
芽休眠和萌发是两个连续的生物学过程,国内外学者致力于其过程中的形成原因、生理特征和解除机理,解决生产上芽萌发迟、萌芽率低且不整齐、产期调控等相关问题(Pérez and Noriega, 2018)。解决芽休眠解除和萌发问题对热带、亚热带地区葡萄产业发展尤为重要。单氰胺在果树生产活动中,作为调控植物芽休眠的破眠剂,得到广泛应用,但作用机制尚未完全揭示。
近年来,组学技术(转录组学、蛋白质组学和代谢组学)在单氰胺解除葡萄芽休眠研究中广泛应用(Muhammad et al., 2017;Michailidis, 2018;董阳,2020)。因此,本研究以第二章和第三章研究为基础,继续以T1处理(单氰胺浓度25000 mg/L)‘阳光玫瑰’葡萄芽组织为试材,利用新一代转录组测序技术(RNA-Seq),分析芽萌发过程中基因表达的差异和模式变化情况;结合转录组测序结果筛选葡萄芽休眠解除及萌发的相关重要基因表达量变化。通过转录组测序分析,筛选休眠解除及萌发过程中的差异表达基因,研究结果将为热带地区葡萄芽休眠解除及萌发等理论研究提供参考,也能为葡萄产业发展和设施栽培等提供理论依据。
1 材料与方法
1.1 试验材料
试验所用材料来自本研究中第二章1.2试验设计中所提到的备用采样枝条。 根据先前研究基础,本章选取T1处理(单氰胺25000 mg/L)涂抹芽和CK(清水)涂抹芽为试材,分别在处理后第2和6天采取备用采样枝条3-5节位葡萄芽进行转录组测序分析,共4个样品组,每种样品3个生物学重复,委托北京诺禾致源科技公司进行转录组测序。
1.2 试验方法
转录组测序是一种基于第二代测序的高通量测序转录组分析方法,基于Illumina测序平台,研究特定时期和特定条件下,组织或细胞转录出来的所有RNA集合,包括信使RNA、核糖体RNA和转运RNA及非编码RNA。
1.2.1 芽组织样品RNA提取
委托北京诺禾致源科技公司进行RNA提取及浓度检测。
1.2.2 文库构建和质控
通过Oligo(dT)磁珠富集葡萄芽组织样品中带有polyA尾的mRNA。首先,以随机的寡核苷酸为引物,将mRNA打段为片段化模版,并合成cDNA第一条链。然后,用RNaseH降解RNA链,以dNTPs为原料合成cDNA第二条链。最后,双链cDNA经过纯化、末端修复、加A尾并连接测序接头等过程,最终获得文库。文库构建完成后,经稀释、定量,保证文库质量合格。使用NCBI官网最新的Vitis vinjfera基因组作为参考基因组,采用Illumina测序平台进行测序。
1.2.3 测量数据质量评估及序列比对
对原始数据进行过滤,保证数据分析的质量及可靠性,主要是对带接头的reads、含N的reads和低质量的reads进行去除。然后对过滤后的数据进行测序错误率检查、GC含量分布检查,即可获得后续分析使用的clean date。使用HISAT2 v2.0.5软件将clean date与参考基因组进行比对,便于后续数据分析。
1.2.4 基因表达水平分析
一般用FPKM来表示RNA-seq的基因表达值,通过制作PCA图评估组间差异及组内样本重复情况。组间样品应该呈现分散状态,组内样品应该呈现聚集状态。获取各样本全部基因的FPKM值并计算每个样品之间所有基因表达量的Pearson相关系数,以热图形式展现,进行相关性分析。相关性系数可以反映各个样品间总体基因表达情况的相似情况,系数越大,其表达模式越为相似,样品间重复性越好。
1.2.5 差异表达基因筛选
以|log2(FoldChange)|≥1、padj≤0.05作为差异基因筛选标准,使用DESeq2(1.20.0)软件对样品组进行差异表达基因分析。
1.2.6 差异表达基因的GO和KEGG富集分析
使用clusterProfiler软件对差异基因进行对差异基因集进行GO功能富集分析和KEGG通路富集分析。GO通路富集分析以padj小于0.05时视为显著富集的阈值,包含生物学过程(Biological Process),分子功能(Molecular Function)和细胞组分(Cellular Component)三个主要组分。KEGG通路富集分析以padj小于0.05作为显著性富集的阈值,用来确定参与代谢途径和信号转导途径的差异基因数。
1.2.7 与芽萌发相关的差异基因筛选
根据GO和KEGG通路富集分析结果,找出差异基因显著富集的GO term和KEGG term,并进一步筛选关键基因。
1.3 数据统计与分析
使用EXCEL 2021软件对数据进行整理,R语言绘制差异基因组间火山图、维恩图、表达水平聚类图等。
2 结果与分析
2.1 转录组测序质量评估
在完成转录组测序后,为保证后续数据分析的质量及可靠性,对12个样品的原始数据进行过滤筛选,共得到583135620条高质量序列。如表4-1所示,测序获得总碱基(Raw Bases)90.75Gb,对原始碱基质控后共得到87.47Gb过滤碱基(Clean Base),每个样品的过滤碱基均大于6.84Gb。测序数据显示,Q20碱基百分比均在98%以上,Q30碱基百分比均在96%以上,且各样本GC含量在43.55 %~46.02%以上,以上结果表明测序质量比较高,可用于后续研究。
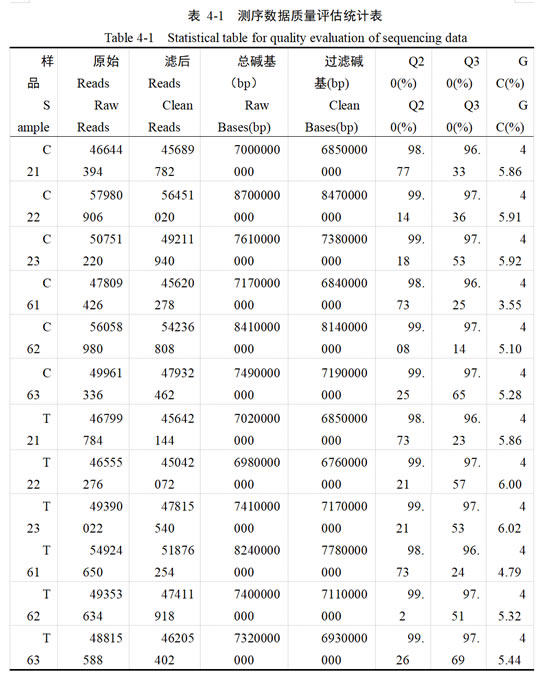
2.2 转录组测序数据与参考基因组比对分析
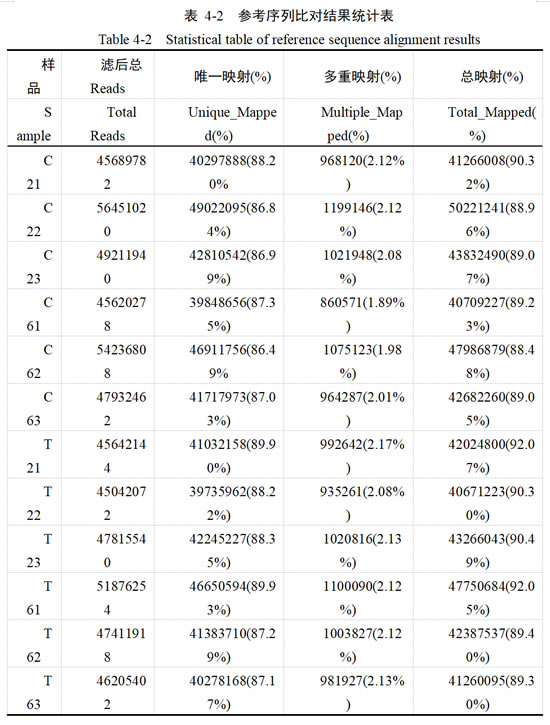
通过使用HISAT2(Hierarchical Indexing for Spliced Alignment of Transcripts),将各样品的Clean Reads与参考基因组进行比对。结果如表4-2所示,有86.49%-89.93%的有效Reads被唯一注释到参考基因组;1.89%-2.17%的有效Reads被多处注释到参考基因组中;各样品有效Reads中总注释到参考基因组的占比在88.48%-92.07%之间。转录组测序数据与参考基因组序列比对的结果符合要求,进一步说明了测序结果良好,clean reads 质量合格,可进行下一步数据分析。
2.3 基因表达水平分析
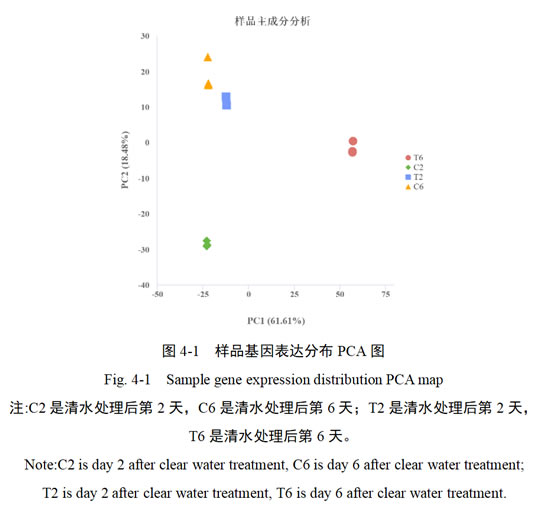
根据基因的TPM值对12个样品进行主成分分析,进一步确定样本之间的重复性和各样品之间的相关性。PC1可以解释转录组数据61.61%的变量,PC2可以解释18.48%的变量,共占总变量的80.09%,说明可以代表所有变量。每个样品的3个生物学重复聚集在一起,说明样品之间重复性较好。样品之间沿PC1轴和PC2轴都明显分开,说明取样合适(图4-1)。
2.4 基因表达差异与聚类分析
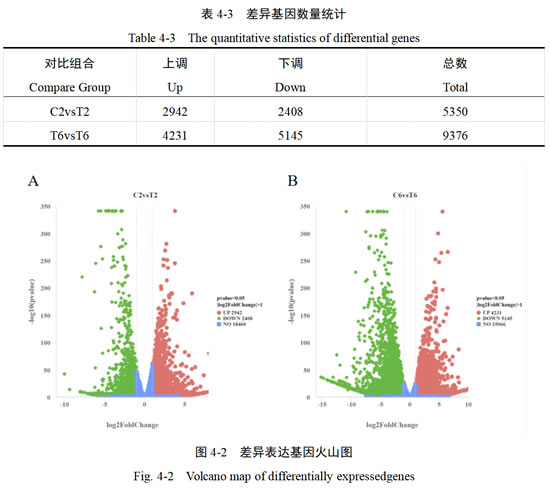
本研究将所有数据merge在一起,分为C2vsT2、C6vsT6二组进行比较。使用基于负二项分布原理的DEseq2方法,对差异表达基因进行DEG检测,以|log2(FoldChange)|≥1、padj≤0.05为筛选条件,不同对比组合的样品DEGs数量被注释。与对照组相比,单氰胺处理后第2天有2942个基因显著上调,2408个基因显著下调;单氰胺处理后第6天,有4231个基因显著上调,5145个基因显著下调。
为了更加快速高效地鉴定差异基因组间有显著性差异,log2FoldChange|>1、padj<0.05|为筛选条件,绘制火山图。点越靠近顶部,表示差异越显著。即差异基因在左上角和右上角集中分布,在基因富集和分类时间值得特别关注(图4-2)。
通过将FPKM值进行聚类分析,使用SAM算法绘制差异基因聚类分析热图,衡量样品之间表达的相似性。横轴代表样品组间二个样本,各三个重复;纵轴代表样本间的差异基因表达情况。横轴被聚类为两类,代表组间样品数据的稳定性;纵轴聚类筛选出组间功能相似的差异表达基因,为后续富集分析提供数据基础(图4-3)。
使用R语言Vennerable语言包制作差异基因组间韦恩图,更加直观地观测单氰胺(T)处理后基因表达量变化情况。通过总表达维恩图展示对比组合中唯一表达的基因数量,重叠区域表示两个或更多对比组合中共表达的基因数量。结果表示,C2vsT2、C6vsT6二组重复区域共包括2594个差异共表达基因值得关注(图4-4)。

2.5 差异基因富集与分类分析
2.5.1 差异基因GO分析
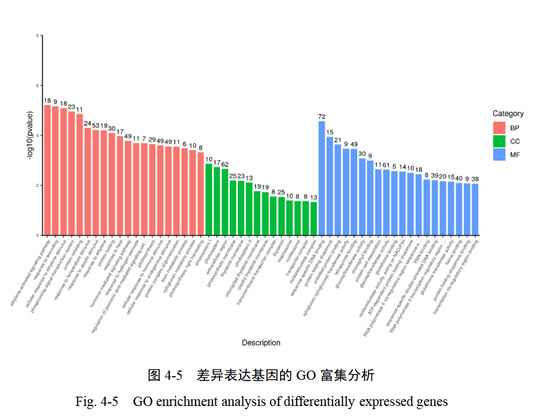
为具体研究不同处理间差异基因的大体功能,使用Blast2GO对两个对比组合间(C2vsT2和C6vsT6)的共表达基因进行GO注释。GO富集分析用于预测基因的生物功能,主要分为生物过程(Biological Process,BP)、分子功能(Molecular Function,MF)和细胞组分(Cellular Component,CC)三类。本研究鉴定了单氰胺(T)处理葡萄芽后,第2、6天两个时期中差异基因的功能,对2594个差异基因进行GO注释分析。结果表明,所有差异基因分布160个条目中,其中,生物过程、分子功能和细胞组分分别富集到97、14、49个条目。根据GO富集分析结果,选取生物过程和细胞组分中最显著的20个Term以及14个分子功能Term绘制柱状图进行展示。
如图4-5所示,每一类注释种类和数量各不相同。在生物过程类别大类中,共被注释到1726个Unigene,其中乙烯激活信号通路(ethylene-activated signaling pathway)、创伤应激反应(response to wounding)显著富集,另外激素介导的信号通路(hormone-mediated signaling pathway)、过氧化氢反应(response to hydrogen peroxide)、细胞激素刺激反应(cellular response to hormone stimulu)也被注释到,分别为49、11、49个Unigene。在细胞组分类大类中,共被注释到细胞组分260个Unigene,大部分的Unigene参与了光合作用过程,其中光系统I(photosystem I)、光系统(photosystemII)、光合膜(photosynthetic membrane)、类光体膜(thylakoid membrane)、类囊体(thylakoid),分别为10个Unigene、17个Unigene、25个Unigene、23个Unigene、25个Unigene。在分子功能大类中,共注释到941个Unigene,其中集中在序列特异性DNA结合(sequence-specific DNA binding)、糖基转移酶活性(glycosyltransferase activity)、四吡咯结合(tetrapyrrole binding)、氧化还原酶活性(oxidoreductase activity)过程,分别为72、61、49、39个Unigene。以上结果说明:在‘阳光玫瑰’葡萄休眠解除萌发过程中,基因的表达受到很多内、外界因素的影响,遗传信息的传递过程有大量的调节因子参与其中。
2.5.2 差异基因KEGG分析
为进一步预测基因的功能以及对比差异表达基因,通过KEGG(Kyoto Encyclopedia of Genes and Genomes)已经报道的相关基因的数据库进行注释。5个生物过程:细胞过程(cellular process)、环境信息过程(environmental information processing)、遗传信息过程(genetic information processing)、代谢(metabolism)和有机体系统(organismal systems)五大类,共有577个Unigene分配到49条生物学通路上。
由表4-4可以得出,Unigene被注释最多的是代谢途径,共41条生物学通路、400个Unigene,占比对总数的69.32%,其次是环境信息处理,共3条通路,74个Unigene,占12.82%,而细胞过程、遗传信息处理和有机系统分别有3、1、1条生物学通路,分别占比0.62%、0.17%、0.17%。在所有的代谢途径中,有氨基酸代谢相关通路7条,其他氨基酸代谢通路4条,如谷胱甘肽代谢(26个Unigene)、半胱氨酸和蛋氨酸的代谢(14个Unigene)、酪氨酸代谢(7个Unigene)、苯丙氨酸和酪氨酸及色氨酸的生物合成(8个Unigene)、精氨酸和脯氨酸代谢(7个Unigene)、苯丙氨酸代谢(7个Unigene)等。还有许多与能量代谢,如光合作用(14个)、光合作用-天线的蛋白质(7个Unigene)、硫代谢(5个Unigene)等通路,碳水化合物相关代谢通路6条,半乳糖代谢、果糖和甘露糖代谢、糖酵解/糖异生、磷酸戊糖途径、抗坏血酸和醛酸代谢、柠檬酸循环(TCA循环)。另外还有与生物合成密切相关的脂质代谢、辅助因子和维生素的代谢、萜类化合物和多酮类化合物的代谢、辅因子和维生素的新陈代谢等多种通路。在信号转导中,植物激素信号转导37个Unigene被注释。因此,单氰胺处理后,在‘阳光玫瑰’葡萄芽萌发过程中,多种通路协同作用,其中代谢通路注释Unigene最多。


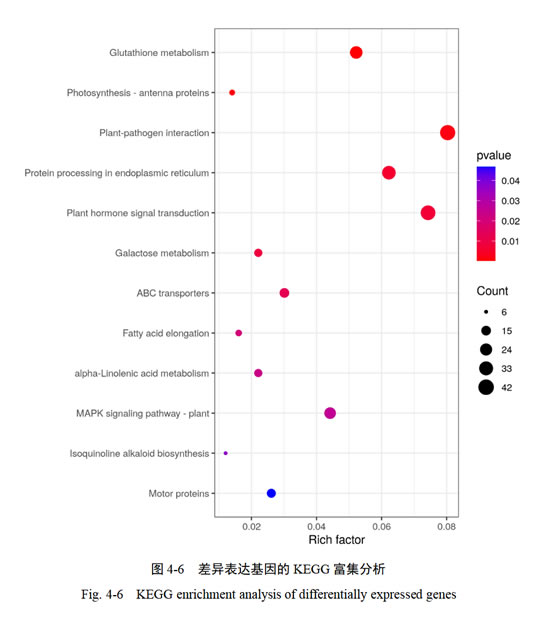
为进一步明确单氰胺处理后‘阳光玫瑰’葡萄芽萌发过程中差异表达基因的功能,使用R软件中的phyper函数进行富集分析,计算Pvalue,然后对Pvalue进行FDR校正得到Qvalue,Qvalue≤0.05的功能视为显著富集。通过KEGG分析结果显示,显著性富集到12个生物学通路,谷胱甘肽代谢、光合作用-天线的蛋白质、植物病原体相互作用、内质网中的蛋白质加工、植物激素信号转导、半乳糖代谢通路最显著。其中代谢途径中的能量代谢(光合作用-天线蛋白质)和碳水化合物代谢(半乳糖代谢)以及环境信息处理(植物激素信号转导)与芽萌发过程具有紧密联系。
2.6 与芽萌发相关基因筛选
2.6.1 碳水化合物代谢相关基因
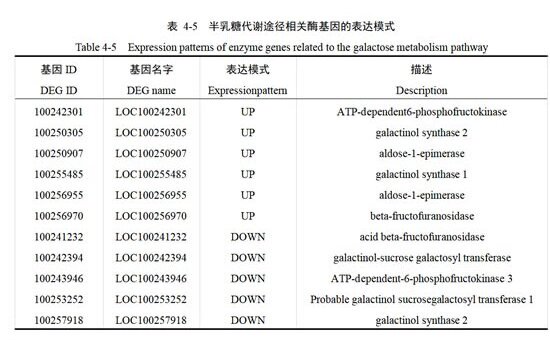
碳水化合物的代谢对植物的生长发育过程发挥重要作用。在芽休眠解除萌发过程中,通常将淀粉进行水解提供能量。本研究根据KEGG富集分析结果,对显著性富集的半乳糖代谢(Galactose metabolism)通路差异基因的表达情况进行着重分析。共筛选到相关差异基因11个Unigene,其中6个Unigene显著性上调,5个Unigene显著性下调。如表4-5所示,1个磷酸果糖激酶(ATP-dependent6-phosphofructokinase)、2个糖基转移酶(galactinol synthase 2、galactinol synthase 1)、1个糖基水解酶(beta-fructofuranosidase)、2个醛糖缩合酶(aldose-1-epimerase)在半乳糖代谢途径中表达量显著上调,推测半乳糖代谢可能在单氰胺处理葡萄芽萌发过程中起重要作用,有待进一步研究。
2.6.2 植物激素信号转导途径相关差异基因
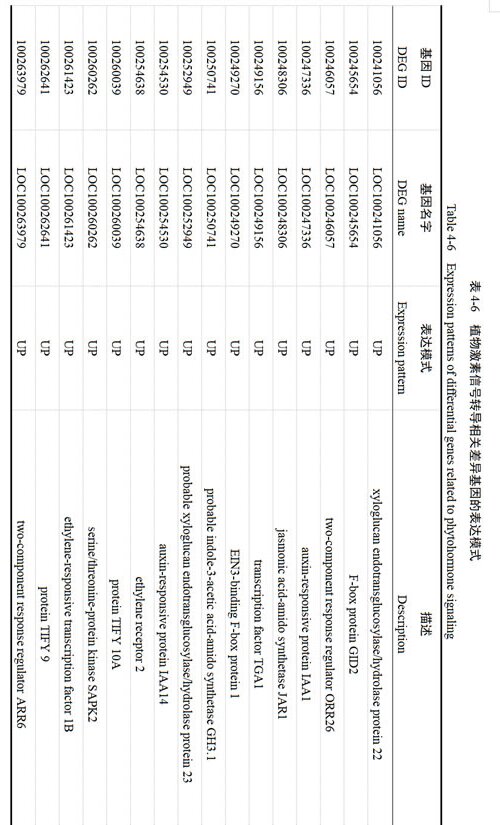
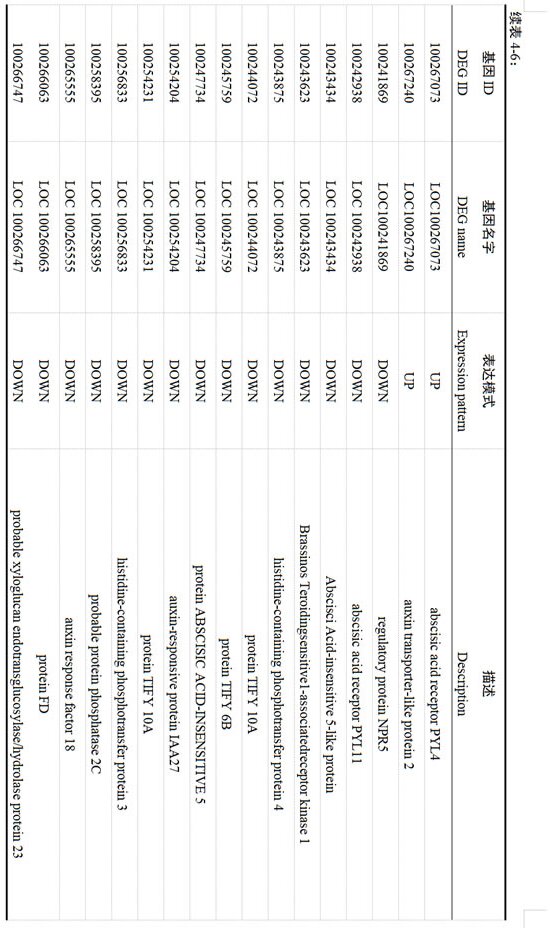
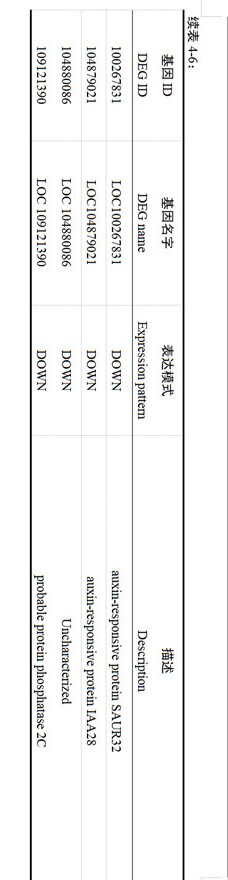
植物内源激素和信号转导途径,在休眠解除和萌发过程中具有重要作用。本研究根据GO、KEGG富集分析结果,信号转导途径中的植物激素信号转导通路被显著性注释。如表4-6所示,参与植物激素信号转导通路的差异表达基因共有37个,其中18个Unigene表达持续上调,19个Unigene持续下调。在ABA信号通路中,两个ABA受体蛋白PYR/PYL被注释,处理后PYL4和PYL11基因表达分别上调和下调。与蛋白磷酸激酶2C(PP2C)家族相关的2个Unigene表达量下调。参与GA介导信号通路的调节的F-box蛋白GID2表达上调。在IAA信号通路中,AUX/IAA家族的生长素响应蛋白IAA1、IAA14、和IAA27、IAA28分别上调和下调。在JA信号通路中,茉莉酸-氨基合成酶JAR1基因表达水平上调,Tify家族中有2个Unigene表达水平上升,3个Unigene的表达水平下降。另外,还有生长素反应蛋白、脱落酸受体、乙烯受体和转录因子、蛋白磷酸酶、丝氨酸/苏氨酸蛋白激酶等可能参与了植物激素信号转导。
3 讨论
我国南方暖温带、亚热带地区主要通过人工喷施破眠剂的方式,代替芽萌发所需需冷量要求,破眠剂使用方法已相对成熟,其中破眠剂单氰胺应用最为广泛。单氰胺是一种植物生长调节剂,在葡萄种植中广泛应用,可以代替需冷量需求满足破眠萌发条件,实现二次结果或者促早栽培生产,提高经济效益。目前,热带地区使用单氰胺处理对葡萄萌芽影响的研究较少,促进葡萄芽萌发的调控机制目前还尚未明确。在本论文第二章中证明单氰胺处理可以代替低温积累,达到促进葡萄芽萌发的效果。本研究通过对单氰胺处理后,葡萄芽萌发过程中的基因表达进行转录组测序(RNA-Seq测序),初步了解热带地区芽萌发分子层面的调控机制,为后续研究者们奠定一定的理论基础。
本研究中,利用Illumina HiSeq 高通量测序技术对12个样品进行转录组测序,对原始数据进行过滤、原始Reads质量评估和序列比对,保证数据分析的质量及可靠性。测序数据显示,每个样品的过滤碱基均大于6.84 Gb,Q20碱基百分比均在98%以上,Q30碱基百分比均在96%以上,各样品有效Reads中总注释到参考基因组的占比在88.48%-92.07%不等。对12个样品进行差异表达分析的相关性评估,12个样品的组间重复都能聚为一类,表明数据满足后续分析要求。
GO和KEGG富集分析通常被用于差异表达基因的功能分析。多项研究表明,在落叶果树芽休眠解除过程中,相关的差异基因主要富集在细胞过程、结合、催化活性、细胞部分和细胞器(Zhang et al., 2018)。本研究得到不同结果,乙烯激活信号通路、创伤应激反应、光合系统、序列特异性DNA结合、糖基转移酶活性通路的差异基因注释较显著,另外激素介导的信号通路、过氧化氢反应、氧化还原酶活性等类别也有富集。根据KEGG数据库对代谢水平进行分析,参与代谢通路的基因数量最多,其中代谢途径、次生代谢物生物合成、植物病原体相互作用、植物信号转导等,与杨丽(2020)等对花芽休眠解除的KEGG分析结果较为一致,同时本研究中谷胱甘肽代谢、光合作用-天线蛋白质、内质网中的蛋白质加工、植物激素信号转导、半乳糖代谢通路富集最显著。结果表明,热带地区在单氰胺处理后的葡萄芽萌发过程中,相关差异表达基因与已有落叶果树休眠研究有相似之处,也存在部分差异。
单氰胺处理后葡萄芽内产生一系列生理生化变化,并诱导各种通路相关基因的差异表达。根据GO和KEGG富集分析显著水平,以下研究主要从以下通路研究单氰胺打破芽休眠促进萌发的机理:碳水化合物代谢通路的半乳糖代谢和信号转导通路的植物激素信号转导。
在碳水化合物代谢通路中,已有研究主要关注淀粉与蔗糖代谢途径,在植物芽萌发过程中主要通过淀粉水解为可溶性糖的形式为生命活动提供能量,研究表明,在淀粉与蔗糖代谢通路中,α-淀粉酶、β-淀粉酶等水解酶基因表达水平上调,蔗糖合酶相关基因下调。休眠解除阶段,芽内淀粉水解为可溶性糖,主要以蔗糖形式存在(Elle and Sauter, 2000)。在本研究中,单氰胺处理后,参与碳水化合物代谢的基因表达量发生变化,其中半乳糖代谢通路显著性富集。这些差异表达基因(磷酸果糖激酶、糖基转移酶、糖基水解酶和醛糖缩合酶相关基因)从不同功能调控半乳糖代谢途径,对维持植物芽内能量平衡具有重要意义,其作用机制还需进一步探讨。
多项研究表明,植物内源激素和信号转导是调控休眠解除促进休眠的重要因子(杨丽丽等,2020;李建召,2019;李渊等,2023)。ABA和GA在植物休眠和萌发中发挥关键作用(胡彩珠等,2024)。在调控葡萄花芽休眠进程中,ABRE和PP2C家族相关的ABA受体基因表达水平上调(Zheng et al., 2015)。本研究中,ABA受体蛋白PYR/PYL被注释,处理后PYL4和PYL11基因表达分别上调和下调,蛋白磷酸激酶2C(PP2C)家族相关的2个基因表达量下调,与董阳(2020)的研究结果一致。参与GA介导信号通路调节的F-box蛋白GID2基因表达上调。在芒果二次花芽形成过程中,茉莉酸信号基因MYC2与JAZ表达上调(彭锦钰,2023),证明JA信号通路也参与调控芽萌发的过程。在IAA信号通路中,AUX/IAA家族的生长素响应蛋白IAA1、IAA14、和IAA27、IAA28分别上调和下调。本研究中,JA信号通路的茉莉酸-氨基合成酶JAR1基因表达水平上调,Tify家族中有2个基因表达量上调、3个基因表达量下调。因此,推测JA信号转导通路对促进芽萌发具有重要作用。另外,注释到生长素反应蛋白、细胞分裂素转录因子、乙烯受体和转录因子、蛋白磷酸酶、丝氨酸/苏氨酸蛋白激酶等可能参与了植物激素信号转导,与先前芽休眠萌发研究结果相似(李建召,2019)。