鲜食葡萄品种改良岗位
1 材料与方法
1.1 植物材料
试验材料为‘瑞都香玉’葡萄品种,采自北京市农林科学林业果树研究所。行距2.5米,株距0.75米露地栽培,倾斜式水平龙蔓,单臂篱架整形。使用常规的栽培管理措施。2024年5月25日,‘瑞都香玉’葡萄开花,花后30d(6月25日)采集果实样品。后每隔15d采样,至2024年8月10日(成 熟 期)止,共4次,分别标记为 S1(幼果期)、S2(膨大期)、S3(转色期)、S4(成熟期)。采样时需要兼顾阴面与阳面,并且每穗葡萄应兼顾肩、中、顶部的位置。将样品用液氮迅速冷冻后置于-80 ℃超低温冰箱保存备用。
1.2 葡萄bHLH基因的鉴定与筛选
首先,我们在Emsembl plants (ftp://ftp.ensemblgenomes.org/)下载葡萄的蛋白数据,并在 PlantTFDB5.0中下载得到拟南芥bHLH转录因子蛋白序列。利用HMMER 3.0软件和本地Blastp方法联合进行检索,HMMER 3.0的限定E值为 1×e-10,Blastp的E值设定为 1×e-5。随后使用NCBI在线网站(https://www.ncbi.nlm.nih.gov/)中 BatchCD-search 来检索bHLH家族的保守结构域,收集所有E值小于0.01的查询结果,即为预测到的葡萄VvbHLH基因。利用序列分析软件DNAMAN 6.0对葡萄bHLH蛋白的保守结构域分析;利用Tbtools软件(v1.098774)进行保守结构域可视化 (Chen et al., 2020)。
1.3 葡萄bHLH基因的染色体定位和共线性分析
借助葡萄基因组的注释信息的(gff3)文件,在染色体中将bHLH基因家族成员进行定位,再利用 Tbtools(v1.098774)的 Gene location visualize from gff3 功能对bHLH基因结构结果进行可视化分析。通过 MCScanX 程序(http://chibba.pgml.uga.edu/mcscan2)和 KaKs_Calculator2.0(http://code.google.com/p/kaks-calculator/wiki/KaKs _Calculator)分析基因复制事件 (Wang et al., 2024),用Tbtools(v1.098774)将葡萄bHLH家族成员以及VvbHLHs和拟南芥AtbHLHs的共线性关系进行可视化。
1.4 葡萄bHLH蛋白的理化性质分析和二、三级结构预测
用在线软件ProtParam(https://web.expasy.org/protparam)分析葡萄bHLH基因家族成员的氨基酸数量、理论等电点、分子质量等理化特性 (Eslami Bojnourdi et al., 2023)。用WOLFSPORT(https://wolfpsort.hgc.jp/)在线工具对葡萄bHLH基因家族成员进行亚细胞定位预测 (Salih et al., 2021)。通过在线工具SOPMA (http://npsa-pbil.ibcp.fr/)对葡萄VvbHLH蛋白进行蛋白质二级结构预测;利用SWISS-MODEL (https://swissmodel.expasy.org/)网站预测分析葡萄VvbHLH蛋白的三级结构 (Liang et al., 2023)。
1.5 系统进化分析、基因结构与保守基序分析
采用MEGA11软件中的MUSCLE工具对葡萄、拟南芥、玉米、梨树、苹果、毛果杨和水稻物种的bHLH序列进行多序列比对,并通过邻接法(Neighbor-Joining)构建系统进化树(Zhang et al., 2021)。使用Evolview在线平台(http://www.evolgenius.info/evolview/#/)对构建的进化树进行修剪和美化。通过GSDS网站(http://gsds.gao-lab.org/)进行基因序列内含子和UTR分析。在MEME在线平台(http://meme-suite.org/tools/meme)进行蛋白质保守基序分析(Zhang et al., 2021)。最后利用Tbtools(v1.098774)按进化树顺序对VvbHLH的系统发育树、保守结构域和基因结构结果进行整合可视化。
1.6 葡萄bHLH启动子顺式作用元件分析
从葡萄基因组文件中提取bHLH家族基因起始密码子上游2000 bp序列作为启动子区域,使用PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行启动子顺式作用元件分析(Zhang et al., 2024c)。通过Tbtools(v1.098774)对分析结果进行启动子元件可视化。
1.7 单萜类物质含量测定
游离态单萜类物质的提取与测定参考Liu等(2022b)的方法。采用自动质谱解卷积鉴定系统(AMDIS)计算保留指数(RIs)并获取质谱信息,通过将质谱分析结果与NIST物质检索谱库进行匹配,并结合物质标准的保留指数进行物质鉴定。葡萄萜类化合物的浓度测定通过标准曲线法进行:参考Zhou等(2022)的方法制备并绘制标准曲线。对于缺乏标准曲线的单萜化合物,采用碳原子数和化学结构相似物质的标准曲线进行定量分析。
1.8 RNA提取与RT-qPCR分析
使用Premier 6软件设计葡萄bHLH家族基因的特异性引物,用天根RNAplant试剂盒(天根,中国)提取总RNA。使用NanoDrop分光光度计(ND-7000,NanoDrop技术公司,美国)测定RNA的产率和质量。用All-in-one 1st Strand cDNA Synthesis Super Mix (gDNA Purge)反转录试剂盒(Novoprotein, China)合成cDNA。将cDNA稀释5倍至200 ng/μL浓度用于RT-qPCR反应。RT-qPCR反应采用SYBR qPCR混合物(GenStar,中国)和CFX连接实时PCR检测系统(Bio-Rad,美国)进行。PCR循环为:95°C 2 min,40个循环数,95°C 15 s,60°C 34 s。每个反应设置3个生物学重复。以VvUbiquitin作为内参基因,使用2−ΔΔCT方法计算基因相对表达量(Harshitha and Arunraj, 2021)。
1.9 葡萄bHLH基因表达量与单萜含量的相关性分析
基于葡萄果实中单萜含量变化及bHLH基因在不同时期的相对表达量,采用SPSS 27.0软件(SPSS,美国)进行Pearson相关性分析。相关性显著性在P < 0.05和P < 0.01水平进行评估,并使用Benjamini-Hochberg错误发现率(FDR)法进行多重检验校正。通过ChiPlot在线平台(https://www.chiplot.online/)绘制热图,可视化单萜含量变化与基因表达结果之间的相关性。
1.10 VvbHLH9基因克隆、质粒构建与亚细胞定位
通过逆转录葡萄果实总RNA获得cDNA,并克隆VvbHLH9基因。为确定该基因的真实定位信息,进行了VvbHLH9基因的亚细胞定位分析:构建带有GFP标签的VvbHLH9蛋白重组质粒,通过农杆菌介导法将重组载体注射入本氏烟草叶片,同时以携带GFP标签的空载pCAMBIA2300-GFP载体作为对照。暗培养过夜后,再光照培养12小时。叶片注射约3天后,将叶片制片,使用FV10-ASW激光共聚焦显微镜观察转基因烟草叶细胞中的GFP荧光。其中GFP代表绿色荧光通道,CHI代表叶绿体自发荧光通道,DAPI代表细胞核染色通道(DAPI染色),DIC代表明场通道,Merge代表多通道叠加图像。
1.11 叶片瞬时过表达分析
将VvbHLH9基因片段克隆至pCAMBIA2300-GFP载体中,并使用重组载体进行瞬时过表达分析。选取大小相近、无机械损伤的'Alden'葡萄新鲜叶片进行侵染实验,每个样品侵染6片叶作为6个技术重复,以等量叶片侵染转入空载pCAMBIA2300-GFP载体的农杆菌作为对照组。菌液培养12小时直至OD600为0.6-1.0,使用侵染缓冲液[MES 2.132 g/L,MgCl2 6H2O 2.033 g/L,蔗糖5 g/L,乙酰丁香酮终浓度200 mg/L,pH5.9]调节菌体OD600至0.4,静置4小时。侵染后的叶片在低温避光条件下培养3天,通过RT-qPCR检测VvbHLH9及单萜合成相关基因的表达水平,并通过GC-MS检测单萜类物质含量。
2 结果
2.1 葡萄bHLH基因的鉴定
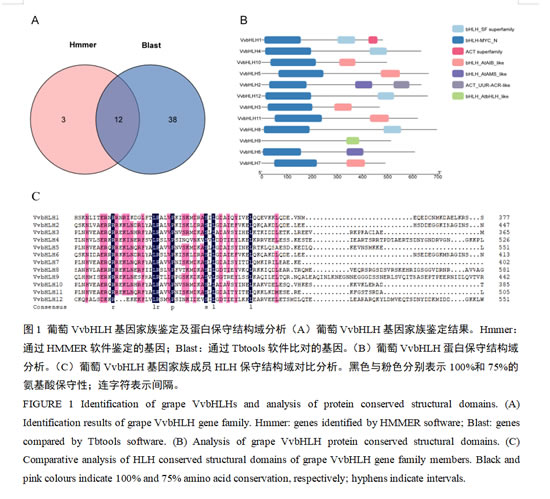
通过HMMER软件和TBtools本地BLAST分析,我们鉴定出12个符合筛选标准的葡萄bHLH蛋白序列(图1A)。根据染色体定位,将这些bHLH序列命名为VvbHLH1~VvbHLH12。基于保守结构域分析,将葡萄bHLH家族分为bHLH_SF超家族、bHLH-MYC_N、ACT超家族、bHLH_AtAIB_like、bHLH_AtAMS_like、ACT_UUR-ACR-like和bHLH_AtbHLH_like共7种类型。除VvbHLH9外,其余11个VvbHLH蛋白的N端均含有bHLH-MYC_N结构域(图1B)。通过DNAMAN软件对12个葡萄bHLH的HLH保守结构域分析表明,C端HLH结构域富含疏水性氨基酸亮氨酸(L)和脯氨酸(P),其中L高度保守,对维持bHLH蛋白二级结构的稳定性具有重要作用(图1C)。
2.2 葡萄bHLH基因的染色体定位与共线性分析
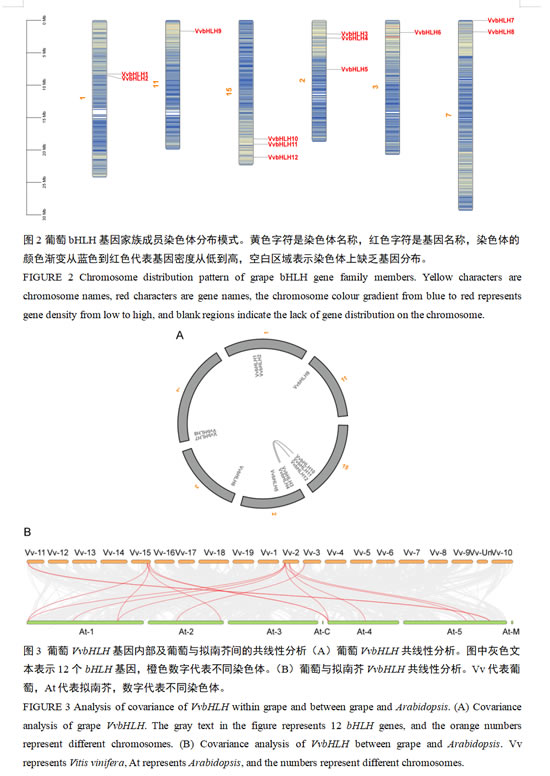
为探究VvbHLH的进化复制事件,我们分析了其染色体分布与共线性关系。根据葡萄基因组注释gff3文件,鉴定出的12个葡萄VvbHLH基因定位于6条染色体上(图2)。这些基因呈不规则分布,在不同染色体骨架上的分布密度各异:其中2号和15号染色体包含的bHLH基因数量最多(各3个),1号和7号染色体各含2个bHLH基因,3号和11号染色体所含bHLH基因数量最少(各1个)。
共线性分析显示,葡萄bHLH基因中存在两对共线性关系(图3A):VvbHLH3与VvbHLH10、VvbHLH4与VvbHLH12,推测其通过大片段基因复制形成。为进一步解析bHLH基因间的进化联系,我们进行了葡萄与拟南芥bHLH基因的共线性分析(图3B)。结果显示葡萄中共有8个VvbHLH基因与拟南芥bHLH基因存在共线性关系。其中,VvbHLH6、VvbHLH9和VvbHLH10这3个基因分别与1个拟南芥bHLH基因同源;VvbHLH3、VvbHLH5、VvbHLH11和VvbHLH12这4个基因分别与2个拟南芥bHLH基因同源;VvbHLH4基因与3个拟南芥bHLH基因同源。
2.3 葡萄bHLH家族蛋白的理化性质分析
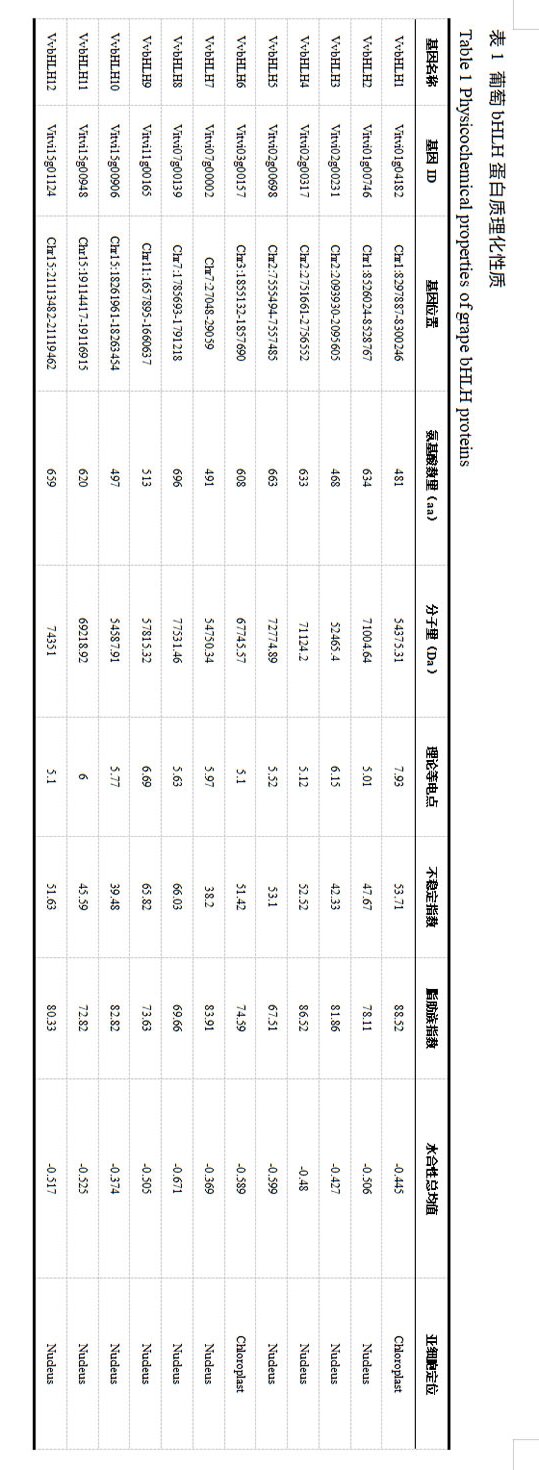
葡萄bHLH蛋白理化性质分析表明(表1):其氨基酸长度在468 aa(VvbHLH3)至696 aa(VvbHLH8)之间。12个bHLH蛋白的分子量范围是52,465.4 Da至77,531.46 Da,其中VvbHLH8分子量最大,VvbHLH3最小。等电点(pI)介于5.01(VvbHLH2)到7.93(VvbHLH1)之间,其中11个bHLH蛋白的pI值处于5-7之间,表明大多数葡萄bHLH家族蛋白理论上是酸性蛋白。不稳定系数范围在38.2(VvbHLH7)至66.03(VvbHLH8)之间,表明大多数成员为不稳定蛋白(不稳定指数II > 40);仅有两个属于稳定蛋白(II < 40),分别为不稳定系数38.2的VvbHLH7和39.48的VvbHLH10。脂肪系数介于67.51(VvbHLH5)到88.52(VvbHLH1)之间。此外,所有bHLH蛋白的GRAVY亲水性指数均小于0,表明这些蛋白主要呈现亲水性特征,但不同蛋白间的亲水性存在差异。亚细胞定位预测显示,大多数bHLH蛋白定位于细胞核,少数定位于叶绿体。
2.4 葡萄bHLH蛋白空间结构分析
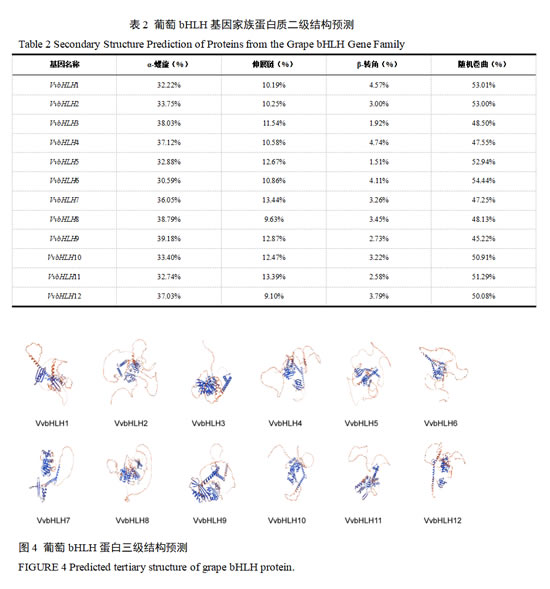
通过SOPMA对bHLH氨基酸序列进行二级结构预测分析发现,葡萄bHLH二级结构主要由α-螺旋(Hh)、无规卷曲(Cc)、β-转角(Tt)和延伸链(Ee)组成(表2)。其中无规卷曲和α-螺旋占比最大,β-转角占比最小。α-螺旋数量占比为30.59%(VvbHLH6)至39.18%(VvbHLH9),延伸链结构数量占比为9.10%(VvbHLH12)至13.44%(VvbHLH7),β-转角结构数量占比为1.51%(VvbHLH5)至4.74%(VvbHLH4),无规卷曲结构数量占比为45.22%(VvbHLH9)至54.44%(VvbHLH6)。通过SWISS-MODEL在线平台对葡萄bHLH序列进行三级结构预测分析显示,所有成员的模型匹配相似度均超过30%,且同一亚家族的蛋白结构具有高度相似性,但个体间也存在差异(图4)。
2.5 系统发育分析、基因结构和保守基序分析
为了阐明葡萄与其他植物bHLH家族的系统发育关系,我们将葡萄bHLH基因家族蛋白序列与拟南芥、玉米、梨树、苹果、毛果杨和水稻的bHLH蛋白序列构建进化树(图5)。根据进化关系,不同物种的132个bHLH蛋白一共被分为12个亚族(Group 1-Group 12),其中最少的Group 11亚族只含有1个成员,最大的亚家族Group 3和Group7有22个成员。葡萄bHLHs的系统发育分析显示,12个VvbHLH蛋白序列可分为3组:Group 3组包含8个VvbHLH蛋白,Group 4组包含3个VvbHLH蛋白,Group 6组包含1个VvbHLH蛋白。从图中可以看出,所有的葡萄VvbHLH基因与梨树、苹果和拟南芥的总是聚在一起,亲缘关系较近,而与单子叶植物玉米和水稻亲缘关系相对较远。
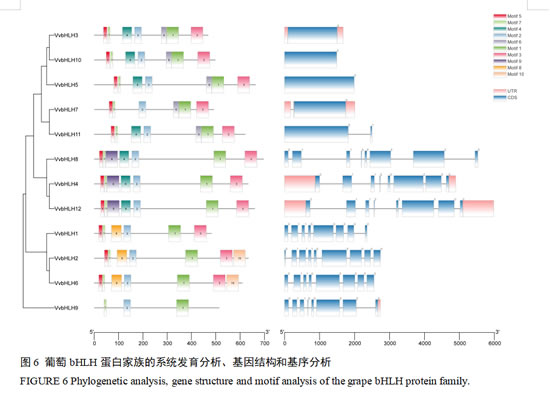
为了更好地分析葡萄的bHLHs,研究进行了单独的发育进化树、基因结构和基序分析(图6)。可以看到, VvbHLHs分为3类,与蛋白系统发育进化树分类一致。可以发现葡萄bHLH家族成员全部具有编码区域(coding sequences, CDS),除VvbHLH1、VvbHLH2、VvbHLH5、VvbHLH6、VvbHLH8、VvbHLH10和VvbHLH11外都具有非翻译区(untranslated regions, UTR),不具有的可能是没有注释出来。同时,葡萄bHLH家族成员均含有Motif 1,表明了bHLH家族的相对保守性。此外,包含相同种类保守基序的bHLH成员进化关系较近。根据Motif差异发现,Group 3亚族成员均含有Motif1、Motif2、Motif3、Motif5和Motif7;Group 4亚族成员均含有Motif1、Motif2、Motif3、Motif 5、Motif 7和Motif 8;Group 6亚族成员则含有Motif1、Motif2和Motif 7。推测不同的分支所包含基序的不同可能是 VvbHLHs进化过程中发生功能分化的原因之一。
2.6 葡萄bHLH基因家族成员的顺式启动子作用元件
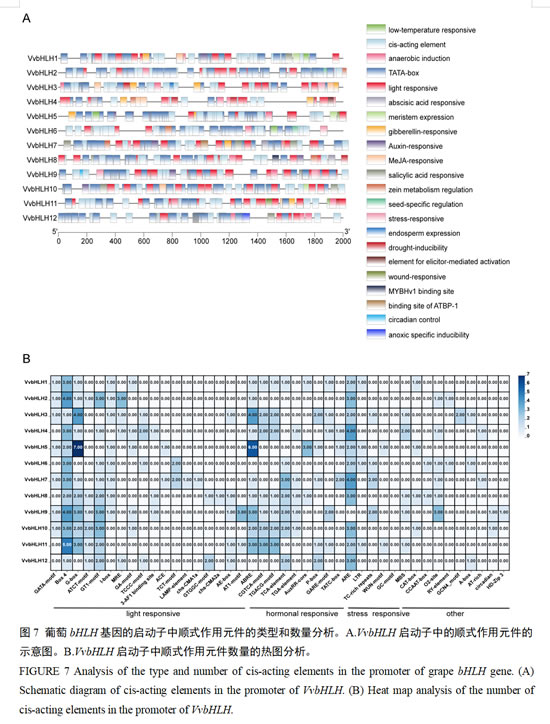
为了解葡萄bHLH基因的转录调控,本研究利用TBtools软件提取起始密码子上游2000 bp的葡萄家族基因序列,结合PlantCARE数据库分析统计顺式作用元件,手动去除冗余及无关序列后,再使用TBtools软件将结果可视化分析。结果表明,VvbHLHs的启动子中含有的元件类型和数量有所差异(图7)。基因的启动子区VvbHLH基因家族包含很多与非生物胁迫有关的作用元件,比如:昼夜节律响应元件、参与光响应的顺式调控元件、参与低温反应的顺式元件、干旱胁迫顺式响应元件和缺氧特异性诱导元件等(图7)。研究发现,所有的bHLH家族成员均含有光响应元件,推测其功能与光响应通路密切相关。葡萄中激素相关响应元件占比较多,其中脱落酸、茉莉酸甲酯响应元件是最多的,分别有23和24个(图7A)。因此,可以推测 bHLH 基因家族对生长素(IAA)、脱落酸、茉莉酸甲酯、赤霉素等激素信号的传播有着及其重要的作用。此外,我们发现6个VvbHLH基因(bHLH2、bHLH4、bHLH6、bHLH7、bHLH8和bHLH9)参与植物中玉米醇溶蛋白代谢调节,这表明VvbHLHs参与植物的代谢调节过程(图7A)。
研究进一步分析了VvbHLH启动子中顺式作用元件的数量(图7B)。结果表明,在全部响应元件中,主要响应元件包括Box 4和抗氧化响应元件(ARE),二者在VvbHLH启动子中分别有1-5个和2-4个。光响应元件主要包括Box 4和G-box元件,其中VvbHLH2、VvbHLH9和VvbHLH11中包含的Box 4元件超过3个;VvbHLH5中包含的G-box元件高达7个。激素应答元件主要由脱落酸响应元件(ABRE)组成,其在VvbHLH3、VvbHLH5、VvbHLH9和VvbHLH11中的含量较高,分别为4、6、3和3个。应激反应元件主要为抗氧化响应元件(ARE),其次是防御与胁迫响应元件(TC-rich repeats)元件。其它作用元件主要包括玉米醇溶蛋白代谢调节元件(O2-site)和干旱响应元件(MBS)等。
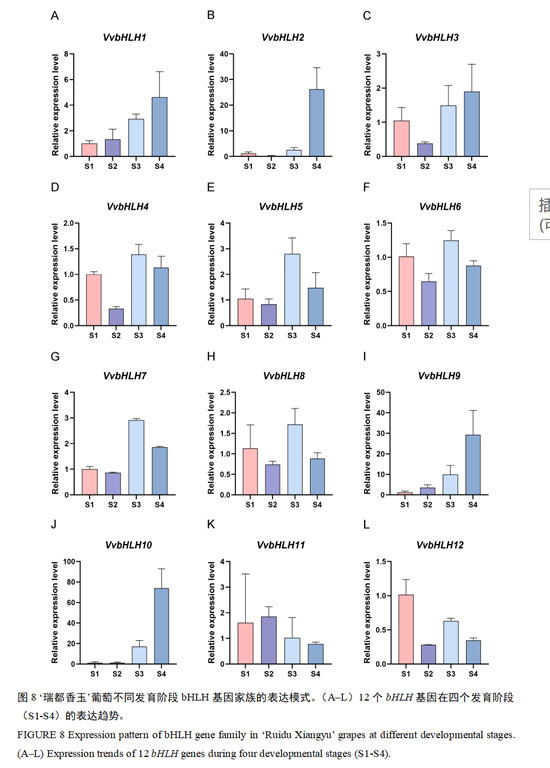
2.7 葡萄bHLH基因家族表达模式分析
研究通过RT-qPCR技术分析了葡萄果实发育过程中VvbHLH基因的时空表达模式。研究表明,与其他VvbHLH基因相比,VvbHLH2的表达在不同发育时期具有显著的时空动态性,该基因在果实S4时期(成熟期)呈现较高的表达水平(图8)。在12个VvbHLH基因中,有5个基因(VvbHLH4、VvbHLH5、VvbHLH6、VvbHLH7和VvbHLH8)在果实S3时期(转色期)表达量显著升高,该时期正值葡萄转色阶段,推测可能与葡萄单萜类物质的积累相关(图8)。此外,VvbHLH1、VvbHLH2、VvbHLH3、VvbHLH9和VvbHLH10这5个基因在S4时期表达上调,VvbHLH11基因在S2时期(膨大期)表达上调,VvbHLH12基因在S1时期(幼果期)表达上调。这些发现表明VvbHLH基因在葡萄果实发育阶段具有不同的功能。
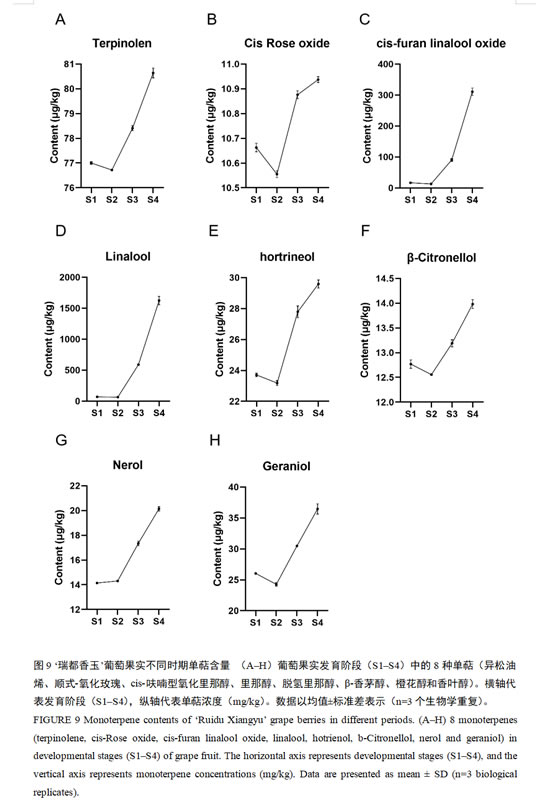
2.8 单萜含量分析
由于单萜代谢物主要在葡萄果实中积累,因此我们研究了单萜在葡萄果实发育的4个阶段的积累情况。研究鉴定出‘瑞都香玉’葡萄果实的4个发育时期均含有的8个关键单萜代谢物,包括异松油烯、顺式-氧化玫瑰、cis-呋喃型氧化里那醇、里那醇、脱氢里那醇、β-香茅醇、橙花醇和香叶醇。图9的结果表明,8种单萜在S1-S4时期的含量总体呈现上升趋势,尤其在S3-S4时期的增长速度较为急剧。具体来看,除橙花醇外,其它7种单萜的含量在S1-S2时期均呈下降趋势。
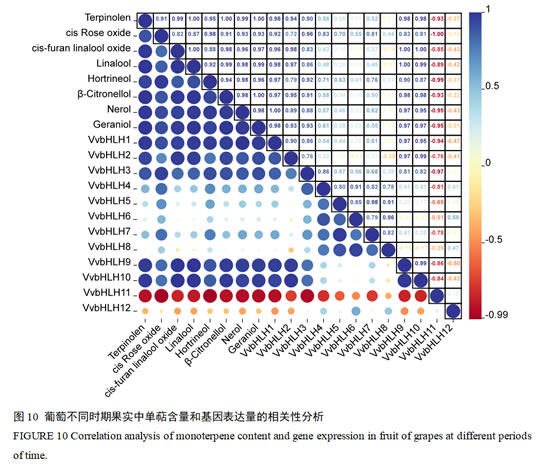
2.9 相关性分析
由于‘瑞都香玉’葡萄果实中单萜含量在S3时期(转色期)急剧上升,故采用Pearson相关性分析评估了S1-S4发育阶段单萜含量与12个VvbHLH基因表达水平之间的关系。可以看出,葡萄中bHLH家族成员的基因表达水平之间也存在一定的相关性(图10)。研究发现,VvbHLH1、VvbHLH2、VvbHLH3、VvbHLH9和VvbHLH10均与葡萄果实中单萜含量呈现显著正相关;VvbHLH11则与葡萄果实中单萜含量呈现显著负相关(图10)。具体来看,VvbHLH1对葡萄果实中异松油烯、cis-呋喃型氧化里那醇、里那醇、脱氢里那醇、β-香茅醇和香叶醇含量增长显著正相关(P<0.05),而对橙花醇含量增长显著正相关(P<0.01)。VvbHLH2对葡萄果实中cis-呋喃型氧化里那醇和里那醇含量增长显著正相关(P<0.05)。VvbHLH3对顺式-氧化玫瑰含量增长显著正相关(P<0.05)。VvbHLH9和VvbHLH10均对异松油烯、β-香茅醇、橙花醇和香叶醇含量显著正相关(P<0.05),对cis-呋喃型氧化里那醇和里那醇含量显著正相关(P<0.01)。VvbHLH11对脱氢里那醇含量显著负相关(P<0.05),对顺式-氧化玫瑰含量显著负相关(P<0.01)。
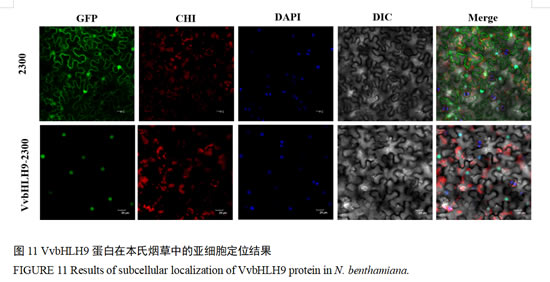
2.10 VvbHLH9的亚细胞定位
为验证VvbHLH9蛋白的预测定位结果,我们成功克隆了VvbHLH9基因的全长CDS序列,将其连接至pCAMBIA2300-GFP载体并转化至GV3101感受态细胞。使用验证成功的农杆菌菌液浸润本氏烟草叶片后观察结果。通过亚细胞定位发现,未插入VvbHLH9基因的绿色荧光蛋白在本氏烟草各细胞器中均有表达,而与VvbHLH9蛋白融合的绿色荧光蛋白仅在细胞核中表达,证明VvbHLH9基因在细胞核中表达并发挥功能(图11)。
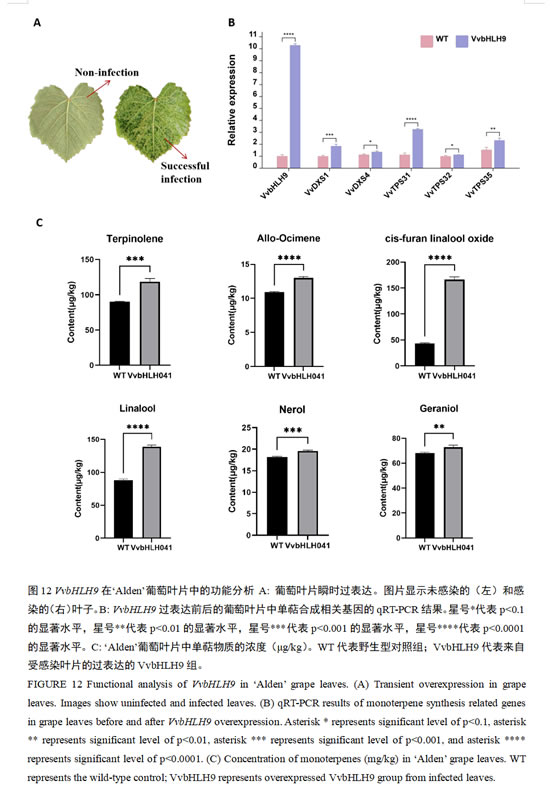
2.11 VvbHLH9过表达促进葡萄单萜代谢物合成
为进一步探究VvbHLH9在葡萄单萜合成中的作用,本研究在‘Alden’葡萄叶片中进行VvbHLH9基因过表达实验。可以看出,与未侵染的叶片颜色相比,侵染后叶片的颜色明显变深(图12A)。RT-qPCR数据显示,该基因显著上调了单萜合成关键酶编码基因VvDXS1、VvDXS4、VvTPS31、VvTPS32和VvTPS35的表达(图12B)。葡萄叶片单萜代谢物定量表明,VvbHLH9过表达促进了包括异松油烯、别罗勒烯、cis-呋喃型氧化里那醇、里那醇、橙花醇和香叶醇在内的多种单萜含量的增加,其中cis-呋喃型氧化里那醇和里那醇的增加尤为显著(图12C)。这一结果与前文中VvbHLH9与异松油烯、β-香茅醇、橙花醇、香叶醇、cis-呋喃型氧化里那醇和里那醇含量显著正相关的研究结果一致,表明VvbHLH9正向调控葡萄单萜合成。