鲜食葡萄栽培岗
马瑞阳 陶建敏 郑焕
在植物芽萌发过程中,单氰胺处理后芽组织内部涉及一系列的生理代谢过程,调控其生长发育状态(黄晓婧,2019)。其中,高等植物的生长发育依赖于有氧代谢,将氧气还原为水为植物的成长与发展供应能量。然而,当转化过程未能彻底进行时,便会形成活性氧(ROS)例如超氧阴离子(O2▪ -)、氢氧离子(OH-)、过氧化氢(H2O2)等含氧化合物。ROS的生成被认为是解除植物休眠机制的必要因素,对于调控植物的休眠状态起到决定性作用(Kärkönen and Kuchitsu, 2015)。
细胞自身具有主动清除ROS的调节功能,启动酶促和非酶促系统共同调节ROS 含量,保持动态平衡。其中,在植物的抗氧化调节系统中,超氧化物歧化酶(SOD)是清除超氧阴离子的特异性酶,主要是通过将O2▪ -分解为O2和H2O2(Zhu, 2016));过氧化物酶(POD)和过氧化氢酶(CAT)是清除过氧化氢的重要酶,主要是将H2O2分解为O2▪ -和H2O(Mittler, 2002)。因此,抗氧化系统的活化也可以作为解除休眠进行萌发的标志之一。
碳水化合物不仅作为植物进行生命活动的能量来源,也可以作为信号分子调控细胞生理生化变化过程。在植物芽休眠解除过程中,碳水化合物的转化是休眠解除的影响因子之一。研究表明,在休眠解除过程中,淀粉和可溶性糖含量发生变化,淀粉水解转化为可溶性糖,同时释放能量,为植物生长发育提供能量(Mohamed et al., 2010;Elle and Sauter, 2000)。随着休眠解除过程结束,淀粉含量不再变化,可溶性糖含量显著下降,原因是通过消耗可溶性糖为植物生长发育提供能量(Vimont et al., 2021)。可溶性蛋白既是一种重要的渗透调节物质,也是生长代谢过程中物质合成的原料,也可以水解为可溶性糖提供能量。研究发现,在不同植物的萌发和幼苗生长过程中,可溶性蛋白含量会发生变化,不同物种变化趋势不同。例如,刘朝以‘水晶’葡萄为材料,研究发现,单氰胺处理可促进葡萄冬芽蛋白质的合成,含量显著性上升(刘朝等,2023)。
在本章研究中,以不同浓度单氰胺处理的‘阳光玫瑰’葡萄芽为试材,通过对超氧阴离子(O2▪ -)、抗氧化酶(SOD、POD、CAT)活性、丙二醛(MDA)、淀粉、可溶性糖、可溶性蛋白等指标进行测定,进一步确定单氰胺处理对葡萄芽萌发生理指标的影响。为解决目前热带地区因休眠不足而出现的多种问题,以及为热带地区葡萄产业的发展提供理论依据。
1 材料与方法
1.1 试验材料与试剂
1.1.1 试验材料
试验所用材料来自本研究第二章1.2试验设计中所提到的备用采样枝条。每处理每棵树留有10根备用采样枝条,枝条粗度均为1 cm以上,留有7-8个芽眼。在本试验中分别采集第3-5节位的葡萄芽,置于液氮中速冻,带回实验室放入-80℃冰箱储存备用。
1.1.2 试验试剂
磷酸氢二钠、磷酸二氢钠、盐酸羟胺、对氨基苯磺酸、α-萘胺、冰醋酸、甲硫氨酸、EDTA-Na2、核黄素、氮蓝四唑(NBT)、2-甲氧基酚、30%H2O2、三氯乙酸、硫代巴比妥酸、葡萄糖、蒽酮、考马斯亮蓝G-250、乙醇、85%磷酸等试剂。
1.1.3 试验仪器
电子天平(BCE623i-1CCN)、分光光度计(UV-5200)、光照培养箱(MGC-450BP)、加热型磁力搅拌器(HS-350C)、台式冷冻离心机(Microfuge 20R)、台式离心机(Microfuge 20)、恒温干燥箱(DHG-9053A)、数显恒温水浴锅(HH-3A)、pH计(S400-K)、双列八孔水浴锅(HH-8)、多功能酶标仪(Eplex)、紫外分光光度计(UV-2600i)、制冰机(IMS-130)、全自动组织研磨仪(Tissuelsyer-96)等仪器。
1.2 试验设计
试验处理前采取花芽留样,3种浓度单氰胺(25000、17000、12500 mg/L)处理与清、水组(CK)对照处理后,分别在第2、4、6、8、10、12天采样备用。在实验室中完成超氧阴离子(O2▪ -)、抗氧化酶(SOD、POD、CAT)活性、丙二醛(MDA)、淀粉、可溶性糖、可溶性蛋白等生理指标的测定。
1.3 测定指标及方法
1.3.1 超氧阴离子(O2▪ -)和丙二醛(MDA)含量测定
(1)O2▪ -含量测定方法
酶液提取:精确称取0.5 g的葡萄芽组织样品,剥除外部鳞片,放入离心管中,使用全自动组织研磨仪进行研磨。随后,加入6 ml 65 mmol/L预冷的磷酸钾缓冲溶液
(pH=7.8)混匀,以4℃、16000 r/min的条件离心20 min。取3 ml上清液作为粗酶提取物。
O2▪ -产生速率测定:
在试管中依次加入0.5 ml 65 mmol/L磷酸钾缓冲溶液(PBS)和1 ml 10 mmol/L盐酸羟胺(同时以PBS代替样品提取液做一对照管)。
将试管置于25℃的水浴中加温10 min;
向每个试管中加入0.5 ml粗酶提取液(空白对照组则加入0.5 ml磷酸钾缓冲溶液进行校零);
再次将试管置于25℃的水浴中加温1 h;
随后向每个试管中加入1 ml 50 mmol/L的对氨基苯磺酸和1 ml 7 mmol/L的α-萘胺,涡旋混匀;
在25℃的水浴中加温20 min;
加入等体积(3 ml)的三氯甲烷,以3000 r/min速度离心3 min;
在530 nm波长下测定粉红色水相液吸光度,重复3次。
样品中超氧阴离子(O2▪ -)的含量按以下公式计算:
O2▪ -含量(μmol/g FW)=n×Vt/(VL×W)
n—由标准曲线查得的O2▪ -量(μmol)
Vt—粗酶液总体积(mL)
VL—测定用酶液体积(mL)
W—样品鲜重(g)
(2) MDA含量测定方法
酶液提取:精确称取0.5 g的葡萄芽组织样品,剥除外部鳞片,放入离心管中,使用全自动组织研磨仪进行研磨。随后,加入5 ml 5%的三氯乙酸(TCA)溶液,混匀,以4℃、16000 r/min的条件离心20 min。取2 ml上清液作为粗酶提取物。
MDA含量测定:
加入2 ml 0.67%硫代巴比妥酸(TBA)溶液混匀;
在100℃的沸水浴中加热30 min,结束后使用冷水快速冷却;
在4℃、5000 r/min的条件下离心15 min;
吸取上清液,分别在450 nm、532 nm、600 nm波长条件下测定其吸光度,重复3次。
样品中丙二醛(MDA)的含量按以下公式计算:
MDA浓度(μmol/L)=6.45×(OD532−OD600)−0.56×OD450
MDA含量(μmol/g FW)=C×V/W
C—MDA浓度(μmol/L)
V—粗酶液总体积(mL)
W—样品鲜重(g)
1.3.2 抗氧化酶活性测定方法
(1)SOD 活性测定方法
酶液提取:精确称取0.5 g的葡萄芽组织样品,剥除外部鳞片,放入离心管中,使用全自动组织研磨仪进行研磨。随后,加入5 ml 50 mmol/L预冷的磷酸缓冲溶液(pH=7.8)混匀,以4℃、16000 r/min的条件离心20 min。取3 ml上清液作为粗酶提取物。
SOD活性测定:
1)配制反应混合液,分别取配好的162 ml甲硫氨酸溶液、6 ml EDTA-Na2溶液、6 ml氮蓝四唑溶液,6 ml核黄素溶液,混合摇匀;
2)分别取1.97 ml反应混合液和0.03 ml酶液于离心管中,即为反应管;同时做2组对照管(1组加1.97 ml反应混合液和0.03 ml(不加酶液)作为最大光还原管,另1组加1.97 ml反应混合液和0.03 ml,同时用锡箔纸包好遮光用于测定时调零);
3)置于4000 lux光照、25℃条件下的光照培养箱中反应30 min;
4)反应结束后,立马取出避光,使用酶标仪分别测定各管在560 nm下的吸光度(OD560),重复3次。
样品中SOD活性按以下公式计算:
SOD总活性(U/g)=2(ACK-AE)×Vt/(ACK×W×Vs)
ACK—对照组吸光值
AE—样品管吸光值
Vt—提取液体积(mL)
Vs —测定时取用的样品体积(mL)
W—样品鲜重(g)
(2)POD活性测定方法
酶液提取:方法同SOD活性测定
POD活性测定:
1)配制反应混合液,将50 ml 0.2 mol/LPBS(Ph=6.0)、28 μl愈创木酚(2-甲氧基酚)19 μL 30%的H2O2混匀,冰箱保存备用。
2)分别取1.97 ml反应混合液和0.03 ml酶液于离心管中混匀,使用酶标仪分别测定各管OD470值在5 min内的变化(上升),20 s测一次,重复3次。
样品中POD活性按以下公式计算:
POD总活性(U/g·min FW)=ΔA×Vt÷(W×VS÷Va)÷0.005÷T=4000×ΔA÷W
ΔA—反应时间内吸光度的变化
Vt—反应体系总体积(ml)
Vs—加入样本体积(ml)
Va—加入提取液体积(ml)
T—反应时间(min)
W—样品鲜重(g)
(3)CAT活性测定方法
酶液提取:方法同SOD活性测定
CAT 活性测定:
1)配制反应混合液,取100 ml 50 mmol/LPBS(pH=7.0)、50 mmol/LTris-Hcl缓冲液(PH=7.0)、0.1546 ml 30%的H2O2混匀,冰箱保存备用。
2)分别取1.97 ml反应混合液和0.03 ml酶液于离心管中混匀,使用酶标仪分别测定各管OD240值在5 min内的变化(下降),20 s测一次。
样品中CAT活性按以下公式计算:
CAT活性(U/g·min FW)=[ΔA×Vt]/(W×Vs×0.01×T)
ΔA—反应时间内吸光度的变化
T—反应时间(min)
Vt—提取酶液总体积(ml)
Vs—测定时取用酶液体积(ml)
W—样品鲜重(g)
1.3.3 淀粉和可溶性糖含量测定
(1)可溶性糖含量测定
1)将葡萄芽组织在80℃烘箱过夜烘干后,称取0.5 g样品倒入10 ml刻度试管中,加入5 ml 80%酒精,置于80℃水浴中保温反应30 min,离心,收集上清液,残渣加2 ml 80%酒精重复提取2次,合并上清液。在上清液中加10 mg活性炭,80℃脱色30 min,定容至10 ml,过滤后取滤液测定。
2)显色及比色,吸取上述酒精提取液1 ml,5 ml蒽酮试剂混合,置于10 ml试管中,加入5 ml浓硫酸,沸水浴煮10 min,冷却至室温。于625 nm下测吸光值,3次重复。
3)绘制标准曲线,将100 mg葡萄糖置于80℃烘箱彻底烘干,按照0-100 μg/ml范围内的梯度浓度制作标准待测液。于625 nm下分别测量吸光值,重复3次,绘制标准曲线。
(2)淀粉含量测定
1)将经过可溶性糖提取后的残渣置于50 ml试管,加入20 ml蒸馏水,沸水加热20 min
2)冷却后加入2 ml 9.2 mol/L的高氯酸,混匀,静置15 min
3)过滤,蒸馏水定容至50 ml,即为待测液
4)吸取提取1 mL待测液和1 mL蒸馏水混匀,置于10 ml试管中(对照加2 mL蒸馏水)
5)加入蒽酮试剂0.5 mL混匀,沿管壁缓慢加入5 mL浓硫酸,将试管置于沸水浴中反应5 min
6)冷却至室温,于540 nm下测定吸光值,重复3次,同标准曲线比较计算出样品含糖量。
1.3.4 蛋白质含量测定
酶液提取:方法同SOD活性测定
蛋白质含量测定:取100 μl待测液,加入2.9 ml考马斯亮蓝溶液,反应5 min,于595 nm下测定吸光值,3次重复。
样品中蛋白质含量按以下公式计算:
蛋白质含量(mg/g)=(C/ug×VT/ml)/(W/g×VS/ml×1000)
C—可溶性蛋白质含量(mg/g)
VT—提取液总体积(ml)
VS—测定时所用提取液体积(ml)
W—样品鲜重(g)
1.4 数据统计与分析
使用EXCEL 2021软件对测量数据进行整理计算,Spass Statistics 27软件分析数据,Origin 2021软件绘制图表。
2 结果与分析
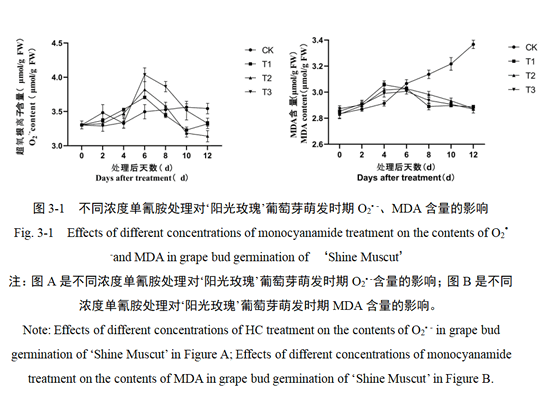
2.1 单氰胺处理对‘阳光玫瑰’葡萄芽O2• -和MDA含量的影响
本研究中分别用不同浓度单氰胺(HC)和清水处理(CK)葡萄芽,并对芽萌发过程中O2▪ -和MDA含量的变化进行分析。结果如图3-1(A)和(B)所示,CK组在处理后O2▪ -含量呈缓慢趋势上升。不同浓度单氰胺处理后,O2▪ -含量都呈现先升后降的趋势,在第6天达到高含量,随后开始迅速下降。其中T1处理在处理后第4-6天含量变化最小,含量为3.72-3.73 μmol/g FW,T3处理含量变最大,为3.79-4.15 μmol/g FW;另外,HC处理组的MDA含量均表现出:第2-4天含量迅速增加,随后下降的变化趋势。其中,T1和T2处理变化趋势基本一致,T3处理与T1和T2处理对比,处理后0-6天含量较低,6天左右含量较高。不同浓度HC组处理均在第12天达到最小值,为2.86-2.89 μmol/g FW。本结果证明,葡萄芽在处理后第2天启动生命活动,随后HC处理组进入萌芽状态,CK组的O2▪ -和MDA含量都呈上升趋势。
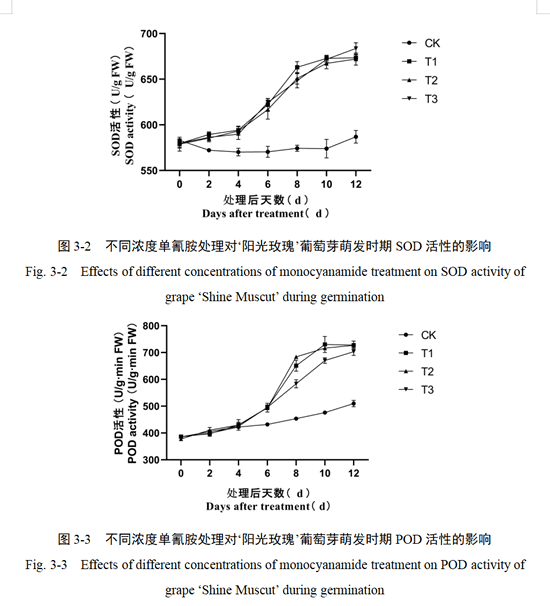
2.2 单氰胺处理对‘阳光玫瑰’葡萄芽组织抗氧化酶活性的影响
如图3-2所示,在试验处理后,HC处理组SOD活性均表现上升趋势,0-4天SOD活性状态变化较为缓慢,4-8天活性急剧上升,于10天后趋于稳定,且在第12天达到最高活性,为678.16(U/g FW)。CK组SOD活性在第0-2天处于下降趋势,随后趋于稳定,直至第10天活性开始上升。总的来说,HC处理组SOD活性均高于CK组,进一步证明了HC处理明显增强芽组织萌发的生命活动。
如图3-3所示,在不同浓度HC处理后,POD活性均在第4-8天急剧上升,随后趋于稳定,于第12天活性达到最高。T3处理POD活性变化速度低于T1和T2处理,其中,处理后第12天T3活性为717.89(U/g·min FW),T1和T2处理POD活性无差别。在前期,CK组的POD活性呈现下降趋势,4天后趋于稳定,直至第10天开始上升。
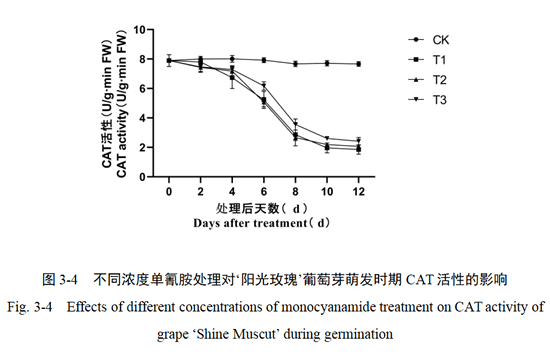
如图3-4所示,单氰胺处理后的CAT活性变化趋势相同,均在处理后第4天呈现下降趋势,第8天后趋于稳定,其中T3处理稍晚于T1和T2处理。另外,CK组对照CAT活性变化趋势不明显,在处理后0-12天内出现小幅度波动。
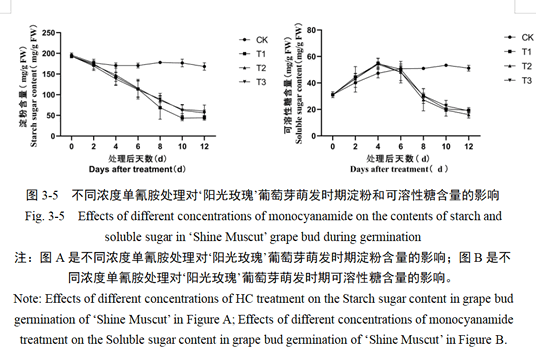
2.3 单氰胺处理对‘阳光玫瑰’葡萄芽组织有机营养物质含量的影响
2.3.1 单氰胺处理对淀粉和可溶性糖含量的影响
研究表明,碳水化合物的转化与果树休眠解除过程中密切相关,是进行休眠和萌芽生命活动的能量来源。在本研究中实验处理后,HC处理组和CK组的淀粉含量均在0-4天呈现下降趋势,随后HC处理组含量继续下降,直至第8天开始趋于稳定。而CK组含量始终保持小幅度波动。HC处理组之间含量变化趋势一致,均在处理后第12天达到最低含量,其中,T1、T2、T3处理分别为39.13、46.23、47.16(mg/g FW)。B图中,HC处理组和CK对照组在处理后2天内,可溶性糖含量呈现上升趋势,随后CK组始终保持稳定水平。HC组均在第4天达到最高值,第6-8天含量迅速下降,于10-12天逐渐趋于稳定,3组处理的可溶性糖含量变化基本一致。综合分析,在HC处理后,淀粉迅速开始水解转化为可溶性糖,为芽萌发提供物质和能量,处理后第10天含量变化趋于稳定,与芽萌发过程变化基本一致。
2.3.2 单氰胺处理对‘阳光玫瑰’葡萄芽组织可溶性蛋白含量的影响
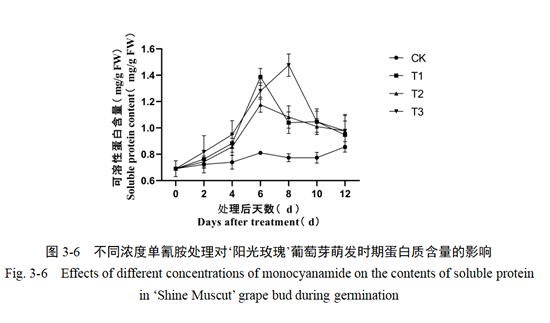
在葡萄芽的萌发过程中,HC处理后的可溶性蛋白质含量变化呈现先上升后下降的趋势。其中,处理后第4-10天含量变化幅度最大,证明本时间段内是芽的迅速生长时期。HC处理后0-4天,可溶性蛋白含量均呈现小幅度波动,第4-6天HC处理含量急剧上升,T1和T2处理在第6天含量达到最高值,分别为1.46、1.34(mg/g FW),T3处理于第8天达到最高值,为1.39(mg/g FW),随后可溶性蛋白含量均开始下降(图3-6)。
3 讨论
活性氧及其清除系统与植物休眠的诱导与解除密切相关。ROS积累作为关键的信号分子,在芽休眠终止过程中引起氧化胁迫功能发挥作用。研究表明,活性氧(ROS)在植物休眠解除过程中含量明显上升,如过氧化氢、超氧阴离子和羟基自由基等(Bailly, 2019)。因此,可以以植物细胞组织内ROS的含量变化为指标,判断植物是否开始萌发生命活动。MDA作为膜脂过氧化的最终代谢产物,可以作为研究植物受伤害和膜脂过氧化程度的指标(周延,2013)。已有研究表明,葡萄芽在单氰胺处理后的萌发过程中,O2▪ -水平显著降低(黄晓婧,2019;王浩,2022)。在本研究中,不同浓度单氰胺处理后第2天,芽组织内的O2▪ -含量呈上升趋势,于第6天萌芽期迅速下降。O2▪ -含量呈上升趋势,可能由于在枝条修剪后立即进行破眠促萌处理,对葡萄产生了一定程度的损伤,其作用机制还需进一步探究。O2▪ -含量随后呈下降趋势,是由于单氰胺处理葡萄休眠芽后,短期内会造成细胞组织内部呼吸紊乱,引起氧化胁迫,进而导致活性氧水平上升(Pérez et al., 2008)。MDA含量上升代表膜脂过氧化进程加快,活性氧含量上升,最终导致膜损伤。
在芽休眠解除过程中,一系列酶活性会发生变化,是植物为防止细胞组织内部的过氧化胁迫造成损伤,自动形成的活性氧清除机制,主要是抗氧化酶类(王春台,1996)。因此,抗氧化系统的运行是芽解除休眠萌发的前提。在本研究中,单氰胺处理后的芽组织在萌发过程中,SOD与POD活性均呈现上升趋势,CAT活性下降,与黄晓婧(2019)、刘朝(2023)、张昂(2008)、房玉慧(2022)等人研究结果一致。但清水对照组与其研究结果不同,抗氧化酶活性水平变化不明显。结果表明,单氰胺处理后,葡萄芽启动抗氧化系统,抗氧化能力迅速提高,维持自身细胞内活性氧动态平衡,促进葡萄芽萌发。
营养物质条件的转化在维持植物的生长发育过程中发挥重要作用。大量研究研究表明,芽在休眠阶段过程,淀粉含量显著上升,休眠解除萌发阶段,淀粉转化为可溶性糖,为芽的生命活动提供物质营养(Mohamed et al., 2010;Richardson et al., 2010)。处于休眠期时,碳水化合物主要以贮藏态的淀粉形式储存;休眠解除时,淀粉水解为可溶性糖,释放能量,以满足萌芽对养分的需要(涂炳坤,2003;Elle and Sauter, 2000)。在本研究芽萌发过程中,淀粉含量逐渐下降,可溶性糖含量逐渐上升,均在处理后第10天趋于稳定。这与韩国秀等(2022)、毕磊(2006)对梨解除休眠后进入花芽分化期的研究结果相似。综合分析,单氰胺处理后的葡萄芽在萌发过程中,淀粉转化为可溶性糖提供能量,清水组含量变化较小,证明其生命活动能力较弱,没有进入萌发状态。
蛋白质和氨基酸是植物进行细胞活动、形态构建的重要生理指标,在芽萌发分化方面具有相同作用(刘宗莉等,2008;孙乃波等,2006)。本研究中,葡萄芽在单氰胺处理后,可溶性蛋白含量呈现先上升后下降的趋势,T3处理可溶性蛋白达到最高含量晚于T1和T2处理,对照组含量变化不明显。与刘朝等人(2023)在单氰胺打破葡萄冬芽休眠的研究中结果不同,其结果是处理组和对照组的蛋白质含量均呈上升趋势。单氰胺处理后葡萄芽内可溶性蛋白含量迅速升高后再降低,可能与第6天进入萌芽快速期,需要大量消耗营养物质进行物质合成、维持生命活动等有关系。
综上所述,单氰胺处理组的O2▪ -含量、MDA含量、抗氧化酶活性(SOD、POD、CAT)、碳水化合物含量和可溶性蛋白质含量的变化均与葡萄萌芽进程密切相关,含量变化与第二章葡萄芽萌发的趋势变化相吻合,因此,可以通过调节其相关作用或含量来调控芽萌发的过程。而且,在热带地区清水处理对芽组织的生理指标变化不显著,推测葡萄必须使用化学药剂处理才能促进芽萌发。