贺兰山东麓综合试验站
姜彩鸽 李建建 宋志娟 马海娟
摘要:在植物病理学研究中,通常需要分离和纯化病原真菌,掌握一套简捷又高效的单孢分离技术,有助于研究工作的顺利开展。本研究以葡萄灰霉病菌为试验材料,比较分析了稀释纯化法、挑针转移法、平板稀释画线法和实体镜下转移法等4种单孢分离方法。试验发现,实体镜下转移法分离成功率最高,高达93.62%。但各方法各有其优缺点,需结合自身优势和实验条件,总结出一套适于自己的简便可靠的单孢分离方法。
关键词:真菌,单孢分离,纯化
真菌病害研究中常会涉及到病原菌的纯培养问题,尤其在病原菌群体遗传特征、致病力分化等研究中总会用到单孢分离技术。因在需病原菌分离的病样上常有各种腐生菌混杂其中,而腐生菌对生长环境要求低,在人工培养基上生长较目标菌株快,用常规病原菌分离方法直接挑取菌株培养易被杂菌污染,成功率低,而使用单孢分离方法纯化则可大大提高纯化成功率。目前,已有多种单孢分离方法可供研究者借鉴使用,一般根据操作难度、单孢分离成功率和应用范围等评估其优缺点。选择某一种单孢分离方法,主要基于其实验室设备、操作习惯和技术掌握的熟练度。但由于各实验室条件不同,某些单孢分离方法中涉及的特殊工具无法在短时间内得到、研究者的操作能力和许多其他问题限制了这些单孢分离方法的应用范围。比如挑针转移法虽然目标孢子明确、准确度高,但无法用于一些不易在标样上产孢的病原真菌;平板稀释画线法虽然操作简便但必须严格控制孢子培养时间;实体镜下转移孢子和眉毛挑针法的显微操作要求对试验操作精准、熟练度较高;切取器分离法分离步骤繁琐、速度慢;稀释纯化法虽然操作简单但要求制备孢子悬浮液的浓度要精准;日本的“后腾氏法”挑取孢子使用的玻璃针易折断;柴荣耀等直接挑取单孢使用的昆虫针较粗,不适宜较小孢子及较密集孢子堆。此研究是在葡萄灰霉病菌单孢分离培养基础上,比较了常用的四种单孢分离方法优劣,以供操作者依自身工作条件、试验材料及个人喜好选择或总结出一套适合自己、简便实用、效率高的单孢分离方法。
1.1 材料与方法
一、1.1 材料
1.1.1 供试材料
试验以葡萄灰霉病菌样品为例,采自贺兰山东麓各葡萄基地,主要是已经发病的果穗或叶片。
1.1.2 试验物品准备
试验需要提前灭菌准备的物品有:显微镜、超净工作台、挑针(解剖针)、解剖刀、涂布器、载玻片、盖玻片、酒精灯、移液枪、移液管、离心管、培养皿、试管、锥形瓶、高压灭菌锅等实验常规用品;无菌水,水琼脂及PDA培养基(添加孟加拉红或链霉素以抑制细菌),并做好水琼脂、PDA平板与PDA斜面。
简易挑孢针的制作参考高金欣等方法。
挑针的制作参考龚国淑等的方法。
二、1.2 实验操作步骤
以下单孢分离操作均需在超净工作台上进行,以防污染。
1.2.1 稀释纯化法
a.孢子悬浮液的配制:先移取1mL无菌水至2mL离心管中,再挑取少量菌丝(孢子粉生长较多部位)到离心管中,充分振荡使孢子充分散开,再从中取20μL孢子悬浮液置入第二个含有1mL无菌水的离心管中,振荡均匀,按照此方法连续稀释数次,直至低倍显微镜下的孢子悬浮液大多数液滴里只含一个孢子为止。
b.孢子悬浮液液滴上覆培养基:取a中稀释好的孢子悬浮液20μL,滴在PDA平板上,每个平板可滴入3-5个液滴,再用灭菌滴管吸取40-50℃的培养基,滴在每个液滴上面,使其覆盖并凝固,再移到真菌培养箱中培养。
c.培养:将做好的培养基液滴放入真菌培养箱25℃、12h光暗交替培养2天,用放大镜不时检查液滴内孢子萌发所形成霉点的情况,若只出现1-2个霉点的培养基即用记号笔标记,以便直接移菌,最后再培养3-5天,直到长出灰色孢子霉层。
d.移菌、保存:将长势好且纯净的菌落移入PDA斜面试管内进行培养,同时完整标记采样时间、品种、地点、单孢分离保存时间等,25℃、12h光暗交替培养3-5天后转入菌种冷藏柜4℃保存。
e.计算单孢分离成功率:将试验重复三次,每次分别制作10个单孢分离培养基,计算单孢分离成功率。
1.2.2 挑针转移法
孢子载体的制备、孢子选取、蘸取单孢、转移单孢:参考高金欣等的方法。
移菌、保存及计算单孢分离成功率:同1.2.1 d、e。
1.2.3 平板稀释画线法
a.制备适宜浓度的孢子悬浮液:同1.2.1 a。
b.画线、培养:参考张昊等的方法。
c.单菌落的转移、培养、保存:选择较分散的单个菌落,在其底部画圈做标记,将标记处培养基切下,转移至新的PDA平板中,25℃、12h光暗交替培养3-5天后,观察菌落形态,进行鉴定,将长势好且纯净的葡萄灰霉病菌菌落移入PDA斜面试管内进行培养,同时完整标记采样时间、品种、地点、单孢分离保存时间等,转入菌种冷藏柜4℃保存。
d.计算单孢分离成功率:同1.2.1 e。
1.2.4 实体镜下转移法
a.制备适宜浓度的孢子悬浮液:同1.2.1 a,不过最后一级孢子悬浮液只需稀释到镜检下的液滴里大多数含1-3个孢子即可。
b.孢子载体的制备:将制备稍硬一点的水琼脂培养基倒入直径为90mm的培养皿内,其厚度1mm−2mm为宜,以便在显微镜下清楚地观察孢子。
c.单孢培养基的分离、转移:用移液枪移取20μL的孢子悬浮液按五点法滴在水琼脂平板上,然后用移液枪依次移取无菌水滴在孢子悬浮液上,放在显微镜下观察孢子的分布变化,将分散度大的孢子在平板底部做记号,再均匀涂布一个范围,然后用解剖刀上下左右将涂布范围划成小的培养基块,用消毒的挑针挑取10小块培养基置于载玻片上,通过目镜观察,将载玻片上只有一个孢子的单孢琼脂块用挑针挑到新PDA培养基中培养,重复三次试验,每组试验确保10个单孢琼脂块。
d.移菌、保存及计算单孢分离成功率:同1.2.1 d、e。
2.2 结果与分析
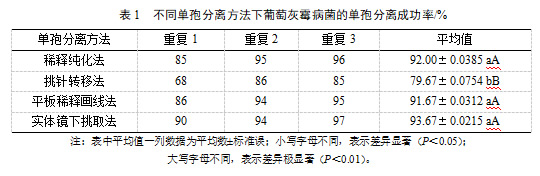
本研究以单孢分离葡萄灰霉病菌为例,4种单孢分离方法结果见表1:
2.1 稀释纯化法
从表1可看出,稀释纯化法单孢分离成功率相对较高,达91.86%,且试验操作简单快速,但制备合适的孢子悬浮液要求较高,需要重复稀释的次数较多,直到孢子密度合适时单孢分离效果才好。孢子密度是影响单孢分离成功率的关键因素,孢子密度越低,越可以轻松锁定目标孢子,且不易使非目标孢子污染目标孢子。此方法笔者使用较多。
2.2 挑针转移法
此方法进行真菌的纯化分离成功率最低,仅为79.22%,与其他方法差异显著。主要是因为在显微镜下挑取时,分生孢子无色透明,不易观察清楚。虽然获得的单孢子是可靠的,但操作复杂、困难、耗时、费力,不适合大批量病样的分离。要熟练进行孢子分离操作,需注意:(1)要依孢子大小选择挑针的细度,针尖细而光滑;(2)挑取孢子前将针尖在新鲜培养基上撵动一圈,以保持针尖表面湿润,便于蘸取孢子;(3)显微镜视野下操作时可将掌根轻轻靠在载物台边缘,以保持挑针的平稳;(4)显微操作时可暂时关闭或调低超净工作台通风设备,避免孢子飘移、掉落及培养基表面快速失水。
2.3 平板稀释画线法
此方法单孢分离成功率也较高,达91.58%,关键是操作步骤简单快捷,不需要在镜下观察,且保留了稀释纯化法的优点。但在试验操作过程中,因病样本身常混杂有各种腐生菌,若画线平板上孢子分布过于密集,极易交叉生长,导致纯化失败。因此,在单孢转移时一要选择较分散且纯净的菌落,二要在霉点出现时及时转移,三要尽可能多地转移单菌落,以提高目标孢子分离成功率。此方法笔者也使用较多。
2.4 实体镜下转移法
实体镜下转移法分离成功率最高,高达93.62%,主要是结合了前面三种方法的优点,克服了挑针转移法操作难度高的缺点。但此方法需对显微镜熟练操作情况下才能高效运用,盖因把培养皿放在显微镜下观察孢子悬浮液中的孢子数量时,不断移动培养皿观察孢子时因液滴晃动需不断调整焦距准确记录单孢数量。
3.3 结论与讨论
3.1 稀释纯化法
此方法稀释过程较繁琐,孢子悬浮液的浓度难以合适配比,但若制备出适宜浓度的孢子悬浮液,单孢分离的成功率还是挺高的。但是由于这种方法实质上是分离菌落,孢子悬浮液浓度高时不能确定一个菌落是从单个孢子繁殖而来,纯化的可靠性较差,而浓度过低可能长不出菌落。张昊等预试验确定了在孢子浓度为1个/μL时,每2μL孢子悬浮液中出现1个孢子的几率达到50%,而无孢子的几率为35%,这样单菌落由单孢子繁殖而来的可靠性就达到85%,只需继续改良试验方法,最大限度地排除出现2-5个孢子的15%情况即可得到可靠的单孢子分离物。
3.2 挑针转移法
该方法更适合于具有大型、深色孢子的真菌分离纯化,如镰刀菌、锈菌、蠕形菌、弯孢霉、链格孢等;尤其适合不新鲜或不单一、其病原菌在培养基上生长缓慢的病样,从上直接挑取单孢,分离纯化成功率较其他单孢分离方法高。且此法所用工具简单,一般实验室条件即可操作,不需特殊设备和严格的无菌环境。挑针转移法进行单孢分离试验时最关键的是要熟练操作转移的要点,经过多次试验,从而掌握自己挑取转移的规律。怎样转移成功率较高,只有在试验中摸索,才能真正熟练掌握此方法。
3.3 平板稀释画线法
经过多次试验,此方法是获得单个真菌孢子既准确、又迅速的单孢分离方法,适用于分离不同类型真菌的孢子,特别是大量病样的分离纯化。张昊等仅用2μL孢子悬浮液画成一条直线,且每个平板5条直线,不仅利于多个孢子分散开,也可保证每个平板均有菌落生长,且有更多的选择来舍弃生长重叠或有污染的菌落,只需挑取较分散、单一、纯净的菌落进行转移、培养。3-5天菌落生长完成,通过鉴定得到目标纯化菌落即可,保证了纯化结果的可靠性。
3.4 实体镜下转移法
该方法是在比较分析改良了前人单孢分离方法基础上总结出的适于自己的一套技术。即在显微镜下直接挑取单个孢子的培养基块,分离到的单孢几乎无杂菌污染,保证了单孢的正常生长发育,掌握熟练的操作成功率可达90%以上,同时免去了分离培养中消毒、重复纯化等一系列过程。但该方法若掌握不熟练、技巧性不强则有一定的缺陷:(1)将培养皿放在显微镜下观察,因不便固定,培养皿不能准确移动,不利于寻找孢子的范围;(2)由于是随机划取,取得的单孢培养基几率不宜掌握。
通过四种单孢分离试验比较可以看出,每种方法都有其优缺点,稀释纯化法和平板稀释画线法操作简单但孢子悬浮液浓度不易稀释精确;挑针转移法步骤简单但技巧性强不易掌握;实体镜下转移法纯化度较高但显微镜使用技巧性要求较高。单孢分离纯培养方法很多,具体选择哪种试验方法,不仅要参考前人经验,也要结合自身优势和实验条件,经过反复试验验证,不断从细节中发现问题,解决问题,从而整合出一套适于自己的单孢分离方法。