加工与综合利用
兰义宾
1 研究目的意义
我国葡萄酒产区众多,每个产区都有鲜明的生态特征。其中,宁夏贺兰山东麓产区和新疆产区气候干旱、昼夜温差大,产区的葡萄酒果实的含糖量普遍偏高,产生的葡萄酒的酒精度偏高(14-16% v/v),这会导致苹乳发酵的迟滞和中止。葡萄酒苹乳发酵可以通过自然发酵或接种选定的乳酸菌发酵剂启动发酵。葡萄酒乳酸菌发酵剂可以缩短苹乳发酵的时间,同时丰富葡萄酒的风味,并且在野生细菌菌株中占据主导地位,减少不良风味产生。常选用酒酒球菌或植物乳杆菌两种菌株作为发酵剂。酒酒球菌对葡萄酒环境的具有高度耐受性,是葡萄酒苹乳发酵的常用菌株。随着植物乳杆菌的酿酒特性和对葡萄酒的风味影响的研究不断增加,除了完成苹乳发酵,植物乳杆菌还具备能够影响葡萄酒风味的广泛酶谱。经过前期的筛选、分离和耐受性评估,实验室已得到3株高耐受高酒精度的植物乳杆菌。本研究现将3株植物乳杆菌及其与酒酒球菌菌株组合应用在赤霞珠葡萄酒中,探究以植物乳杆菌为主的单菌及其混合发酵对葡萄酒香气品质的影响,为植物乳杆菌与酒酒球菌混合发酵影响葡萄酒香气提供参考依据。
2 材料与方法
2.1发酵菌株及培养
所选的菌株有:商业乳酸菌O. oeni VP41(Lallemand, Inc., Montreal, BC, Canada)。从中国河北葡萄酒中分离出来的三株植物乳杆菌:L. plantarum B16,C10,D30。植物乳杆菌和商业乳酸据分别在MRS和MRS-AJ液体培养基中培养至对数生长期,在酒精含量10%的驯化培养基中驯化后,接种至20 L赤霞珠葡萄酒中。
2.2 苹果酸乳酸发酵实验
本研究使用宁夏创新中心的赤霞珠葡萄酒(酒精发酵结束后的酒样)。酒精发酵时采用RX60酵母启动发酵。
通过离心收获驯化细胞,并在20 L葡萄酒中接种菌株以诱导 MLF,设置8种接种策略,一式三份,葡萄酒样品在20 ℃下进行苹乳发酵。。乳酸菌接种策略分为两种:单菌接种(O. oeni VP41、L. plantarum B16、L. plantarum C10、L. plantarum D30)和混菌接种 (O. oeni VP41+ L. plantarum B16, O. oeni VP41+ L. plantarum C10, O. oeni VP41+ L. plantarum D30)。当L-苹果酸含量降至 0.2g/L 时加入40 mg/L SO2终止发酵,低温储存以备检测用。
2.3 发酵过程中活菌数与L-苹果酸测定
采用热培养基倾注法测定活菌数。取葡萄酒样品1 mL,用生理盐水稀释 10-9-10-1 CFU/mL 浓度梯度菌液后,混合均匀取1 mL稀释液加入培养皿中,倾注热MRS固体培养基并摇匀,待培养基冷却凝固后,放置恒温培养箱于37 ℃倒置培养48 h后计算菌落数。
采用BioSystems® Y15试剂盒检测L-苹果酸的含量。将L-MALIC ACID试剂盒放入相应试剂槽中,确保仪器已校准并处于正常工作状态,将装有葡萄酒样品的小杯按顺序放入仪器的样品架,选择L-苹果酸检测方法启动程序,记录检测结果。
2.4 菌株定殖确定
采用随机多态性DNA聚合酶链式反应(RAPD-PCR)的方法确定未灭菌赤霞珠葡萄酒中植物乳杆菌的定殖。在苹乳发酵终止点,取葡萄酒样品稀释至MSR平板上,从MRS平板上随机选择10个菌落,用DNA试剂盒提取DNA。使用引物M13进行RAPD-PCR分析,PCR 产物在1.5%(w/v)琼脂糖电泳凝胶上用5000bp的Maker分离。通过比较每个菌落的RAPD电泳图谱和接种菌株的电泳图谱,确定菌株定殖。
2.5 葡萄酒基本理化指标测定
采用FOSS Winescan(FT 120, Foss Electric, Hillerød, Denmark)检测葡萄酒得基本理化指标(还原糖、酒精度、总酸、挥发性酸、pH、乳酸、酒石酸、柠檬酸)。葡萄酒样品8000 rpm离心10min取上清液准备上机。
2.6 数据统计与分析
采用顶空固相微萃取结合气相色谱与质谱联用(HS-SPME-GC-MS)方法对葡萄酒中的高级醇类、酯类、脂肪酸类、萜烯及降异戊二烯类等挥发性香气物质进行测定。取5 mL葡萄酒样品、1.5 g氯化钠、10μL 内标(4-甲基-2-戊醇,1.018 g/L)加入20 mL 样品瓶中,使用聚四氟乙烯瓶盖密封后准备上机。使用CTC CombiPAL自动进样器(CTC Analytics, Zwingen, Switzerland)完成HS-SPME前处理。酒样在40 ℃平衡 30 min后,在2 cm聚二甲基硅氧烷/碳筛/二乙烯苯(DVB/CAR/PDMS)SPME 萃取头(50/30 µm, Supelco, US)吸附30 min。
使用Agilent 7890B-5975C(Agilent Technologies, Santa Clara, CA, USA)和HP-INNOWAX色谱柱(60 m×0.25 mm×0.25 µm, J&W Scientific, CA, USA)进行GC-MS 分析。进样口温度为250 ℃,进样分流比为5:1,热解析8 min。载气为高纯氦气,其流速1 mL/min。色谱柱升温模式为:50℃保持1 min,3℃/min 升温至220℃保持5 min。质谱接口温度为250 ℃,电子轰击离子源(EI),离子能为70 eV,离子源温度为230 ℃,四级杆温度为150 ℃,质量扫描范围为29-350 u。
依据自动质谱图解卷积系统(AMDIS)计算保留指数(RI)及在NIST 11商业谱库中比对质谱图对化合物进行定性。利用 Masshunter 软件(MS 定量分析)积分峰面积,以各物质与对应内标的峰面积比为定量依据。
2.7 数据统计与分析
采用香气定量描述性分析(quantitative descriptive analysis, QDA)方法对葡萄酒样品的香气轮廓进行评价。感官分析小组包括16名品评员(8名男性,8名女性,22至30周岁),品评员是中国农业大学葡萄与葡萄酒研究中心(CFVE)的学生或工作人员。正式品评之前,感官小组评估葡萄酒样品,记录样品的香气描述词,最后确定7个香气描述词概括所有酒样的香气轮廓,包括生青、红色浆果、黑色浆果、新鲜水果、干果、奶酪及整体香气强度。小组成员进一步熟悉描述词对应的标准参考物并对每种香气强度的打分均能达成一致。参考标准的配制见附表2。共以11分制衡量每种香气描述词的强度(0=“不存在”,1=“非常低”,10=“非常高”)。感官分析在干净、无异味、光线充足的感官实验室进行。在18 ℃下冷藏的编码葡萄酒样品被随机呈现给感官小组。在25±1℃的温度下对各样品进行了感官品尝。每个样品之间的间隔时间为10-15分钟。最后使用PanelCheck软件对每位评价员的数据进行评估和校正,剔除对同一样品重现性较差的评价员数据。
2.8 数据统计与分析
采用分光测色计(CM-3700A, Konica Minolta, Tokyo, Japan)对葡萄酒颜色进行测定。葡萄酒样品经0.45μm聚醚砜膜(Jinteng Experimental Equipment Co., Ltd, Tianjin, China)过滤后,在2 mm 比色皿中进行检测,记录L*值、a*值、b*值,空白对照为蒸馏水。
2.9 数据统计与分析
值表示为SD±平均值(n≥3),所有误差表示为每个处理一式三份的标准差(SD)。单因素方差分析与事后多重比较利用SPSS 20.0(SPSS Inc.,Chicago,IL)完成。采用Duncan 检验(p < 0.05)来确定处理之间的显着差异,不同的字母表示统计学上的显着差异。使用GraphPad Prism 9处理折线图。使用TBtools绘制热图。使用ORIGIN绘制PCA图和雷达图。
3 结果与讨论
3.1 发酵过程中菌株动力学变化
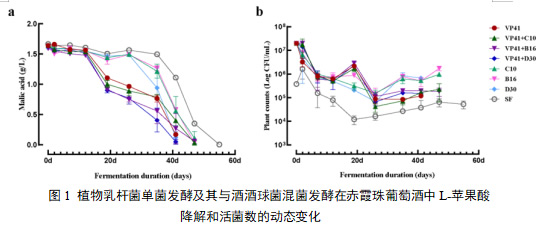
酒酒球菌和植物乳杆菌以两种接种策略(单菌接种和混合接种)接种至赤霞珠葡萄酒中进行中试规模的酿造。图1显示发酵过程中L-苹果酸和活菌数的动力学变化。乳酸菌接入葡萄酒后,菌株活力下降,在第5天降至106 CFU/mL。接种后活菌数下降是由于葡萄酒中的高含量乙醇和较低的pH。在第12天之后,单独VP41和混菌接种的葡萄酒(VP41+B16, VP41+C10, VP41+D30)启动苹乳发酵,迅速消耗L-苹果酸至1.0 g/L,其中VP41、VP41+D30的样品发酵用时28天。接种植物乳杆菌B16、C10、D30的葡萄酒在第26天启动苹乳发酵,其中D30苹乳发酵用时14天,B16、C10苹乳发酵用时21天。两种接种策略的苹乳发酵均快于自然发酵,这说明接入的菌株均发挥了积极的发酵作用。
酒酒球菌VP41单菌发酵和混菌发酵的处理中,菌株的适应期短,植物乳杆菌B16、C10、D30的适应期较长。这与菌株代谢苹果酸的机制差异有关,乳杆菌(Lactobacillus)和球菌(Oenococcus)在苹果酸代谢过程中使用不同的酶系统,并且这些酶系统的调控机制和功能有所差异。酒球菌(O. oeni)主要通过苹果酸乳酸脱羧酶(MLE)途径将苹果酸转化为乳酸,释放H+从而调控细胞的pH,促使其适应环境。因此,酒球菌在转化苹果酸时,可能具有更高的酸降解效率。乳杆菌(Lactobacillus)则通过MLE途径和苹果酸酶(ME)途径代谢苹果酸,ME途径主要目的是能量生成而非降酸,其转化苹果酸的效率可能较低,特别是在没有充分依赖于MLE途径时。混菌发酵的葡萄酒MLF较仅接种VP41的更快。这与前人的研究结果一致,与单菌接种相比,两个种乳酸菌物种混合发酵MLF效率更高。
3.2 发酵后乙基酚及其前体物分析
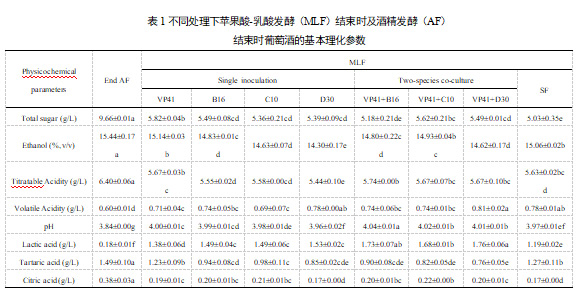
在苹乳发酵后,葡萄酒的基本理化参数有显著变化,首先就是总酸含量下降,pH值升高。在不同发酵方式上,混合菌发酵(VP41+B16、VP41+C10、VP41+D30)相比单菌发酵(B16、C10、D30)葡萄酒的乳酸含量显著更高。单菌发酵的葡萄酒中,植物乳杆菌的乳酸产量明显高于酒酒球菌,这可能与菌株的糖代谢特性有关。除了将苹果酸1:1转化为乳酸外,乳酸菌还可通过糖代谢生成乳酸。植物乳杆菌消耗一分子己糖生成两分子乳酸,而酒酒球菌生成一分子乳酸和乙酸。植物乳杆菌主要通过糖酵解途径消耗己糖生成乳酸,而酒酒球菌则能够利用植物乳杆菌不易利用的糖(如五碳糖),通过磷酸戊糖途径进一步发酵,生成乳酸和乙酸等副产物。混合菌发酵可以使两者在糖的利用上互为补充,从而显著提高乳酸的整体产量。此外,混合菌发酵的葡萄酒pH值和总酸度也显著高于单菌发酵,表明混合菌发酵有助于更有效地降低酸度。
乳酸菌还消耗葡萄酒中的其它营养物质如柠檬酸、酒石酸等。各接种方式苹乳发酵后消耗柠檬酸在0.16-0.21 g/L范围内。乳酸菌对柠檬酸的代谢产生二乙酰、2,3-丁二酮等物质影响葡萄酒的风味。D30单菌发酵和D30+VP41混菌发酵的葡萄酒中含有更多的挥发酸,均不超过规定浓度。苹乳发酵后,葡萄酒的酒精度下降,这或许与酯类物质动态合成有关。
3.4 菌株定殖分析
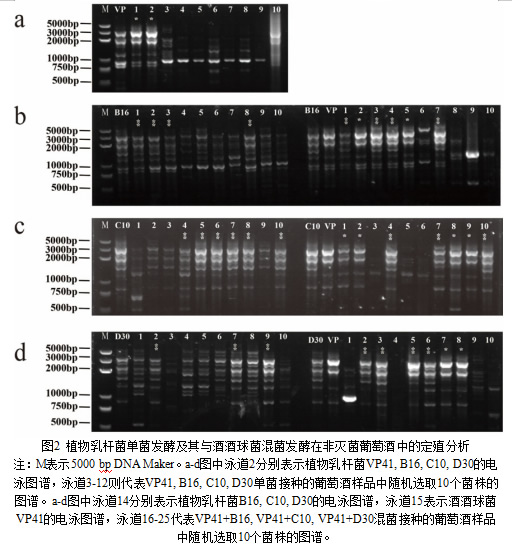
用RAPD-PCR技术评估植物乳杆菌和酒酒球菌分别在非灭菌葡萄酒样品中的植入能力。图2显示,所有处理均能够在非灭菌葡萄酒中成功定殖:对于单菌接种的葡萄酒,VP41(20%),B16(40%),C10(60%),D30(30%);对于混菌发酵的葡萄酒,VP41+B16(20%+40%),VP41+C10(40%+30%),VP41+D30(20%+40%)。定殖分析显示,发酵终点存在接种菌株,植入能力低于100%。这与之前的研究结果一致。这表明接种菌株虽然能够在非无菌葡萄酒中定殖,但其定殖情况受到了与天然微生物竞争、环境条件以及菌株特性差异等多种因素的影响,未能完全占据葡萄酒中的微生物生态位。
3.5 香气化合物分析
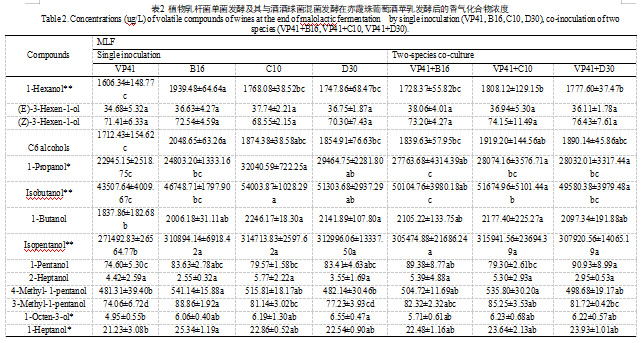
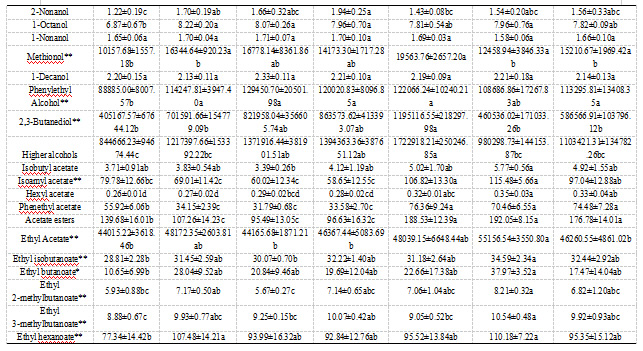
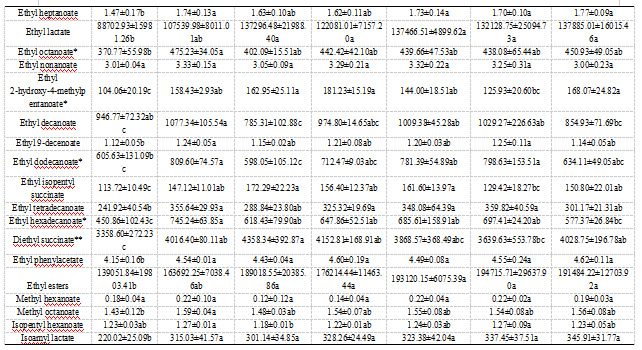
这项研究中,葡萄酒中共检测出63种挥发性化合物,3种C6醇,16种高级醇,29种酯类(4种乙酸酯,19种乙酯,6种其他酯),萜烯和降异戊二烯类物质4种,5种脂肪酸和还有4种其他类别的物质。
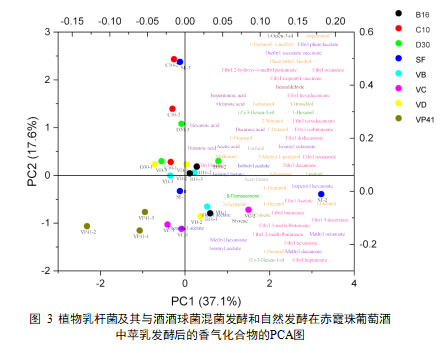
自然发酵的样品生物学在PCA图中分布在三个象限,生物学平行差异过大(如图3)。在其他7种接种策略中,仅接种VP41的葡萄酒的多数香气物质含量显著低于其他6种接种策略的葡萄酒。根据图样品层次聚类分析,样品可分为四类:单菌接种VP41,单菌接种C10,单菌接种(B16、D30),混合接种(VP41+B16、VP41+C10、VP41+D30)。
酯类为葡萄酒贡献果香,乳酸菌发酵对调控酯类物质有重要作用。总体而言,与AF相比,MLF后葡萄酒的酯类物质显著性增加(如图2)。MLF之后,乳酸菌接种的葡萄酒中的脂肪酸乙酯大量增加,由于乳酸乙酯的显著增加。乳酸乙酯是MLF过程中由乙醇和乳酸之间的酯化作用生成的特征香气化合物,为葡萄酒带来果香、黄油和奶油香以及圆润的味道。
如表2中,混菌发酵乙酸酯物质的含量显著高于单菌发酵的葡萄酒,这种发酵方式能够保留葡萄酒中原有的乙酸酯,如乙酸异戊酯、乙酸苯乙酯。这些乙酸酯可以贡献令人愉悦的果香,MLF后乙酸酯的增加在之前就已经被报道。我们的研究表明,同单菌接种相比,微生物群落能够进一步增加葡萄酒中的乙酸酯类物质含量,之前的研究也观察到了类似的现象。另外,乳酸菌能够通过降解丙酮酸生成双乙酰,双乙酰氧化或还原生成2,3-丁二醇和乙偶姻,能够给葡萄酒带来奶油、黄油的味道。两种乳酸菌混菌发酵的这三种物质含量均高于单菌发酵,这是混菌接种的方式造成的,混菌发酵中细菌-细菌协同作用导致丙酮酸的降解更加活跃的结果。
萜烯和降异戊二烯物质能够为葡萄酒提供花香和甜香。与AF的葡萄酒相比,MLF之后的葡萄酒中的萜烯类物质总量降低,其中里那醇、香茅醇在MLF之后含量增加。植物乳杆菌主导苹乳发酵后的的葡萄酒中里那醇和香茅醇含量高于酒酒球菌。这种差异可能与菌株的糖苷酶活性及其类型密切相关。植物乳杆菌具有更高的糖苷酶活性,能够更有效地将糖苷结合态的香气前体物质水解为游离态的香气化合物,从而释放出更多的里那醇和香茅醇。
不同菌株风味特征也有所差异。从热图中可以看出,VP41+C10混合MLF发酵主导的葡萄酒的酯类物质含量丰富,特别是短链脂肪酸乙酯,如乙酸乙酯、异丁酸乙酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、己酸乙酯等物质。这些酯类的OAV均大于1,能够显著贡献果香和甜香,这与该样品在感官评价中表现出的浓郁新鲜水果特征相一致。B16主导MLF的葡萄酒的长链脂肪酸乙酯含量丰富,如癸酸乙酯、9-癸烯酸乙酯、月桂酸乙酯、肉豆蔻酸乙酯、棕榈酸乙酯等物质。如表S2中,单菌接种VP41主导的MLF,C6醇的含量显著降低。在MLF过程中,植物乳杆菌对C6醇的影响有限。MLF后的葡萄酒的高级醇含量显著降低,不包括C10单菌发酵的葡萄酒。C10单菌发酵的葡萄酒高级醇含量明显高于其他样品。单菌接种C10的葡萄酒的脂肪酸含量也显著高于其他接种方式的。这是由于异戊酸、丁酸、己酸的大量生成,且这些物质的OAV含量大于0.1。
挥发酚类对葡萄酒的香气有负面影响,呈现动物味或汗味。过去的研究表明,乳酸菌存在生成挥发酚的pad基因,且能够产生挥发性酚类物质。在我们的研究中,在所有接种的葡萄酒中均没有检测到挥发性酚。

3.6 颜色参数分析
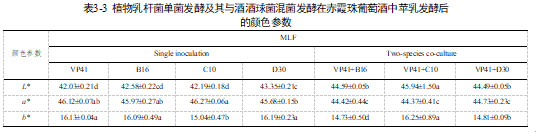
对不同乳酸菌处理下苹果酸-乳酸发酵(MLF)结束时葡萄酒的基本理化参数进行分分析,不同接种方式导致葡萄酒的颜色参数有差异。混菌发酵的葡萄酒较单菌发酵在颜色参数有差异,其中混菌发酵葡萄酒的L*显著高于单菌发酵的,表现葡萄酒的酒体亮度高,颜色浅;而单菌发酵a*显著高于混菌发酵的,红色色调明显。除此之外,接种策略带来的颜色参数的差异小于各菌株之间差异。
3.7 感官特征分析
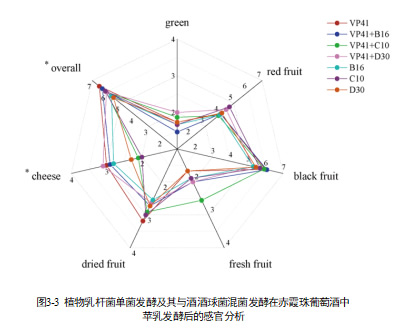
基于QDA对赤霞珠葡萄酒进行颜色分析和感官评价,以研究乳酸菌菌株带来的感变化,如表2所示。各乳酸菌处理‘赤霞珠’葡萄酒苹乳发酵后,整体感官轮廓均以黑色浆果为主,其次红色浆果,少量的果干/果脯味和生青味。按照奶油/奶酪味可将不同菌株发酵分为两类:第一类包括VP41+C10、C10和D30,特征是具有较少的奶油/奶酪味;第二类包括VP41、B16、VP41+D30、VP41+B16,特征是酒样具有可识别的奶油/奶酪味。另外VP41+C10的葡萄酒的新鲜果香的打分较其他发酵方式的更高。在感官分析中,不同接种混菌发酵和单菌发酵并无明显差异。
3.8 结论
通过将筛选出的三株植物乳杆菌B16、C10、D30应用在‘赤霞珠’葡萄酒中进行苹乳发酵,同时分别与商业酒酒球菌VP41混合进行苹乳发酵,通过对发酵过程中的菌株代谢生长动态、菌株的定殖能力和对发酵后葡萄酒的理化参数、香气化合物、感官和颜色的分析,从中进一步筛选出一种能够应用在实际生产和优良风味影响的植物乳杆菌发酵策略。主要结论如下:
(1)三株植物乳杆菌B16、C10、D30均能完成苹乳发酵,且快于自然发酵。所有接入的菌株均在葡萄酒中完成定殖。酒酒球菌启动苹乳发酵快,而植物乳杆菌在葡萄酒中启动苹乳发酵前需要一段适应期。由于两种菌株的代谢通路有差异,相较酒酒球菌,植物乳杆菌能够产生更多的乳酸。两种菌种混合接种在苹乳发酵上相互协同,不需要适应期直接启动苹乳发酵,且还能额外利用还原糖,显著提升乳酸的产量,从而提高酒的pH,柔和口感。
(2)接种不同植物乳杆菌及其混合发酵启动的葡萄酒苹乳发酵能影响葡萄酒的香气。与酒精发酵相比,所有接种乳酸菌苹乳发酵后的葡萄酒有显著的香气变化,特别是酯类物质显著增加,这是由于苹乳发酵后生成的大量乳酸导致的乳酸乙酯、乳酸异戊酯显著增加。
(3)混菌发酵的接种方式能够改变葡萄酒中的香气组成,如乙酸酯、双乙酰等物质。混菌发酵的葡萄酒的乙酸酯类物质含量显著高于单菌发酵的葡萄酒。柠檬酸代谢的产物2,3-丁二醇、双乙酰、乙偶姻的物质含量也高于单菌发酵的葡萄酒。这或许是由于两种菌种的协同互作使酯类物质的合成和柠檬酸代谢更加活跃。
(4)最后,不同植物乳杆菌发酵能够改变葡萄酒的香气。单菌发酵和混菌发酵7种处理之中,酒酒球菌VP41的香气化合物的含量低,植物乳杆菌B16葡萄酒的长链脂肪酸乙酯含量更高,植物乳杆菌C10的葡萄酒的高级醇和脂肪酸的物质含量更高。VP41+C10的混菌发酵的乙酸酯和短链脂肪酸乙酯物质含量较高,在感官中也对应得分更高的新鲜果香。
综上所述,混合发酵较单一菌株有更快的苹乳速率,有利于丰富葡萄酒香气物质含量、改善酒样香气表现,特别是VP41+C10混合发酵。下一章的研究将聚焦于植物乳杆菌C10及其与酒酒球菌VP41混合发酵的接种策略研究,以探究对葡萄酒感官风味影响最佳的苹乳发酵的接种策略。