济南综合试验站
刘利 李勃
氮素是植物生长发育所必需的大量矿质元素之一,参与作物体内氨基酸、蛋白质、激素、核酸、叶绿素、酶、维生素和生物碱等关键有机化合物的组成(Novoa and Loomis, 1981; Krapp, 2015; 张合琼等, 2016)。氮素是植物生长发育所必需的重要营养成分(Novoa and Loomis, 1981; 张合琼等, 2016; Xu et al., 2016),对促进果树的生长、器官的形成、花芽的分化,提高果树产量及果实品质具有重要的作用(彭福田等, 2006; 李洪娜等, 2015)。植物能够吸收利用生长介质中的无机氮 (硝酸盐和铵盐等)和有机氮(尿素和氨基酸等),无机氮是果树从土壤吸收氮素的主要形式(Qian et al., 2015),包括硝态氮和铵态氮。硝态氮是高等植物可直接利用且最易被植物吸收的氮素营养形态,直接影响光合电子传递、糖类运输、蛋白质表达及二级代谢物等合成(Crawford and Glass, 1998)。Mo是NR的活性成分,在硝酸盐还原为亚硝酸盐的过程中起着传递电子的作用。铵态氮是由土壤含氮有机物在微生物的作用下形成的,在好气条件下很容易成为硝态氮。二者皆为水溶性的,铵态氮主要为交换态,而硝态氮则是土壤溶液的主要成分,可被植物吸收利用。
钼(molybdenum,Mo)是植物正常生长发育所必需的一种微量元素。岩石圈中Mo的含量一般是1.2 mg·kg-1,通常以MoS2、PbMoO4和Fe2(MoO4)3的形式存在(Kaiser et al., 2005);植物体内Mo的含量一般是0.2 mg·kg-1(Gupta, 1991)。在土壤中,Mo主要以钼酸根离子(MoO42-)的形式存在,参与到各种生命过程中。土壤中有效Mo的含量是评价土壤供Mo能力的指标,Mo的可利用性在高浓度的土壤氮素水平、低温以及低的土壤pH(<5.5)下较低(Nie et al., 2014)。世界上很多地方土壤中的有效Mo含量不能满足植物正常生长发育所需,对于酸性土壤这一现象尤其严重(巫飞飞等, 2015)。据报导,在我国有大约4400多万ha耕地缺Mo(Nie et al., 2014),生长在有效Mo含量低的酸性黄棕壤上的冬小麦等作物出现了严重的缺Mo症状(Yu et al., 2010)。Mo缺乏的症状有钼酶活性降低、氮饥饿反应、茎和叶发育受阻、叶枯斑病、种子发育不良、坐果率降低等(Martin and Meybeck, 1979; Kaiser et al., 2005; 巫飞飞等, 2015)。
葡萄(Vitis vinifera L.)属于葡萄科葡萄属植物,是我国当前经济栽培效益最好的果树树种之一。2021年我国葡萄的种植面积约为735.50千公顷,产量约1443.00万吨,位居世界葡萄产量的首位。然而,一直以来,我国果树栽培遵循“上山下滩,不与粮棉油争田”的原则,大多数果园主要集中在山地丘陵地区,土层浅,土地瘠薄,立地条件差等问题突出。葡萄种植者为了获取较高的产量和经济效益,过度追求葡萄园早产丰产,滥用化肥(以氮肥为主)。氮肥的过量施用不仅增加了葡萄种植成本,降低了氮素养分响应度和氮肥利用率,而且导致土壤有机质含量低,土壤酸化,矿质营养失衡,威胁我国葡萄产业的健康、持续和稳定性发展。因此,研究钼对不同氮源条件下氮素吸收、利用具有重要的意义。
1.1 材料与方法
1.1.1 试验材料与试验设计
试验于2021年在山东农业科学院济阳基地日光温室进行。葡萄供试品种为3309m嫁接的阳光玫瑰(Vitis labrusca×V. vinifera ‘Shine Muscat’),采用沙培技术,将葡萄幼苗定植于塑料盆中(23 cm × 21.5 cm)。待幼苗长到3~4片真叶时移至栽培槽中进行试验。幼苗用改良的霍格兰营养液进行处理,营养液中含有7.0 µM硝化抑制剂双氰胺,该营养液含N 7.14 mmol/L, N: P:K的比例为 1:0.85:1.1,其它营养元素MgSO4为493 mg L−1 , H3BO3为2.86 mg L−1, Fe-EDTA为30 mg L−1, MnSO4为2.13 mg L−1, ZnSO4·7H2O为0.05 mg L−1, CuSO4·5H2O为 0.05 mg L−1. 不同氮源分别为:硝酸盐(NO3-),硝酸盐和铵盐(NH4NO3,50:50),和铵盐(NH4+),三种氮源下分别添加1 μmol L−1Na2MoO4- ·2H2O 和0 μmol L−1Na2MoO4- ·2H2O作为处理。每个处理50棵幼苗,营养液每7d更换一次,培养50d取样测定各项指标。
1.1.2 植株生长指标的测定
植株分为根系和地上部两部分,冲洗干净后,放置烘箱中105°C杀青30分钟,然后80°C烘干,测定干重。
用清水洗净根系,将根系平铺于透明硬塑料板上,在水中将根系展开,用WinRHIZO (2007年版)根系分析系统获取根系扫描图形,记录总根长、平均根直径、根尖数以及总表面积,重复3次。
根系活力采用TTC法测定。准确称取0.5g根,洗净,用滤纸吸干,放入盛有10ml等体积0.4% TTC溶液和磷酸缓冲液混合液的试管中,封口,37℃避光培养4h后,加入2ml 1mol/L硫酸终止反应。空白对照先加2 ml 1 mol/L硫酸终止反应。放置15 min后,分别将实验组和对照组的根系取出,滤纸吸干水分,放入研钵中,加入3ml乙酸乙酯,充分研磨,以提取出TTF。把红色提取液(TTF)转移至离心管,并用少量乙酸乙酯把残渣洗涤2~3次,再将洗涤液一并转移至离心管,补加乙酸乙酯至10ml,封口摇匀,在485nm下比色测定。
1.1.3 植株钼含量,叶绿素含量,氨基酸和可溶性蛋白含量的测定
1.1.3.1 植株钼含量的测定
参照Wang等(2016)的方法进行,称取葡萄干样0.3 g于消解管中,加入5 mL优级纯浓硝酸浸泡过夜后,再加入2 mL优级纯双氧水,采用微波消解萃取仪进行消解,消解完全冷却后转移至比色管中,用超纯水定容至50 mL,放置过夜即可得样品待测液。采用相同消解方法制备空白对照组,用NexION 300X型电感耦合等离子体质谱仪测定。
1.1.3.2 叶绿素含量的测定
利用分光光度法(赵世杰等,1998)测定。原理:叶绿体中的叶绿素a、叶绿素b和类胡萝卜素在不同的溶剂中的吸收光谱有差异。叶绿素a和叶绿素b的80%丙酮提取液在红光区的最大吸收峰波长分别为663nm和645nm,类胡萝卜素的80%丙酮提取液最大吸收峰波长为470nm,计算公式如下:
Ca=12.21D663-2.81 D646
Cb=12.21D663-2.81 D646
Cx.c=(1000D470-3.27Ca-104Cb)/ 229
叶绿素a、叶绿素b和类胡萝卜素的96%乙醇提取液最大吸收峰波长分别为665nm、 649nm和470nm,计算公式如下:
Ca=13.95D665-6.88D649
Cb=24.96D649-7.32 D665
Cx.c=(1000D470-2.05Ca-114.8Cb)/ 245
取新鲜的样品,清洗干净,剪碎。称取3份0.2g剪碎的叶片分别放入研钵中研成匀浆,研磨时加入少量石英砂和碳酸钙粉及3ml 96% 乙醇,研磨至变白,放置4min左右过滤到25ml棕色容量瓶中,反复冲洗干净,定容摇匀。
比色测定:96% 乙醇作空白,在波长665nm、649nm和470nm下测定吸光度。根据上述公式分别计算叶绿素a、叶绿素b和类胡萝卜素的浓度。
计算公式:叶绿体色素含量=[色素的浓度C*提取液体积*稀释倍数]/样品鲜重
1.1.3.3 氨基酸含量的测定
氨基酸浓度采用吸收光谱法测定水合三酮苯胺(Ninhydrin)试剂盒(Comin,苏州,中国)。样品溶液(1ml)在1ml醋酸缓冲液(2mmol L−1,pH 5.4)和1ml茚三酮中研磨,在沸水浴中孵育15min,然后在水中冷却。5分钟后,用3ml 60%乙醇稀释上述混合物。用光谱仪在570nm处测定吸光度。
1.1.3.4 可溶性蛋白质含量的测定——考马斯亮蓝法
考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595nm波长下有最大光吸收。其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。蛋白质与考马斯亮蓝G-250结合在2min左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h内保持稳定。
试剂:
(1)牛血清白蛋白标准溶液的配制:准确称取100mg牛血清白蛋白,溶于100mL蒸馏水中,即为1000μg/mL的原液。
(2)考马斯亮蓝G-250蛋白试剂的配制:称取100mg考马斯亮蓝G-250,溶于50mL90%乙醇中,加入85%(W/V)的磷酸100mL,最后用蒸馏水定容到1000mL。此溶液在常温下可放置1个月。
(3)乙醇;
(4)磷酸(85%)。
样品提取液中蛋白质浓度的测定:
(1)待测样品制备:称取样品2g放入研钵中,加2mL蒸馏水研磨成匀浆,转移到离心管中,再用6mL蒸馏水分次洗涤研钵,洗涤液收集于同一离心管中,放置0.5~1h以充分提取,然后在4000r/min离心20min,弃去沉淀,上清液转入10mL容量瓶,并以蒸馏水定容至刻度,即得待测样品提取液。
(2)测定:另取2支10mL具塞试管,按下表取样。吸取提取液0.1mL,放入具塞刻度试管中,加入5mL考马斯亮蓝G-250蛋白试剂,充分混合,放置2min后用1cm光径比色杯在595nm下比色,记录光密度OD595nm,并通过标准曲线查得待测样品提取液中蛋白质的含量X(μg)。
结果计算:
样品蛋白质含量(mg∕g鲜重)=(C×V/a)/W
式中:C为查标准曲线所得每管蛋白质含量(mg);V为提取液总体积(ml);
A为测定所取提取液体积(ml);W为取样量(g)。
1.1.4 全N含量、NO3-和NH4+含量的测定
植株全氮用凯氏定氮法测定(鲍士旦, 2000)。
采用特制试剂盒(Comin, Suzhou, China)测定茎部和根部样品中的NO3-浓度。将植物样品(1 g)转移到10 mL试管中,加入约5 mL的水,然后在沸水浴中孵育30分钟。匀浆冷却后12000 g离心20 min,将上清移入管中,采用水杨酸法测定NO3-含量。
根据制造商指南(Comin, Suzhou, China)使用特定试剂盒测定茎部和根部样品中的NH4+浓度。反应液为滤液0.1 mL, 10%酒石酸钾钠0.01 mL,再蒸馏水2.4 mL,奈斯勒试剂0.1 mL。用分光光度计测定5min后在425 nm处的吸光度。
1.1.5 植株解析样品测定方法
将植株分成根部、茎部和叶片3部分,放入烘箱中于105℃杀青30 min,80℃烘干至恒重,称重,研磨粉碎后过0.25 mm筛,装袋备用。植株全氮用凯氏定氮法测定(鲍士旦, 2000)。15N丰度在中国农业科学院原子能利用研究所用MAT-251质谱仪(美国菲尼根公司)测定。
Ndff (%) = [植物样品中15N丰度(%)–15N自然丰度(%)] / [肥料中15N丰度(%) –15N自然丰度(%)]×100;氮肥分配率(%) = 各器官从氮肥中吸收的氮量(g) /总吸收氮量(g) ×100;器官全氮量(g) = 器官生物量(g) ×氮含量(%);器官15N吸收量(g) = Ndff ×器官全氮量(g);氮肥利用率(%) = 器官15N吸收量(g) / 施肥量(g) ×100。
1.1.6 植株酶活性的测定
1.1.6.1 NR活性的测定
硝酸还原酶催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐可以与对氨基苯磺酸(对-氨基苯磺酰胺)及α-萘胺(萘基乙烯二胺)在酸性条件下生成红色偶氮化合物,生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。硝酸还原酶活性可以由产生的亚硝态氮的量表示。NR活性参照Savidov 和 Lips(1997)的测定方法进行改进。
标准曲线的制作:取7支干净烘干的15ml刻度试管,依次编号1、2、3、4、5、6和7,分别按顺序加入亚硝酸钠标准液0、0.2、0.4、0.8、1.2、1.6和2.0ml,蒸馏水2.0、1.8、1.6、1.2、0.8、0.4、0ml,再分别向各试管中按顺序加入4ml 1% 对-氨基苯磺酸、4ml 0.2% α-萘胺。摇匀,把各试管放在30℃保温箱中保温30min,然后在540nm波长下比色,根据结果绘制标准曲线,横坐标是亚硝态氮(μg)含量,纵坐标是吸光度。
将葡萄幼苗的根、茎和叶片清洗干净后,每个样品称取1.0g,放在研钵里研磨,参照 Pinto等(2014)的方法用6 mL的提取缓冲液提取,4°C,8000 g离心5 min,获取上清液放入试管中并编号,用于测定NR活性。向各试管中加入KNO3-异丙醇-磷酸缓冲液混合液9ml,其中一管立即加1.0ml三氯乙酸混匀作对照。然后将所有试管置真空干燥器中接真空泵抽气,反复几次直至叶片沉在管底。将各试管置30℃下黑暗处保温30min,分别向处理管加1.0ml三氯乙酸,摇匀终止酶活性。最后将各试管静置2min,吸取上清液2ml加入另一组试管,以对照管做参比,按标准曲线做法进行显色测定,并计算酶活性。
计算公式:样品中酶活性(μg/g.FW.h)=[C*V1/V2]/[W*t]
C—反应液催化产生的亚硝态氮总量(μg)
V1—提取酶液时加入的缓冲液体积(ml)
V2—酶反应时加入的粗酶液体积(ml)
W—样品重量(g)
t—反应时间(h)
1.1.6.2 亚硝酸还原酶活性的测定
亚硝酸还原酶活性参照Rao 等(1981)和Ozawa 和 Kawahigashi(2006)的方法测定。反应混合液包含1 mL 0.1 M 磷酸缓冲液(pH 7.5),0.05mL10 mM KNO2,0.05 mL 15 mg mL−1 甲基紫晶,0.2 mL 粗酶液和50 mg mL−1 溶解在100 mM NaHCO3的 连二亚硫酸钠(Na2S2O4)。此混合液在25℃下保温半小时直至甲基紫晶的颜色消失。反应剩余的NO2−的量用下述方法测定:0.2 mL上述反应剩余液,6.5mL的水,1.8mL 10% (w/v)磺胺(溶于浓HCl中),1.5 mL1%(w/v) 萘乙二胺。摇匀后在30℃下黑暗保温30min,然后在540nm波长下比色。
1.1.6.3 谷氨酰胺合成酶活性的测定
GS活性测定参照赵世杰等(2002)主编的《植物生理实验指导》。
谷氨酰胺合成酶(GS)是植物体内氨同化的关键酶之一,在ATP和Mg2+存在下,它催化植物体内谷氨酸形成谷氨酰胺。在反应体系中,谷氨酰胺转化为γ-谷氨酰基异羟肟酸,进而在酸性条件下与Fe形成红色的络合物,该络合物在540nm处有最大吸收峰,可用分光光度计测定。
提取缓冲液:
0.05mol/LTris-HCl,pH8.0,内含2mmol/LMg,2mmol/L DTT,0.4mol/L蔗糖。称取Tris(三羟甲基氨基甲烷)1.5295g,0.1245g MgSO4·7H2O,0.1543g DTT(二硫苏糖醇)和34.25g蔗糖,去离子水溶解后,用0.05 mol/L HCl调至pH8.0,最后定容至250ml;
反应混合液A(0.1mol/L Tris-HCl缓冲,pH7.4):
内含80mmol/L Mg,20mmol/L谷氨酸钠盐,20mmol/L半胱氨酸和2mmol/L EGTA,称取3.0590g Tris,4.9795 gMgSO4·7H2O,0.8628g谷氨酸钠盐,0.6057g半胱氨酸,0.1920gEGTA,去离子水溶解后,用0.1mol/L HCl调至pH7.4,定容至250ml;
反应混合液B(含盐酸羟胺,pH7.4):
反应混合液A的成分再加入80mol/L盐酸羟胺,pH7.4;
显色剂(0.2mol/L TCA,0.37mol/L FeCl3和0.6mol/L HCl混合液):3.3176g TCA(三氯乙酸),10.1021g FeCl3·6H2O,去离子水溶解后,加5ml浓盐酸,定容至100ml; 40mmol/L ATP溶液:0.1210g ATP溶于5ml去离子水中(临用前配制)。
测定方法如下:
(1)粗酶液提取 称取植物材料1g于研钵中,加3ml提取缓冲液,置冰浴上研磨匀浆,转移于离心管中,4℃下15,000g离心20min,上清液即为粗酶液。
反应1.6ml反应混合液B,加入0.7ml粗酶液和0.7ml ATP溶液,混匀,于37℃下保温半小时,加入显色剂1ml,摇匀并放置片刻后,于5,000g下离心10min,取上清液测定540nm处的吸光值,以加入1.6ml反应混合液A的为对照。
(2)粗酶液中可溶性蛋白质测定 取粗酶液0.5ml,用水定容至100ml,取2ml 用考马斯亮蓝G-250测定可溶性蛋白质。
(3)结果计算:
GS活力(A·mg-1protein·h-1)=A
/(P×V×t)式中 A—540nm处的吸光值;
P—粗酶液中可溶性蛋白含量(mg/ml);V—反应体系中加入的粗酶液体积(ml); T—反应时间(h)。
1.1.6.4 NADH-GOGAT活性测定
NADH-GOGAT活性测定参照Singh和Srivastava(1986)以每min每mg反应混合液于30℃减少1 μmol的NADH为一个酶活单位,用μmol·h-1·g-1表示。提取液:0.2 M磷酸缓冲液(pH 7.5),2 mM EDTA,0.5%(v/v)Triton X-100,0.1%(v/v)巯基乙醇,和50 mM KCl.
然后在10,000 g 4℃离心20min,弃去沉淀,得到上清液。反应液:25 mM磷酸缓冲液(pH 7.3),酶提取液(0.3 mL),1 mM EDTA,5 mM 2-酮戊二酸,100 mM KCl, 20 mM l-谷氨酰胺,和1 mM NADH。在340nm下比色,测定消光值得变化。
1.1.7 总RNA的提取、反转录
将冻存的样品在液氮中迅速研磨成粉,取100mg组织样,用TIANGEN生产的RNAprep Pure多糖多酚植物总RNA提取试剂盒法提取样品的总RNA。从各器官提取的RNA各取2µL进行1.0% 琼脂糖凝胶电泳检测,使用大连宝生物公司DL 2000 DNA Marker 估测目的条带大小。cDNA第一链的合成参照试剂盒Primer ScriptTM RT Reagent Kit With gDNA Eraser(Takara)说明书。
1.1.8 实时荧光定量PCR 分析(qRT-PCR)
根据MOT1的cDNA序列设计荧光定量特异引物(表2-1),同时选用葡萄Ac t i n 基因为内参基因,并设计定量PCR引物FaMOT1-F和FaMOT1-R(表2-1)。使用大连宝生物公司SYBR Premix ExTaq(TaKaRa Biotechnology)试剂盒进行实时荧光定量,qRT-PCR 反应体系为25μL:SYBR Premix Ex Taq 12.5μL,上、下游引物各1.0 μL,模板2.0 μL,加去离子水至25 μL。每次试验设置3次技术重复。荧光定量PCR 反应程序为:95 °C预变性30 s,95 °C变性5 s,60 °C退火30 s,40 次循环,所有PCR 反应都设3 次生物学重复和3次技术重复。使用SYBR Green法在Bio-RAD CFX connect实时荧光定量PCR仪上进行RT-qPCR实验,试验结果用2-ΔΔCT 法对数据进行定量分析。
1.1.9 数据处理
试验数据采用SPSS18.0 软件进行单因素方差分析,LSD 法进行差异显著性检验,应用Microsoft Excel 2003和Graphpad Prism 5绘制图表。
1.2 结果与分析
1.2.1 钼对不同氮源下植株生长、干重、根系构型和根系活力的影响
如图1所示,不同氮源条件下,生长在含Mo的培养液条件下植株长势优于不含Mo的培养液条件下的葡萄植株。

如表1所示,在不同施氮形式中,NH4NO3的植株干重最高,而NH4+的植株干重最低。在NO3-、NH4NO3和NH4+处理下,施用钼使葡萄幼苗的茎部干重分别提高了10.40%、15.73%和9.94%,根系干重分别提高了16.43%、34.84%和15.88%。与不施钼处理相比,施用钼显著提高了植株干重。

如表2所示,不同氮源条件下,施用NH4NO3导致根系结构参数和根系活性最高,而单独施用NH4+导致根系结构参数和根系活性最低。Mo处理显著增加了葡萄幼苗的根长、根体积、根表面积、根分叉、根尖和根系活力。同时,-Mo和+Mo处理的平均根径差异不显著。与-Mo相比,在NO3-、NH4NO3和NH4+源下,Mo处理的根系活力分别提高了28.97%、32.92%和25.92%。
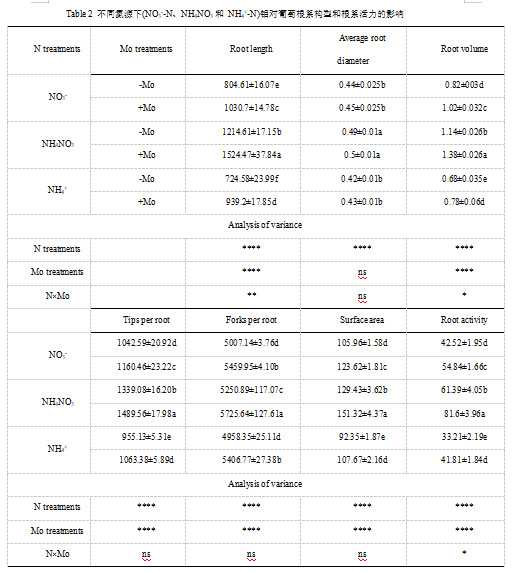
1.2.2 钼对不同氮源下植株钼浓度、叶绿素含量、氨基酸含量和可溶性蛋白含量的影响
氮肥处理下,施钼显著提高了葡萄幼苗地上部和根部的钼浓度。NH4NO3处理下,葡萄幼苗根部的钼浓度明显高于单独施用NO3-或NH4+处理。但不同氮源下,不施用钼的葡萄幼苗地上部和根部的钼浓度差异不显著(表3)。
在NH4NO3处理下,-Mo和+Mo处理的葡萄幼苗叶绿素(a+b)含量最高(表3)。与-Mo处理相比,施用Mo提高了NO3-和NH4NO3源下的叶绿素(a+b)含量,但叶绿素b含量和叶绿素a/b比值没有差异(数据未显示)。
以NH4NO3为氮源的幼苗氨基酸含量最高,与葡萄藤幼苗根、芽中可溶性蛋白含量一致(表3)。
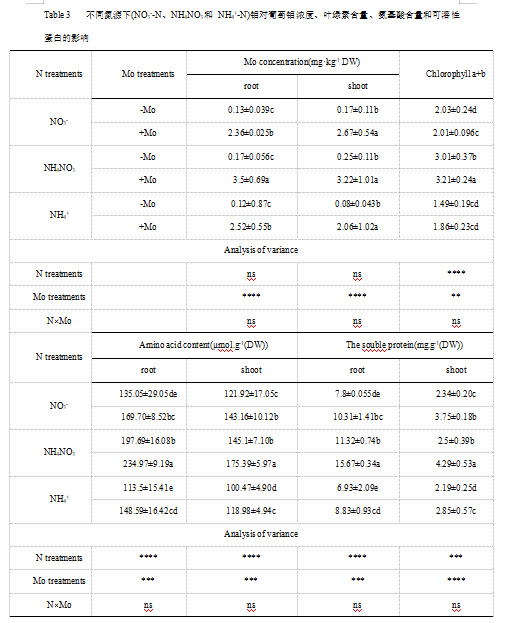
1.2.3 钼对不同氮源下植株全N、NO3-和NH4+含量的影响
如表4所示,不同供氮处理的幼苗根系氮含量差异显著,NH4NO3处理的幼苗枝条氮含量高于NO3-和NH4+处理。钼增加了葡萄幼苗茎部和根部的总氮含量。添加钼后,NH4NO3处理的总氮含量最高。分析了根部和茎部的NO3-浓度。与单独使用NH4+相比,单独使用NO3-和共施用NH4NO3时,Mo的供应明显降低了NO3-的含量。
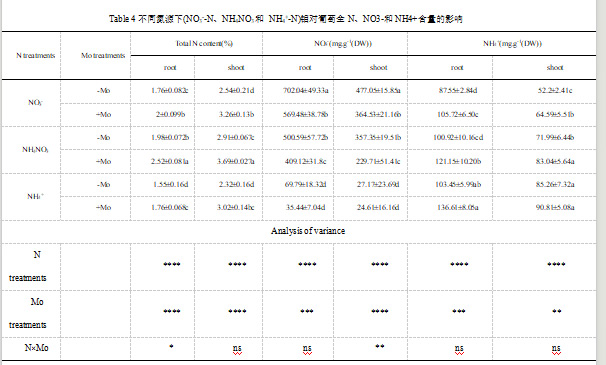
1.2.4 施用钼提高了不同氮源下葡萄幼苗氮素吸收和氮肥利用效率
15N标记试验表明,在NH4NO3条件下,施用Mo后,茎和根对15N的吸收量最高(表5),说明NO3-与NH4+共施时Mo与N具有互补效应。NH4NO3混合处理下,Mo处理的15NUE最高。在NO3-、NH4NO3和NH4+源下,施用Mo可使幼苗15NUE分别提高38.54%、49.26%和26.38%(表5)。
1.2.5 钼对氮素代谢酶活性及VvMOT1和VvNRT1.1基因表达的影响
在NO3-和NH4NO3源下,葡萄幼苗根和芽中NR活性均较高(表6);而在仅以NH4+为氮源的葡萄幼苗中,+Mo和-Mo处理之间没有差异(表6)。同时,Mo培养的葡萄幼苗叶片和根系的NiR活性高于未Mo,特别是在NH4NO3存在的情况下(表6)。
施钼显著提高了NH4NO3源下葡萄幼苗根系GS活性(表6)。同时,施钼的葡萄幼苗在所有源下的茎部GS活性均显著高于未施钼的葡萄幼苗(表6)。葡萄幼苗NADH-GOGAT活性也有类似的变化趋势(表6)。
在氮源存在的情况下,Mo的应用上调了芽和根中VvMOT1基因的表达(图2、A和B),表明Mo在激活VvMOT1转录物中的作用。在Mo处理下,当N源为NH4NO3时,VvMOT1在根和芽中的表达量均达到最大值(图2、a、B);VvMOT1表达量与Mo浓度一致。同时,施钼和不同形态的氮素影响了VvNRT1.1的转录水平(图2、C和D)。施钼显著提高了氮素处理下葡萄幼苗根和芽中VvNRT1.1的表达。

1.3 结论
在葡萄幼苗中,氮素形态和钼的施用对干重、根系构型和活性有显著影响。施钼可提高组织Mo水平,确保有足够的Mo用于氮的同化。此外,氮素形态和钼的施用对叶绿素含量、氨基酸含量和可溶性蛋白质含量也有影响。Mo诱导了VvMOT1和NRT1.1的表达,保证了Mo和N的充分吸收。氮同化相关酶(NR、NiR、GS和NADH-GOGAT)活性指数升高,降低了组织NO3-含量,提高了NH4+含量。随着氮同化相关酶(NR、NiR、GS和NADH-GOGAT)活性的提高,组织NO3-含量降低,NH4+含量增加,表明NH4NO3和Mo的供应改善了氮素的吸收和同化。不同氮源下施用钼后,氮素吸收和氮素利用率均有所提高,表现出钼和氮的协同效应。这表明硝态氮营养下钼对葡萄氮素吸收、利用的促进作用大于单一铵态氮,尤其在NO3-和NH4+都存在的条件下,钼表现出更好的协同作用。这为生产上葡萄育种工作提供了氮肥高效吸收利用的农艺措施。