豫东综合试验站
吕中伟 尚泓泉 崔小月 娄玉穗 张柯 樊红杰 吴文莹
核因子Y(nuclear factor Y, NF-Y)又称亚铁血红素活化蛋白(heme activator protein, HAP)或CCAAT顺式作用元件结合因子(CCAAT-binding factor, CBF),通常由3个不同的亚基组成,包括NF-YA(CBF-B或HAP2)、NF-YB(CBF-A或HAP3)和NF-YC(CBF-C或HAP5)。NF-YA、NF-YB和NF-YC组成的异源三聚体复合物通常位于细胞核中,通过结合靶基因启动子的CCAAT-box元件或与其他转录因子相互作用来激活或抑制靶基因的表达而发挥作用。NF-YB3在调控植物生长发育、响应多种激素和胁迫反应中发挥重要作用。NF-YB3可作为生长调节剂促进种子萌发、加速开花、促进生长;响应多种植物激素和干旱、盐、高温、低温等非生物胁迫;调控光合速率和气孔导度;调控JA介导的免疫反应等。前人从欧洲葡萄中鉴定得到34个NF-Y基因,其中NF-YB基因有18个,经过对NF-Y基因的进化、结构和表达模式分析推测NF-Y基因可能在应激反应、发育和糖代谢中发挥作用。本研究利用PCR克隆技术从欧洲葡萄无核白中获得VvNF-YB3基因序列,并对其进行了综合的生物信息学分析,此外还分析了VvNF-YB3基因的组织特异性和不同胁迫下的表达趋势,为今后研究其在葡萄生长发育和响应非生物胁迫过程中的生物学功能奠定基础。
1 材料与方法
1.1 基因克隆和序列分析
使用植物RNA提取试剂盒(OMEGA R6827)从无核白葡萄叶片中提取总RNA,经紫外分光光度计检测RNA的质量,选择检测结果良好的RNA,按照反转录试剂盒(天根KR116)说明书将其反转录为cDNA,稀释到质量浓度为100 ng/μL后作为基因克隆的模板。根据欧洲葡萄NF-YB3基因(Vitvi10g00251)序列设计引物(表1),通过同源克隆的方法获得VvNF-YB3基因,并送至河南尚亚生物技术有限公司进行测序。经EnsemblPlants预测VvNF-YB3基因在染色体上的位置,SMART用于分析VvNF-YB3蛋白的保守结构域,氨基酸多序列比对分析利用ClustalX2进行,利用MEGA6构建系统进化树,采用最大似然法(Maximum Likelihood),Bootstrap重复1000次,各在线工具网址如表2所示。
1.2 生物信息学分析
利用在线网站ProtParam对葡萄NF-YB3基因编码蛋白质的氨基酸数目、分子量、等电点、不稳定指数、脂溶指数、总平均疏水指数等理化性质进行分析。通过在线软件GSDS 2.0分析VvNF-YB3的基因结构。VvNF-YB3蛋白的二级结构利用在线网站SOPMA分析,三级结构使用在线软件SWISS-MODEL预测。
1.3 启动子顺式作用元件分析
将欧洲葡萄NF-YB3基因起始密码子上游2 000 bp的序列提交至PlantCARE用于启动子顺式作用元件分析,通过网站GSDS 2.0将结果进行可视化。
1.4 表达模式分析
供试材料红地球葡萄为10年生成龄树,生长于河南现代农业研究开发基地葡萄示范园,2023年5月25日采集其成熟叶、幼叶、卷须、花、幼果和茎用于组织特异性分析。长势一致且生长健壮的红地球葡萄叶片(从新梢顶部开始的第3和第4叶)用冰盒带回实验室,用湿棉花包裹叶柄,置于放有湿滤纸的托盘上,分别对叶片进行喷施10% PEG6000和4 ℃低温、40 ℃高温处理,并于处理的0、2、4、8、12、24 h取样,每个处理设置3次生物学重复。在液氮中迅速研磨样品,RNA提取和cDNA第一条链的合成同1.1所述,将cDNA稀释到质量浓度为100 ng/μL后用作实时荧光定量PCR的模板。使用NCBI设计基因的特异性qRT-PCR引物,内参基因为VvActin7(Accession no. XM_002282480),引物序列如表1所示。qRT-PCR的反应体系和程序参照前人的方法[22],基因相对表达量采用2-ΔΔCT法进行分析,误差线代表3次生物学重复的标准误差(±SE)。显著性分析使用SPSS 23.0,采用图基检验进行单因素方差分析(P <0.05)。
1.5 互作蛋白的预测
VvNF-YB3的互作蛋白经STRING进行预测,利用SMART分析候选互作蛋白的保守结构域,利用PlantRegMap数据库鉴定VvNF-YB3上游可能存在的转录因子,利用软件Cytoscape将结果进行可视化。
2 结果与分析
2.1 VvNF-YB3基因克隆与序列分析
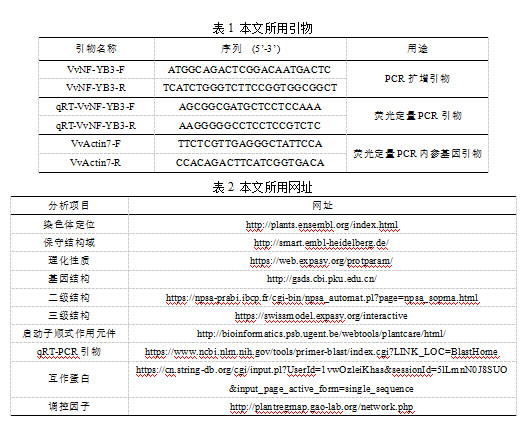
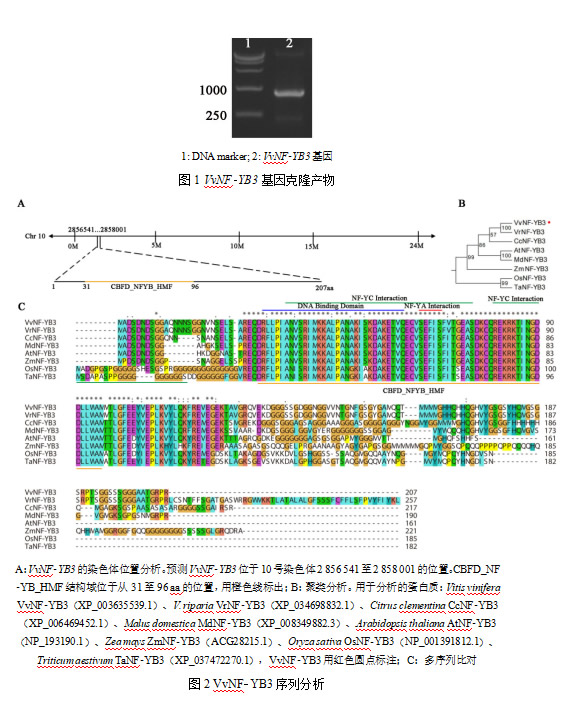
根据欧洲葡萄(黑比诺)NF-YB3基因序列设计引物,以无核白葡萄叶片cDNA为模板,通过同源克隆的方法得到VvNF-YB3基因,与黑比诺葡萄NF-YB3基因序列完全相同,CDS全长624 bp(图1),编码207个氨基酸。经葡萄基因组网站预测分析,VvNF-YB3定位在10号染色体上(图2A),基因全长1 461 bp。VvNF-YB3中存在1个典型的CBFD_NFYB_HMF结构域(residues 31-96 aa)(图2A,C)。聚类分析显示VvNF-YB3与河岸葡萄中同源基因的相似度最高,其次是柑橘,与水稻和小麦中的同源基因亲缘关系最远(图2B)。对多个物种的NF-YB3进行氨基酸序列比对,VvNF-YB3包含NF-YB3的3个保守结构域,分别是DNA结合域、NF-YA结合域和NF-YC结合域(图2C)。
2.2 VvNFYB3结构分析
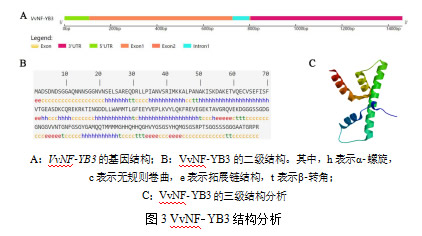
基因结构分析显示,VvNFYB3基因含有2个外显子、1个内含子,并且含有106 bp的5'UTR和658 bp的3'UTR(图3A)。理化性质分析结果显示,VvNFYB3蛋白分子式为C919H1459N285O314S12,原子总数2 989,分子量21 909.14。其理论等电点6.31,不稳定指数27.66,总平均疏水指数-0.738,为一酸性、稳定的亲水蛋白。VvNFYB3的二级结构主要是由α螺旋(41.55%)和无规则卷曲(40.10%)组成,拓展链结构(10.63%)和β转角(7.73%)占比较小(图3B)。相应的,VvNFYB3的三级结构为螺旋卷曲螺旋,且为单体(图3C)。
2.3 VvNFYB3基因启动子顺式作用元件分析
为了更好地了解VvNFYB3基因的转录调控和潜在功能,分析了其起始密码子上游2 000 bp的序列中含有的顺式作用元件。由图4可知,除了CAAT和TATA框外,VvNFYB3基因启动子中出现频率最高的是光响应元件(9个),其次是MYB结合元件(5个)。VvNFYB3基因启动子中还包含应激响应元件STRE和抗病相关元件W box。此外,还存在大量的激素响应元件,主要包括茉莉酸甲酯响应元件(TGACGmotif和CGTCAmotif)、赤霉素响应元件(TATCbox)、脱落酸响应元件(ABRE)和乙烯响应元件(ERE)。由此推测VvNFYB3基因可能响应胁迫和多种植物激素。

2.4 不同组织和处理下VvNFYB3基因的表达模式
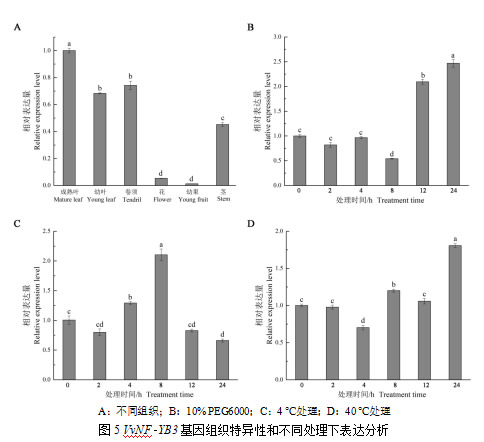
分析了VvNFYB3基因在欧洲葡萄品种红地球的不同组织中的表达量发现,叶片、卷须和茎中VvNFYB3基因的表达较高,在成熟叶中表达量最高,花和幼果中VvNFYB3基因的的表达量较低,在幼果中表达量最低(图5A)。10% PEG6000处理8 h后,VvNFYB3基因表达下调,之后呈上调趋势(图5B)。低温处理时VvNFYB3基因的表达量呈先上升后下降的趋势,在处理8 h时达到峰值,约为处理前的2.2倍(图5C)。高温处理也可改变VvNFYB3基因的表达量,40 ℃处理4 h时VvNFYB3基因的表达量显著低于处理前,处理8 h和24 h时表达量显著高于处理前(图5D)。由以上结果可知,VvNFYB3基因为一组成型表达基因,可响应PEG模拟的干旱、低温和高温胁迫,为一胁迫响应基因。
2.5 NFYB3互作蛋白分析
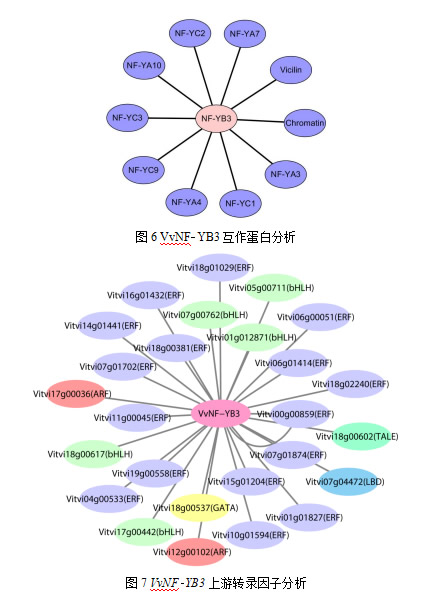
经预测,VvNFYB3的互作蛋白大多是核因子Y家族的亚基,包括NFYA和NFYC的几个成员。此外,Vicilin类贮藏蛋白和染色质易接近性复合蛋白Chromatin均含有1个CBFD_NFYB_HMF结构域,也可能和NFYB3存在互作关系(图6)。VvNFYB3的上游可能存在27个转录因子,主要包括ERF、bHLH、ARF等,其中ERF最多,有17个(图7),此外,转录因子TALE、LBD、GATA也可能调控VvNFYB3基因的表达。
3 结论
综上,本研究通过同源克隆的方法从无核白葡萄中分离得到了VvNFYB3基因,CDS全长624 bp,编码一个酸性、稳定的亲水蛋白。氨基酸序列与河岸葡萄、柑橘的同源物具有较高的相似性,均具有典型的CBFD_NFYB_HMF结构域。VvNFYB3基因在葡萄的成熟叶、幼叶、卷须、花、幼果和茎中均表达,且受到干旱、低温和高温胁迫的诱导。VvNFYB3的互作蛋白主要是NFYA和NFYC,均含有CBFD_NFYB_HMF结构域。VvNFYB3基因上游存在一些调控因子,可能与启动子中的顺式作用元件结合发挥作用。本研究为进一步深入研究葡萄NFYB3基因的功能和葡萄抗逆反应机制奠定了基础。