制汁葡萄品种改良岗位
郭印山 林洪 姜长岳
葡萄灰霉病是葡萄生产中面临的一种危害性极强的病害,其侵染能力广泛,能够对葡萄的不同部位造成不同程度的损害,这一病害严重影响了葡萄果实的品质和产量,对葡萄产业带来了重大的经济损失。目前化学防治被视作为灰霉病的主要防治措施,但经济成本高的同时易污染环境以及对人体的健康存在潜在危害。近年来,随着植物分子生物学的迅速发展,抗病育种也成为众多学者的研究目标,然而关于葡萄灰霉病抗性的调控机理仍不明确,因此,挖掘葡萄抗灰霉病关键基因,探究抗病调控机理对葡萄抗病分子育种具有重要的意义。
在葡萄的生长发育以及对逆境胁迫的抵抗过程中,转录因子都发挥了重要的作用。本团队前期以抗灰霉病品种‘贝达’以及感灰霉病品种‘红地球’为材料,进行不同时间的灰霉病原菌侵染条件下的RNA-seq测序,本研究通过对几个与抗性相关的转录因子家族进行分析,发现两个转录因子VlMYB74以及VlWRKY48在不同材料中有着显著的差异表达,推测其可能与葡萄灰霉病抗性相关。以‘贝达’和‘红地球’为试验材料,通过同源克隆得到VlMYB74和VlWRKY48两个基因,对VlMYB74以及VlWRKY48进行序列和表达分析,为后续开展葡萄VlMYB74以及VlWRKY48基因的抗病功能研究提供理论及实验依据。
1 材料与方法
1.1 试验材料
本试验选用美洲种与河岸杂交品种‘贝达’(Beta)与欧亚品种‘红地球’(Red Globe)为试验材料,使用灰霉病原菌的孢子悬浮液进行侵染,孢子浓度为1×107个/mL,试验重复三次,液氮速冻后保存在-80 °C冰箱中,用于qPCR分析。‘贝达’以及‘红地球’的根、茎、叶片、卷须、花序、果实均取自于沈阳农业大学葡萄资源圃。烟草种植于人工气候室,设置环境温度为25℃。
1.2 方法
1.2.1葡萄灰霉菌的培养和悬浮液配置
由于葡萄灰霉病病原菌在PDA培养基(马铃薯葡萄糖琼脂)上生长良好,故本研究选用此培养基。
(1)PDA培养基的配置过程
挑选新鲜未发芽的健康马铃薯,削皮后清洗干净,称取100g洗净后切块备用,锅中加入500mL蒸馏水与马铃薯一同煮沸,沸腾后计时30min,中途不停用玻璃棒搅拌防止马铃薯产生的淀粉糊底,然后趁热用双层纱布进行过滤,注意不要把滤渣过滤到容器中,过滤后的溶液加入葡萄糖以及琼脂粉10g,玻璃棒搅拌混合均匀后蒸馏水定容到500mL。
(2)灭菌及接菌
经过121℃高压蒸汽灭菌20分钟后,将培养基冷却至室温并倒入无菌培养皿。在超净工作台中,用无菌接菌针取灰霉病原菌,放至PDA培养基中央,轻盖培养皿并用封口膜密封,避免晃动导致菌丝脱落。随后将培养皿放入培养箱,设定22℃、80%湿度、避光条件进行培养。全程确保无菌操作,以优化灰霉病原菌生长环境。
(3)灰霉菌孢子悬浮液的配制方法
侵染成败的关键因素之一是灰霉菌孢子悬浮液的浓度,将发育完好的灰霉菌培养基加入一定量的ddH2O浸湿后,使用无菌涂布器将菌丝刮下,刮下来的溶液用双层纱布过滤后得到灰霉菌孢子悬浮液,在血球计数板上下各滴30μL,使用万能电子显微镜统计孢子数目,参考前人及相关学者的研究,本试验最终采用浓度为1×107/mL的灰霉菌孢子悬浮液,使用时现用现配。
1.2.2 葡萄灰霉病的抗病性鉴定
在生长旺季,采集当年生供试单株上叶龄大概为15d左右的叶片,判断依据是新梢顶端自上而下的第4~5片叶。采集无病斑虫害的健康叶片后,挑选两个品种的葡萄,各取3片健康、长势相近的叶片,进行灰霉菌侵染试验,试验重复三次。步骤如下:先用蒸馏水清洗叶片,去除表面的灰尘和虫卵,再用滤纸吸去多余水分,然后平整地放入自封袋中密封,并用记号笔注明材料名称,迅速放入冰盒带回实验室,双层滤纸铺于150mm培养皿中,蒸馏水浸湿到不会滴水的程度。采用五针刺伤法进行接种,在叶片正面左右各自对称的位置接种已经制备好的灰霉菌孢子悬浮液(避开主叶脉),然后将棉球润湿包在叶片根部防止失水。接种完成后放在人工智能气候培养箱中(MLR-352H-PC,Panasonic)进行培养,设置条件为:温度22℃、相对湿度85%、12h光照、12h黑暗。运用智能叶面积测量仪(YMJ-C)对灰霉病侵染后的葡萄叶片进行面积统计,具体时间点为培养后的0小时、72小时和120小时,统计内容涵盖病斑的平均面积及整体叶面积。
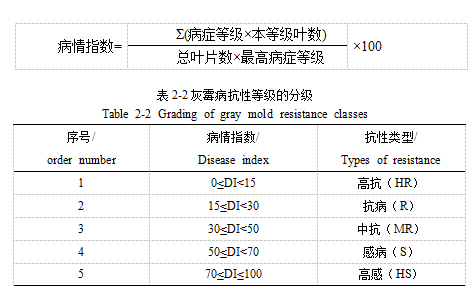
对于灰霉病抗性的评价,我们采用了基于病情严重度(DS)的分级系统。具体来说,当DS值在0%至20%之间时,定义为1级;DS值在20%至25.5%之间时,为2级;DS值在25.5%至36%之间时,为3级;DS值在36%至46.5%之间时,为4级;DS值在46.5%至57%之间时,为5级;DS值在57%至74.5%之间时,为6级;而当DS值超过74.5%时,则被划分为7级。
为了更直观地评估病情,我们将这些病症等级转化为病情指数(DI)。最后,基于DI的计算结果,我们可以将灰霉病的抗性表型数据细分为五种不同的抗性类型,从而实现对葡萄叶片灰霉病抗性的全面评估。
病症等级和病情指数的转化计算公式:
1.2.3 基于转录组数据筛选抗性相关候选基因
(1)RNA提取
使用改良后的CTAB法提取灰霉病原菌侵染后0h、72h、120h的葡萄叶片总RNA,具体步骤如下:
a.提前将水浴锅调至65℃,预热CTAB;
b.研钵用75%无水乙醇进行消毒,液氮预冷后加入0.1g葡萄叶片和少许PVP,研磨过程中一直保持低温直至将样品磨成细粉末;
c.在无酶无菌的离心管中加入685 μl 预热的CTAB 以及 15 μl β-巯基乙醇,将上一步磨好的样品迅速加到离心管中,65℃水浴锅中加热20min,期间每5min上下翻转4~5次使细胞得到充分裂解,预冷离心机;
d.水浴结束后加入等量体积的氯仿,反复颠倒混合液5min,使之混合充分,离心机4℃,12000 rpm,离心 10 min;
e.离心结束后,取出离心管,此时观察到混合液分层,吸上清液至新离心管,加入等量氯仿,后续步骤同d;
f.离心结束后取上清加入1/4体积1M LiCl(DEPC 水配制)混合均匀,-20°C 冰箱过夜静置。
g.静置好的混合液离心机4℃,12000 rpm,离心 20 min,小心吸取上清尽量避免碰到沉淀;
h.75%无水乙醇洗涤沉淀(DEPC水配置),离心机4℃,12000 rpm,离心 5 min,此步骤重复两次;
i.吸除上清后在通风橱将沉淀吹干,根据情况加入适量体积的DEPC水溶解沉淀。(步骤g~i尽量在冰盒上操作)。
(2)RNA的检测
检测RNA的浓度使用超微量紫外分光光度计,凝胶电泳检测RNA条带的完整性,质量好的RNA样品保存于80°C冰箱。
(3)cDNA单链的合成
采用Vazyme反转录试剂盒进行RNA的反转,第一步反应为去除DNA,反应体系如下:

上述反应体系中,模板RNA的总量为1000 ng,在无酶无菌离心管中配制上述混合液,混匀后在42℃的PCR仪中反应2 min。反应结束后加入4µl 5 × HiScript III qRT SuperMix,再次混匀,在37ºC PCR仪中反应15 min;85ºC 5 s,。将反应后获得的cDNA保存于-20ºC 冰箱中。
(4)实时荧光定量PCR
将反转录生成的cDNA稀释10倍,以便进行后续分析。为了测定基因的相对表达量,我们采用了QuantStudioTM 6 Flex实时荧光定量PCR仪。该仪器利用实时荧光定量技术,精确测量PCR产物的数量,从而评估基因的相对表达水平。为了计算基因的相对表达量,我们采用了2-△△Ct算法。
2 结果与分析
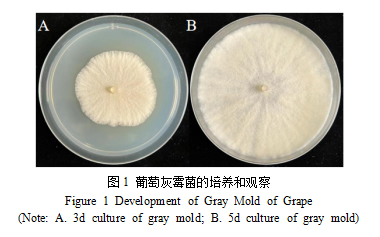
2.1 灰霉病菌的培养
经过对灰霉菌的培养情况观察,如图2-1所示,我们可以清晰地看到,在培养的第3天,A图展示了灰霉菌菌落的初步形态,而从第5天的B图中则可以观察到,灰霉菌菌落已从中心向四周均匀扩展。整个培养过程中,未见有其他杂菌的污染,这充分满足了后续试验对灰霉菌菌落纯净度的严格要求。通过对菌落生长情况的细致分析,我们可以确认灰霉菌的培养状态良好,为后续的实验研究提供了可靠的材料基础。
2.2 两个葡萄品种的灰霉病抗性鉴定
本试验选用美洲种和河岸杂交品种‘贝达’(Beta)与欧亚品种‘红地球’(Red Globe)在实验中,我们采用了灰霉菌孢子悬浮液,对两个不同品种的葡萄离体叶片进行了接种处理,以评估它们的抗病性。经过一定时间的观察和记录,我们得到了如图2-2所示的抗病性鉴定结果。结果显示在灰霉菌侵染的两个品种中有较为显著的表型差异,从侵染过程中的病斑面积可以看出,‘贝达’的发病面积要远小于‘红地球’的发病面积,其中‘贝达’叶片的平均病斑面积为423.97mm2,病情指数为17.0属于抗病品种。‘红地球’叶片的平均病斑面积为913.73mm2,病情指数为55.0属于感病品种。表明葡萄品种‘贝达’相较于‘红地球’对灰霉病有着更强的抗性,推测贝达葡萄中存在抗病关键基因。

2.3 基于转录组分析和筛选抗灰霉病候选基因
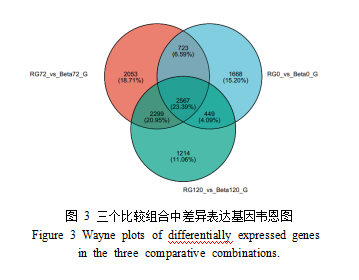
为了寻找与灰霉病抗性相关的基因,分别在灰霉菌侵染‘红地球’和‘贝达’两个品种的0h、72h、120h 进行了RNA-seq检测,在3个比较组合中(RG0vsBeta0、RG72vsBeta72、RG120vsBeta120),分别有5407、7642、6529个差异表达基因。抗病基因的筛选依据是根据在灰霉病原菌侵染的0h、72h和120h都表现出上调,基于课题组前期转录组结果筛选了几个跟抗病有关的基因家族如WRKY、MYB、NAC、ERF等。
为了更清晰地了解不同抗性葡萄在灰霉菌侵染过程中的基因表达差异,使用R软件绘制了三个比较组合中的差异基因韦恩图。如图2-3所示,这三个组合中各有特殊的基因表达,共有2567个基因在所有组合中均特异表达。值得注意的是,抗病品种‘贝达’在不同侵染阶段的差异基因表达量显著少于感病品种‘红地球’,暗示灰霉病菌对感病品种的代谢过程可能产生更为深远的影响。
2.4 候选抗病基因的qRT-PCR验证
我们对‘红地球’和‘贝达’的感病叶片在灰霉菌侵染后的0h、72h、120h进行了取样,并利用反转录后的cDNA作为qRT-PCR的模板。本研究选取葡萄β-Actin基因为内参,结合转录组数据,筛选了与抗性相关的典型转录因子家族中的差异基因。随后,对这些可能与葡萄抗灰霉病相关的差异表达基因进行了qRT-PCR分析,这些基因分别为:VlEDR2(Vitvi02g00982)、VlERF39(Vitvi00g00859)、VlERF92(Vitvi07g02065)、VlWRKY2(Vitvi04g01163)、VlWRKY48(Vitvi06g01574)、VlMYB74(Vitvi10g00345)、VlMYBPA4(Vitvi11g00098)、VlNAC92(Vitvi17g00316)、VlNAC42(Vitvi19g02273)、VlGT-2(Vitvi10g00254)结果如图4-3所示。
分析上述基因在不同侵染时期和不同葡萄品种中的相对表达量后,我们发现,在‘红地球’葡萄中,NAC42、NAV92、MYB74、EDR2和EDR2-1这五个基因的表达趋势均为先上升后下降。从图中可明显看出,在灰霉菌侵染的0h、72h、120h三个阶段,NAC42、NAC92和MYB74与‘红地球’的表达模式保持一致。而EDR2基因在72h时的表达量有所下降,但在120h时又显著回升至初始水平的2.8倍。与之相对的是,在‘贝达’葡萄中,EDR2-1基因的相对表达量则随着侵染时间的延长而持续上升,呈现出一种不断增强的趋势,这在灰霉菌侵染的三个时期中表现得尤为明显。
而ERF39、ERF92、WRKY48这三个基因的表达量在‘红地球’中的表达趋势均呈现持续下降,其中基因ERF39的表达量随着灰霉菌侵染时间的增加而降低,且在灰霉菌侵染的72h和120h表达量都低于‘红地球’。基因WRKY48在‘贝达’中随着灰霉菌的侵染表达量提高。
基因WRKY2和基因MYBPA4在灰霉菌侵染72h均表现出下调趋势,但在侵染120h时,又上调至原有水平,但基因WRKY2的表达量在灰霉菌侵染72h和120h时无明显差异,基因MYBPA4在‘贝达’中的表达水平表现出持续下降。基因在灰霉菌侵染初期(0h),GT-2在‘贝达’中的表达量是‘红地球’的约25倍。然而,随着侵染时间的推移,GT-2在‘红地球’中的表达量显著增强。这表明,在不同葡萄品种中,GT-2基因对灰霉菌侵染的响应模式存在差异,但在‘贝达’中三个时期的表达量相差不大。结合转录组数据分析,最终确定VlWRKY48和VlMYB74作为灰霉病抗性候选转录因子。

3 小结
为了深入探索葡萄对灰霉菌侵染的抗性机制,我们对灰霉菌胁迫下不同时期的‘贝达’和‘红地球’葡萄叶片进行了抗性鉴定和RNA-seq测序分析。经过严格筛选,我们共识别出11个可能参与葡萄抗灰霉进程的候选基因。通过qRT-PCR验证及后续深入分析,我们进一步筛选出两个关键基因,分别是MYB74和WRKY48。研究结果显示,在灰霉菌胁迫下,MYB74和WRKY48在抗性品种‘贝达’中的表达水平显著高于感病品种‘红地球’。基于这些发现,我们推测MYB74和WRKY48在葡萄对灰霉病的抗性反应中扮演着重要的角色。上述葡萄抗灰霉病关键基因的筛选和后续进一步的功能研究,将为利用分子辅助育种技术进行葡萄抗病新品种的选育提供理论基础和技术指导。