石家庄综合试验站
葡萄霜霉病(Grape Downy Mildew)是葡萄生产中的主要病害,危害严重。目前的防治方法仍是采用化学杀菌剂防控为主,但大量农药投入不仅造成栽培成本提高,果品安全性也受到影响。同时,化学杀菌剂的频繁使用不仅能诱导霜霉菌株产生抗药性,也危害环境的生态平衡。抗霜霉病基因的挖掘为抗病育种提供了新思路。我们通过转录组测序,发现VvDLO2基因在葡萄霜霉菌侵染抗、感材料过程中出现了显著的表达差异,比对发现该基因在葡萄中编码DMR6-like oxygenase2,与拟南芥AtDLO2为同源基因,推测其对葡萄防御霜霉菌侵染具有重要的调控作用。本实验通过拟南芥的DLO2同源基因的缺失突变体,离体接种辣椒疫霉,探究VvDLO2基因在植物抗病途径的功能。
1 试验材料与方法
1.1 试验材料
试验所用的拟南芥的col-0野生型河北师范大学朱正歌教授馈赠,T-DNA插入突变体dlo1和dmr6购自福州爱若莎生物科技有限公司(AraShare)。
试验菌辣椒疫霉由西北农林科技大学馈赠。
液体10%V8培养基: 100ml V8蔬菜汁中加入1g碳酸钙,3000rpm离心15 min,取上清,再加入十倍体积的去离子水(ddH2O),定容到1000ml,分装后121℃灭菌15-20 min。
固体10%V8培养基:按照100 ml加1.5g琼脂粉的比例配置,再121℃灭菌15-20 min。
1.2 试验方法
1.2.1不同基因型拟南芥的抗逆表型
将野生型col-0以及T-DNA插入突变体dlo1和dmr6在室内光照培养箱培养,待6周后开始低温胁迫,定期观察胁迫后的表型。
1.2.2 辣椒疫霉侵染方法
使用菌液侵染方法,辣椒疫霉培养于10% V8固体培养平板上。在25℃黑暗培养4-5 d。待菌丝伸展到整个培养板的2/3时,将菌饼切成长度为4-5mm的小块,置于含有液体V8培养基的培养皿,在25℃黑暗培养3-4 d,用灭菌的无菌水清洗三次,25℃黑暗培养过夜,随后置于4℃冰箱30 min,再室温静置5-10 min。用血球计数板将游动孢子悬浮液调至浓度为5×104/mL,用于接种。
1.2.3 接种辣椒疫霉
把拟南芥叶片剪下来,叶背面朝上,放置在含无菌湿润滤纸的托盘里(保湿),在叶片偏中上位置用移液枪悬滴10-15μL 游动孢子悬浮液,最好成水珠状,保证菌与叶片接触面积一致。封上保鲜膜(保湿),于25℃黑暗培养48 -72h后,观察叶片发病面积。用液氮冻存部分样品,其它的样品拍照并进行台盼蓝染色。
1.2.4 台盼蓝染色,观察发病面积
叶片发病后,加入植物台盼蓝染色液浸没叶片染色12h,用95%乙醇清洗,然后用95%乙醇脱色12h,用蒸馏水浸洗平衡30min,观察记录并拍照。
1.2.5病原菌相对生物量统计
辣椒疫霉生物量统计:将冻存的叶片研磨,用CTAB法提取叶片及辣椒疫霉基因组DNA,将DNA浓度稀释至200ng/μL作为模板,以拟南芥内参和辣椒疫霉内参对辣椒疫霉生物量进行qPCR分析。

2 试验结果
2.1 不同基因型拟南芥的抗逆表型
在室内培养的野生型col-0以及T-DNA插入突变体dlo1和dmr6,经过低温胁迫后的表型如图1。野生型col-0的生长缓慢甚至干枯死亡,而突变体dlo1和dmr6的生长没有受到抑制。

2.2 接种辣椒疫霉表型
拟南芥野生型col-0以及T-DNA插入突变体dlo1和dmr6的离体叶片在接种辣椒疫霉后72h观察到发病。由图1可见,col-0的叶片没有明显的变化,突变体dlo1叶片正面有明显的失绿,dmr6的叶片正面黄化更明显,同时突变体dlo1和dmr6的叶片的背面能看到菌层。经过台盼蓝染色后,突变体dlo1和dmr6 有明显的染色区域,表明基因突变导致拟南芥的抗性降低。

2.3 辣椒疫霉相对表达量统计
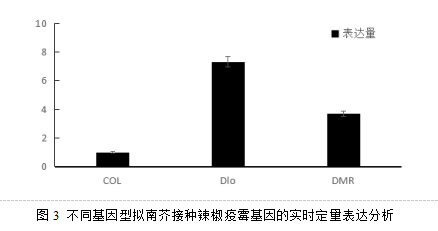
对三种基因型拟南芥接菌叶片中辣椒疫霉的表达量做qRT-PCR分析,由图2 中可见,以野生型col-0中辣椒疫霉的表达量作为1,突变体dlo1和dmr6中辣椒疫霉的表达量都有升高,dlo1中表达量为7.33,dmr2中的表达量为3.69,表明基因突变导致拟南芥的抗病性降低。
3.结论
辣椒疫霉同葡萄霜霉病菌一样属于卵菌,亲缘关系上较为接近,而且辣椒疫霉能够在培养基上培养,所以本次试验采用了辣椒疫霉。本次实验中,不同基因型拟南芥在受到低温胁迫后,突变体dlo1和dmr6表现出明显的抗逆性。离体接菌试验结果显示,野生型col-0的拟南芥叶片对辣椒疫霉表现出抗性,没有明显的病斑,而T-DNA插入突变体dlo1和dmr6则表现明显感病症状,出现褪绿斑和菌层,推测与突变体中基因dlo1和dmr6的表达受到抑制有关。进而推测基因dlo1和dmr6与植物的抗逆性和抗病性有一定的关系。