济南综合试验站
朱自果 李勃
植物一生中经常受到外界生物或非生物胁迫的威胁,比如干旱、盐渍、低温、病害和虫害等。其中,干旱时最为常见的非生物胁迫之一。目前,世界范围内约1/3以上的地区处于干旱或半干旱地区,水分亏缺限制植株生长,抑制光合,进而导致严重的经济损失,影响农业发展。MYB基因是高等植物中一类大的转录因子基因,在植物次生代谢、细胞分化、器官建成、响应干旱、低温和高盐等发挥着重要作用。中国野生燕山葡萄具有极强的抗旱性,但其抗旱机制还不是很清楚。前期我们从燕山葡萄干旱转录组中克隆到一条受干旱显著诱导的MYB基因,本研究将对其调控干旱的机制进行研究,以期为葡萄育种提供基因资源。
1 材料和方法
1.1 基因克隆及生物信息学分析方法
采用OMEGA公司的E.Z.N.A. Total RNA Kit I提取燕山葡萄叶片RNA,并利用SMART MMLV反转录酶进行反转录获得cDNA第一链。根据欧洲葡萄基因组设计燕山葡萄MYB基因引物序列,MYB24:上游引物:atggataaaaaaccctgcaattctcag,下游引物:
ttaatctccattaagtagctgcatag。以燕山葡萄叶片cDNA为模板,采用Primer®STAR HS DNA 高保真酶进行PCR克隆MYB24基因。PCR反应体系为:5×PrimerSTAR(Mg2+ Plus)5μL,dNTP Mixture 2 μL,上下游引物各0.2 μL,模板0.2 μg,高保真Taq酶0.25μL,加无菌水至25 μL。PCR反应程序为:98℃变性10 s;60℃退火10 s;延伸2 min,30个循环,72℃终延伸10 min。PCR产物在1%琼脂糖凝胶进行电泳,胶回收并与T载体进行连接(4℃过夜),而后转化大肠杆菌感受态细胞Top10进行LB平板蓝白斑筛选并摇菌,送上海生工生物工程技术有限公司进行测序。生物信息学分析:欧洲葡萄基因组比对:在线网址Grape Genome Browser(https://www.genoscope.cns.fr/externe/GenomeBrowser/Vitis)。采用DNAMan软件进行进化树分析。
1.2 材料处理及RNA提取
材料为2年生燕山葡萄盆栽植株,选择植株中部健康成熟叶片。非生物胁迫处理:高盐处理用0.1 mol/L NaCl浇灌至盆底溶液流出为止,高温处理将盆栽苗置于40℃光照培养箱,于处理后的3,6,9,12,24,36和48小时采收叶片。干旱处理,于盆土含水量为70%时开始干旱处理,于处理后0、1、2、3、4、5、7、9天采收叶片。所有处理材料采后立即用液氮速冻,置于-80℃冰箱冻存,以正常浇水的葡萄苗为对照,在相应的时期取样。上述材料放置在植物培养间或培养箱, 温度25-28℃,光照强度2000 lx,光照时间14 h 光照/10 h黑暗。以上试验均选用生长势一致的3盆葡萄植株进行处理。采用OMEGA公司的E.Z.N.A. Total RNA Kit I提取燕山葡萄处理下的叶片的RNA并进行反转录,并以此获得的cDNA为模板,实时定量试剂为TaKaRa公司SYBR premix Ex TaqII实时荧光定量PCR试剂盒,PCR的反应体系为:SYBR premix Ex Taq II 10 μL,上下游引物各0.8 μL,DNA模板2 μL,用双蒸水补齐到20 μL。qRT-PCR反应在Bio-Rad CFX 荧光定量PCR仪上进行。程序为95℃预变性30 s,95℃变性5 s,60℃退火和延伸30 s,40个循环。扩增曲线、溶解曲线、标准曲线由定量PCR仪软件自动生成。threshold cycle Ct 值(每个反应荧光信号由本底进入指数增长阶段的拐点所对应的循环数)由分析软件自动产生,mRNA相对比值的获得根据公式2-ΔΔCT (Livak and Schmittgen 2001)计算,以葡萄激动素基因Actin作为内参。每处理三个生物学重复,每个时间点荧光值三个技术重复,取平均值做图,通过t检验进行差异显著性分析。
1.3 亚细胞定位
挑取3-4周拟南芥,第5-7片健康叶于0.4M Mannitol的溶液中切细丝,浸没在酶解液中,避光酶解2-3 h。加入等体积酶解终止液,经40目尼龙网过滤,4℃,100g离心8min,弃上清,用重悬液轻柔重悬原生质体2次,至原生质体数目大约为2×105mL-1。取200 ul原生质体,加入质粒10 ul(浓度1-1.5 ug/μL),轻柔混匀,放置5 min,然后加入210 μL的PEG溶液,轻柔颠倒混匀,室温放置5~30 min。加800 μL终止液稀释终止反应,低速离心重悬,20~23℃弱光下培养18 h以上。利用共聚焦显微镜分别在405 mm和488 mm激发光下进行荧光观察。
1.4 转基因方法
构建pCAMBIA2300- VyMYB24超表达载体,利用农杆菌介导的遗叶盘法转化本氏烟草。烟草叶片预培养,菌液侵染、暗培养、脱菌、筛选培养基筛选愈伤组织至抗性芽出现、生根培养基诱导生根,至此成功获得VyMYB24转基因烟草植株,并利用PCR进行检测,T2代转基因烟草用于下游的功能验证。
1.5 激素处理及含量测定
采用ELISA方法测定赤霉素GA1+3。参照shan et al.,的方法。表型恢复实验:3周烟草苗,10-5M赤霉素处理3周。
1.6 干旱处理
方法:干旱处理10天,采集样品进行生理指标测定。叶绿素含量测定:参照Zhu et al., 的方法,将0.1 g样品剪碎置于10 mL浸提液(丙酮:乙醇=1:1),避光置于恒温培养箱,待叶肉组织变白,用分光光度计在645 nm、663 nm波长下测定光密度值,叶绿素总含量=(20.2×OD645+8.02×OD663)×V/1000/W,其中V为提取液总体积(mL),W为叶片鲜重(g)。
相对电导率测定:取0.3 g新鲜样品,用去离子水冲洗干净,剪碎置于10 mL去离子水中3h,测定溶液电导率(R1),然后100℃沸水浴20 min,冷却至常温测定溶液电导率(R2),相对电导率(%)=R1/R2×100%。活性氧、超氧阴离子染色:DAB染色采用北京索莱宝科技有限公司DAB染色试剂盒。DAB染色来检测过氧化氢的积累,将叶片浸泡在DAB溶液中,真空渗透30 min,然后将其避光过夜。之后将叶片浸泡在脱色液中(乙醇:水:乙酸:甘油=8:1:1:1),100度水浴10 min进行固定脱色,冷却至室温,将叶片转入新鲜的固定液中,拍照保存。NBT染色:将叶片浸泡在染色液中,染色液为25 mM磷酸缓冲液(pH7.6)溶解的NBT(1 mg/mL)溶液,在室温黑暗培养过夜。去除染色液,加入乙醇:甘油:乳酸(3:1:1)固定液,100度水浴10 min进行固定脱色,冷却至室温,将叶片转入新鲜的固定液中,拍照保存。生理指标测定采用检测试剂盒,参照说明书:MDA(南京建成A003-1)、H2O2(南京建成A064)、O2-含量(南京建成A052)、POD(南京建成A084)SOD(南京建成A001)CAT(南京建成A007)。
2 结果与分析
2.1 燕山葡萄VyMYB24基因的序列分析
燕山葡萄中VyMYB24基因,cDNA全长570 bp,编码190个氨基酸,分子量为21.569 kD,与欧洲葡萄基因组进行比对(https://www.genoscope.cns.fr/blat-server/cgi-bin/vitis/webBlat),定位于第14条染色体的16764247-16767889 bp处,gDNA长度为3643 bp,包含3个外显子,分别为136 bp、130 bp、304 bp,2个内含子,分别为93 bp、2980 bp。
在NCBI数据库中检索与VyMYB24同源的其他植物蛋白序列,利用DNAMAN软件对蛋白序列进行多重序列比对,发现VyMYB24与烟草、拟南芥、金鱼草MYB转录因子一样,均包含一个高度保守的R2-R3型结构域,VyMYB24与这些物种MYB蛋白序列相似性很高。
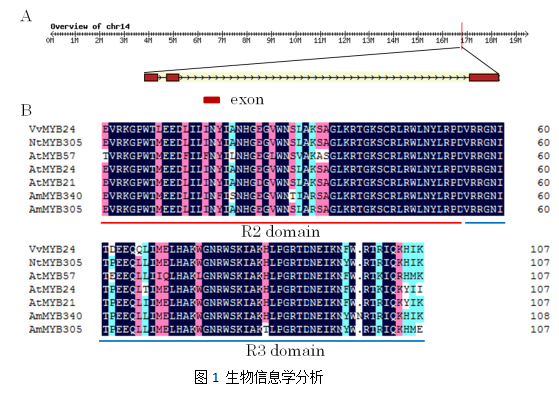
2.2 MYB24基因的表达分析
实时荧光定量PCR (qPCR) 检测燕山葡萄VyMYB24基因在逆境(干旱、高温和高盐)条件下的表达。干旱胁迫下,VyMYB24基因的表达量呈现上升趋势,且在干旱胁迫处理到9 d时表达量达到最大值,约为0天的25.96倍;高温条件下,VyMYB24基因的表达量呈现先上升后下降的趋势,在处理36 h时表达量达到峰值,约为0天的3.18倍;高盐胁迫条件下,VyMYB24基因的表达量呈上升趋势,在胁迫处理48 h时表达量达到峰值,约为0天的2.72倍(图2)。上述结果表明VyMYB24基因受干旱的强烈诱导,预测其可能在响应干旱胁迫中发挥重要作用。
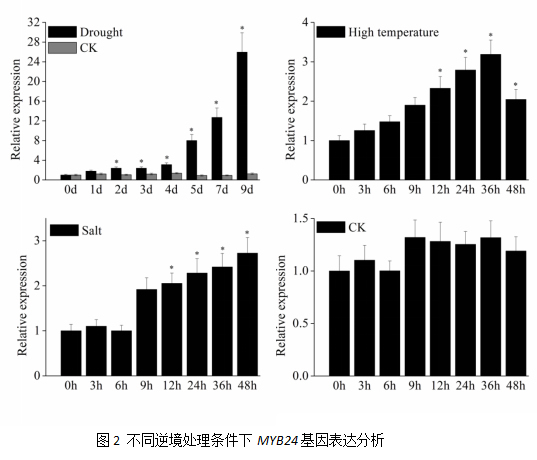
2.3 燕山葡萄VyMYB24基因的亚细胞定位
蛋白分析发现,燕山葡萄VyMYB24蛋白含有一个核定位信号,KGLKHMGKTPEAPSTINSKNCKIYKPK (蛋白位置第135-152)。为证实VyMYB24蛋白的亚细胞定位,对VyMYB24基因进行双酶切(XbaI和KpnI)插入到载体PBI221-GFP的绿色荧光蛋白的C端,构建融合表达载体pBI221- VyMYB24- GFP,通过PEG法将构建好的质粒转化到制备好的拟南芥原生质体中,以含有GFP的质粒作为对照,在荧光显微镜下观察拟南芥原生质体内绿色荧光蛋白的分布。结果表明,VyMYB24-GFP融合蛋白定位在细胞核内,而对照GFP蛋白则布满整个细胞,在细胞核、细胞质中均有分布(图3),说明燕山葡萄VyMYB24基因定位于细胞核。
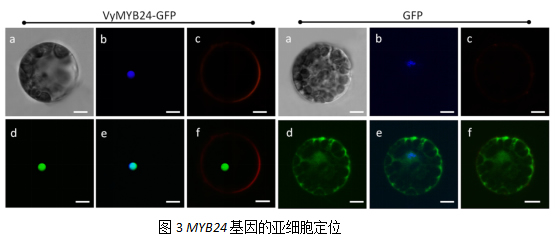
2.4 燕山葡萄VyMYB24基因导致植株矮化
T2代转基因烟草植株播种在MS培养基中,待其生长到第2周时,移栽到营养钵,分别在播种后的第2周,6周,8周和10周进行植株表型观察。结果如图3,相比野生型烟草,转基因植株(OE1、OE3)呈矮化表型,株高分别为野生型的54.07%和48.15%(2周),49.01%和35.83%(6周),64.44%和58.73%(8周),59.91%和56.78%(10周)(图3-2 A-E)。转基因植株叶面积显著小于野生型,转基因植株(OE1、OE3)分别为野生型的86.56%和56.76%。但是转基因烟草叶绿素含量显著高于野生型,转基因植株(OE1、OE3)分别为野生型的119.10%和138.22%。
此外,我们也观察到转基因烟草植株生殖器官也显著小于野生型。转基因烟草花器官显著小于野生型,长度分别为野生型的82.15%和81.50%;转基因烟草植株果实也显著小于野生型,长度分别为野生型的49.16%和40.74%。以上结果表明,VpMYB24基因影响植株发育,导致植株矮化。
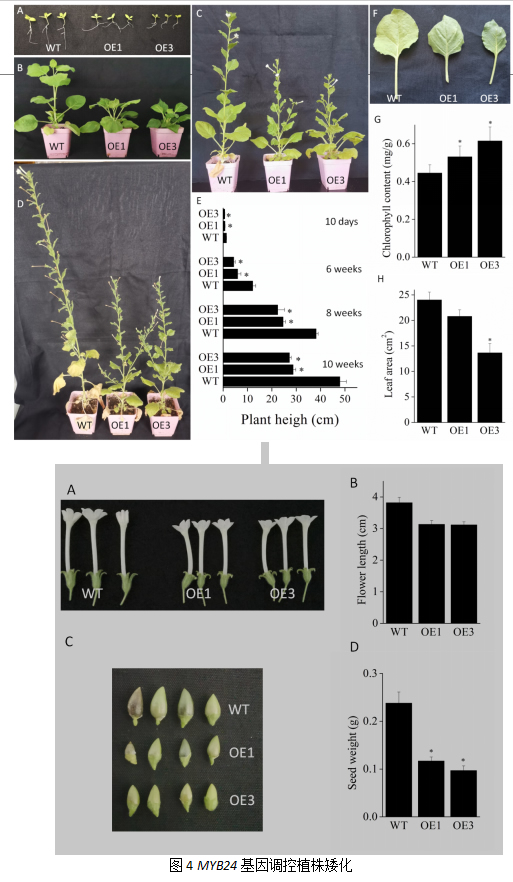
2.5 VyMYB24基因负调赤霉素导致植株矮化
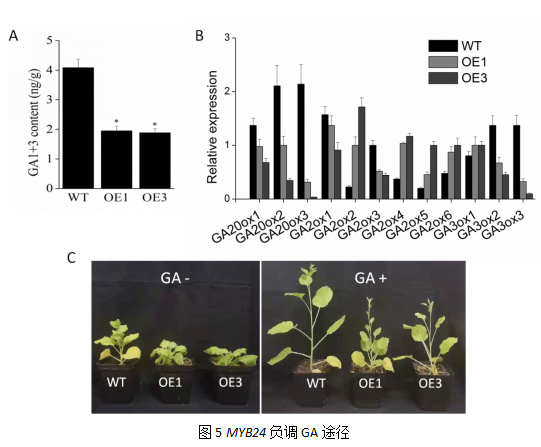
在赤霉素合成过程中,蛋白家族GA20ox和GA3ox在激素合成过程中发挥重要作用;蛋白家族GA2ox则调控具有生物活性的赤霉素的降解。本研究中发现,赤霉素合成相关基因GA20ox和GA3ox呈下调表达,赤霉素降解相关基因GA2ox呈上调表达。表明MYB24基因抑制赤霉素的合成。
赤霉素在植物生长发育方面起着重要调控作用,为解析VyMYB24基因导致植株矮化的机制,我们对转基因烟草内源赤霉素GA1+3含量进行测定。结果如图3A,转基因烟草的两个株系的GA1+3含量显著低于野生型,分别为野生型的47.72%和46.17%(p<0.05)。同时我们对3种赤霉素合成代谢相关基因的表达进行分析,赤霉素合成相关基因GA20ox类在两个转基因株系(OE1、OE3)中的表达量均低于野生型;赤霉素降解相关基因基因GA2ox类基因的表达除了GA2ox1和GA2ox3之外,均是转基因株系表达高于野生型株系。此外,我们通过外源喷施赤霉素来验证GA水平能否回复转基因烟草表型,结果如图3D,喷施赤霉素后转基因烟草的两个株系矮化表型均得到恢复。以上结果表明,VyMYB24基因通过负调赤霉素的合成来调控植株发育。
2.6 燕山葡萄VyMYB24基因提高植株的抗旱性
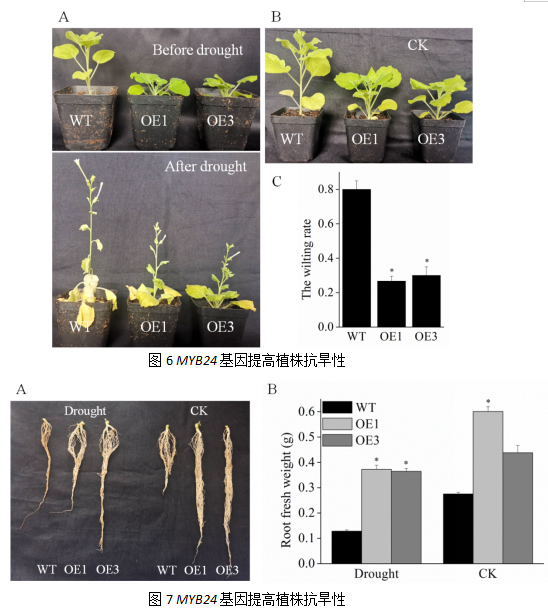
A旱处理和对照烟草苗根系形态;B旱处理和对照烟草苗鲜重测定
选取4~5周苗龄的烟草进行12 d干旱处理。结果如图,与野生型烟草相比,干旱处理后转基因烟草的叶片较少出现萎蔫失水现象,转基因烟草萎焉率为26.67%和30%,而野生型的萎焉率则达到了80%。干旱处理后,转基因植株根系发达,根系鲜重显著高于野生型烟草,转基因植株鲜重为0.37 g/株和0.36 g/株,而野生型仅为0.13 g/株,这表明VyMYB24基因可以显著提高烟草植株的抗旱能力。
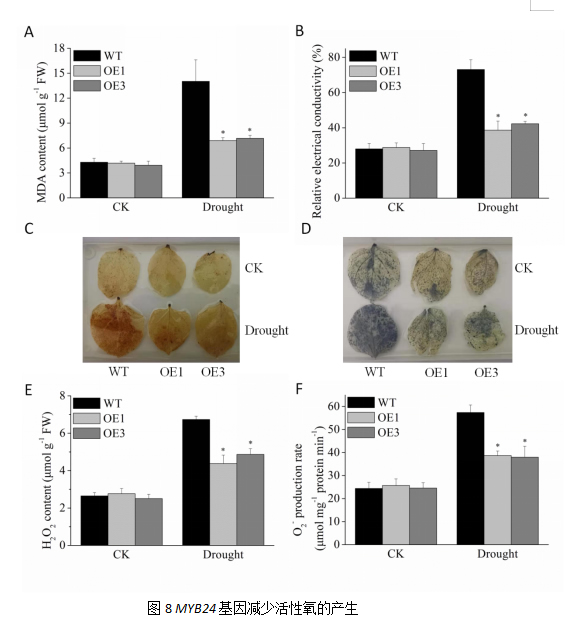
MDA和相对电导率都是鉴定植物受损伤的重要因子,在植物应对干旱胁迫时起着至关重要的作用。正常浇水情况下,野生型和转基因烟草MDA和相对电导率没有差异。但干旱胁迫后野生型MDA含量显著高于野生型,转基因植株MDA含量为野生型植株的49.07%和51.07%。干旱胁迫后野生型电导率含著高于野生型,转基因植株相对电导率为0.38和0.42,而野生型植株则达到0.73。以上结果表明,VyMYB24基因过表达可以降低植株在干旱条件下的MDA和电导率,保护叶片受损。
干旱胁迫条件下,活性氧的积累是导致植物不能进行正常生理活动的一大影响因子。此时活性氧清除机制的平衡被打破,过量的活性氧影响膜脂的平衡,导致膜系统被破坏;其次就是活性氧不断积累,产生有毒物质,毒害细胞,失去正常的生理功能。过氧化氢(H2O2)和超氧阴离子(O2-)属于活性氧的主要组成成分,因此可以通过鉴定H2O2和O2-在植物中的累积,判断植物耐受干旱胁迫的能力强弱。
DAB和NBT染色通常用于定位植物组织中的H2O2和O2-。将干旱处理10 d后的烟草叶片进行DAB和NBT染色观察。结果发现,DAB染色,对照组的野生型烟草和转基因烟草叶片上色较浅,无显著差异;而干旱处理,野生型烟草叶片的褐色斑块颜色较深,且斑块面积明显高于转基因植株;NBT染色,对照组的野生型烟草和转基因烟草叶片上色较浅,无显著差异;而干旱处理,野生型烟草叶片的褐色斑块颜色较深,且斑块面积明显高于转基因植株。
同时我们对烟草叶片H2O2含量和O2-产生速率进行测定。结果发现,对照野生型烟草和转基因烟草叶片H2O2和O2-含量差异不明显;但干旱处理后野生型烟草叶片H2O2和O2-含量显著上升,但转基因烟草叶片H2O2产生速率仅为野生型烟草的64.93%和72.57%,转基因烟草叶片O2-产生速率仅为野生型烟草的67.38%和66.20%。说明干旱条件下VyMYB24基因可以通过减少烟草叶片组织中活性氧的积累从而提高植物的抗旱能力。
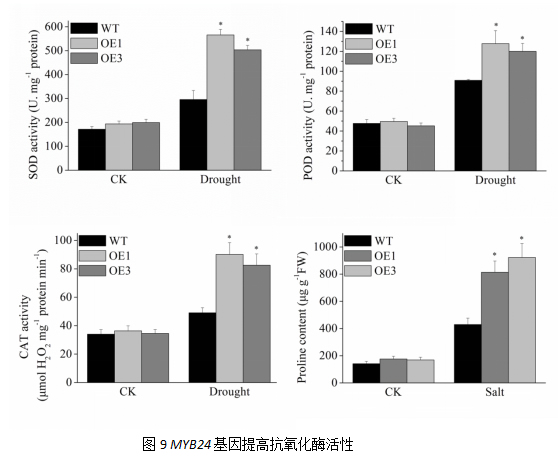
活性氧清除酶在植物应对外界逆境胁迫过程中起重要作用。SOD、POD、CAT三种活性氧清除酶的活性正常条件下,在野生型烟草和转基因烟草中没有差异;但在干旱条件下,抗氧化酶活性迅速增加,转基因植株SOD酶活为野生型植株的1.91倍和1.70倍;转基因植株POD酶活为野生型植株的1.40倍和1.32倍;转基因植株CAT酶活为野生型植株的1.84倍和1.68倍。此外,我们还对渗透调节物质脯氨酸进行测定,正常浇情况下,脯氨酸在野生型烟草和转基因烟草中没有差异,三种物质的含量均处于相同水平,但干旱胁迫后,可以观察到转基因烟草脯氨酸含量显著高于野生型。以上结果表明,VyMYB24基因过表达可以提高转基因烟草的抗氧化酶活性和脯氨酸含量,降低转基因烟草在逆境条件下受到的损伤,从而提高烟草抵御外界干旱胁迫的能力。
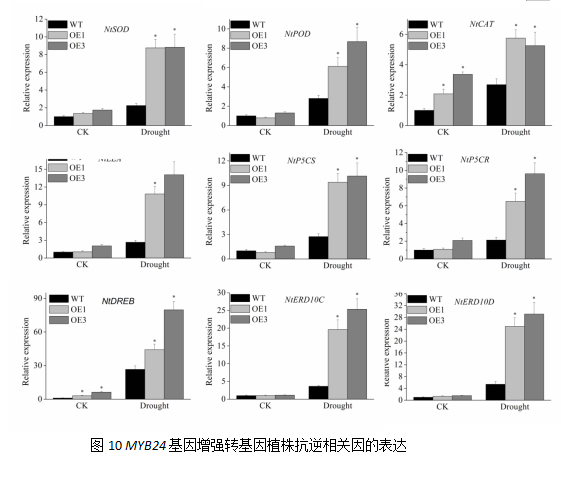
为阐明VyMYB24基因调控干旱的分子机制,利用实时荧光定量技术抗逆相关基因的表达进行检测。结果发现,干旱胁迫后,转基因植株抗逆相关基因的表达量均显著升高,特别是NtERD10C、NtERD10D的表达,与对照相比上升了近14倍左右;NtDREB基因的表达量与对照相比上升了近10倍左右;NtSOD、NtPOD、NtCAT、NtP5CS、NtP5CR基因的表达量变化相似,表达倍数变化较低,与对照相比上升了近7倍左右。由此表明,VyMYB24基因可能通过调控抗逆相关基因的表达来增强植株的耐旱能力。
3. 讨论与结论
作为一种重要的园艺作物,葡萄在世界范围内广泛栽植。然而,干旱显著影响葡萄的生长发育,特别是果实及葡萄酒的品质。以往的报道表明,MYB基因参与调控植株发育进程、生物及非生物胁迫。但是,MYB基因如何介导干旱的机制还不是很清楚。
许多物种的MYB基因家族成员参与植物器官建成、花发育和生长等发育过程。同源性分析发现,MYB24蛋白与烟草MYB305、金鱼草MYB330蛋白具有较高的同源性,后两者抑制植株发育,导致植株矮化。我们的研究表明,过表达MYB24基因同样引起植株矮化症状,包括株高、叶面积、花长度及种子大小等。拟南芥MYB96基因也表现同样的现象,植株矮化,改变叶形态,侧根数目减少等。此外,MYB24基因与拟南芥MYB24、MYB21和MYB57基因归为一类,后3基因参与花药发育。但本研究MYB24为影响转基因植株花药的发育进程,没有发现雄性不育的现象。因此,我们认为MYB24基因在植株发育过程中对株高的调控起主要作用。作为一种重要的激素,GA在调控植物发育过程中起关键作用。本研究中,转基因植株GA1+3含量显著降低,同时外源施用GA可恢复转基因植株的矮化表型。同时通过解析赤霉素代谢基因的表达发现,转基因植株中赤霉素合成相关基因显著下调,而赤霉素降解相关基因显著上调。拟南芥JUB1基因也表现出相同的结果。以上表明,MYB24基因通过赤霉素代谢途径来调控植株发育。
在胁迫反映过程中,MYB24基因手干旱诱导最为强烈,这促使我们探究其在抗旱中的功能研究。干旱胁迫下,相比野生型,转基因植株表现出相对较低的萎焉率和相对电导率,表明其增强了对干旱的抵抗能力,而且转基因植株拥有更强壮的根系。苹果上SIMYB1和MYB88也通过强壮的根系来增强抗旱能力。
作为一种信号分子,活性氧课调控植株发育。正常状况下,活性氧的产生及消除处于一种平衡状态,但当受到外界胁迫时,植物会积累过量的活性氧,它可引起细胞膜脂过氧化,破坏细胞膜,甚至造成细胞死亡。植物体内存在活性氧清楚机制,通过一些列的氧化酶(SOD、POD、CAT)来清除过量的过氧化氢和超阳阴离子。以往的研究表明,拟南芥MYBs基因,水稻MYB6基因,小麦MYB33和苹果SIMYB1基因均可通过抗氧化酶系统来调控活性氧的产生。本研究中,干旱胁迫下MYB24转基因植株累积较少的活性氧,且抗氧化酶含量显著高于野生型,同时抗氧化酶基因SOD、POD、CAT的表达量均显著高于野生型。以上表明,MYB24基因可通过上调抗氧化酶活性来减少活性氧的产生。
总而言之,我们从燕山葡萄中鉴定到一条抗旱相关的R2R3型MYB基因。干旱胁迫下,MYB24基因可通过增强植株根系,上调抗氧化酶活性,累积脯氨酸,上调抗逆相关基因,来增强植株抗旱性。此外,MYB24基因可通过负调控赤霉素代谢途径抑制植株发育。以上研究不仅拓展了葡萄MYB基因的潜在功能,为进探讨MYB基因家族干旱胁迫的分子机制提供了新的证据。