鲜食葡萄品种改良岗位
1 材料与方法
1.1 材料
利用生长于北京温泉苗圃的‘峰后’(Vitis vinifera×Vitis labrusca)葡萄,植株年龄15年,篱架方式栽培,植株生长健壮。
1.2 试验方法
1.2.1 激素处理和采样
利用赤霉素5ppm(GA3,Sigma-Aldrich,美国)进行处理,该激素浓度是基于先前的研究(Lu et al. 2016)。将GA3溶解在含有5%乙醇和0.1%Tween 80的溶液中。2017-2019年选取10株‘峰后’葡萄,在开花前(DBA)8天前,每一株葡萄选择4个相同节位的花序,共选取20个花序,其中10个花序去雄,利用5ppm的GA3(Sigma-Aldrich,美国)对去雄后的10个花序进行喷洒花序处理,另外10个花序没有去雄,正常授粉受精作为对照。
开花后2、6、10、14天,收集各处理的花序,样品分为2份,一份用FAA(50%乙醇,5%冰醋酸和5%甲醛)固定,用于制作石蜡切片进行显微观察。还有一份立即在液氮中冷冻,并保存在-80℃条件下,用于基因表达分析。
1.2.2 组织形态结构观察与统计分析
将FAA固定的子房或幼果通过乙醇系列脱水后,包埋于石蜡中,切成8μm的切片,用番红和固绿染色,然后用Olympus CX31显微镜照相。 使用ImageJ软件测量2、6、10、14DAF的子房或幼果中内、中、外果皮的直径、细胞层数、细胞面积。
1.2.3 RNA提取和实时PCR分析
总RNA通过用改良的CTAB方法(Murray and Thompson 1980)从葡萄的子房/果实中进行提取。使用逆转录酶(Promega,USA)和oligo dT引物,合成多达2μg的RNA合成第一条cDNA。 RT的反应条件如下:将样品在70℃下孵育5min,然后在42℃下孵育1h,然后立即置于冰上。这些cDNA用作模板在ABIPRISM 7500上进行的定量实时PCR(qRT-PCR)。所有实验均进行了三个生物学重复和两个技术重复。VvDELLA1,VvDELLA2,VvDELLA3,VvCEB1,VvEXPA8,VvEXPA11用Primer软件5.0(PREMIER Biosoft International,Palo Alto,CA,美国)设计引物。VvUBQ用作管家基因以使基因表达正常化。相对基因表达水平使用2-ΔΔCt方法进行计算 (Livak and Schmittgen 2001)。所有这些引物在补充表S1中列出。
1.2.4 酵母双杂交试验
利用Matchmaker GAL4的双杂交系统3进行酵母双杂交试验(Y2H)。将VvDELLA2、VvCEB1的全长及分段cDNA序列克隆到pGADT7或pGBKT7载体中(见补充表S2),通过乙酸锂法将猎物和诱饵构建体共转入酵母菌株AH109中。通过在最小的-Leu/-Trp (SD-2)培养基和含有4mg ml-1 X-α-gal的-Leu/-Trp/-His/-Ade (SD-4)培养基上生长共转染组合,验证了每个共转染组合的相互作用。
1.2.5 双分子荧光互作法
使用pSPYNE和pSPYCE(见补充表S2)创建表达YFPN和YFPC融合体的构建体(见补充表S2),并如前所述(Schutze et al. 2009)共同转化到烟草叶片中。注射后的烟草叶片在28℃下8小时/16小时,光/暗循环培养72小时,在共聚焦显微镜(Olympus Fluoview FV1000)下进行绿色荧光蛋白(GFP)荧光观察。
1.2.6 电泳迁移率测定(EMSA)
将VvCEB1的CDS区克隆到PET-30a(+)载体中,生成组氨酸(His)融合蛋白(见补充表S2)。将构建体转化到大肠杆菌BL21(DE3)细胞中,将细胞在16℃下孵育过夜,之后将其超声处理,裂解液通过镍柱(生物技术(上海)有限公司,中国)收集并纯化蛋白质。用500mM咪唑洗涤纯化的VvCEB1蛋白。通过将互补的寡核苷酸在72℃退火30分钟,合成结构基因的寡核苷酸探针,并用5′-生物素(Sangon Biotech)标记(补充表S3)。根据制造商的说明,使用Chemiluminescent Biotin-labeled Nucleic Acid Detection Kit(Beyotime Biotechnology)进行电泳迁移率测定(EMSA)。
1.2.7 荧光素酶检测
将VvCEB1和VvDELLA2的cDNA独立插入pCAMBIA 1305.1植物组成型表达载体,产生35S::VvCEB1和35S::VvDELLA2构建体。将VvEXPA8和VvEXPA11的启动子分别地插入pCAMBIA2300植物组成表达载体以产生pVvEXPA8::LUC和pVvEXPA11::LUC。所用引物列于补充表S2中。使用冻融法(Weigel and Glazebrook 2006)将载体独立转化到Agrobacterium EHA105细胞中。将转化的细胞重新悬浮在含有1mM MgCl2、1mM MES-KOH和50μM乙酰丁香酮的pH5.7的浸润缓冲液中,直到OD600浓度达到1.0。使用无针注射器,将以下等量的各种组合菌悬液(pVvEXPA8::LUC+空载体(1:1)和35S::VvCEB1+pVvEXPA8::LUC(1:1);pVvEXPA11::LUC+空载体(1:1)和35S::VvCEB1+pVvEXPA11::LUC(1:1);35S::VvCEB1+pVvEXPA8::LUC(1:1)和35S::VvDELLA2+35S::VvCEB1+pVvEXPA8::LUC(1:1:1);35S::VvCEB1+pVvEXPA11::LUC(1:1)和35S::VvDELLA2+35S::VvCEB1+pVvEXPA11::LUC(1:1:1))注射到5周龄烟草植株的幼叶中,将植株在24℃下培养3天。然后将注射的叶子剪下,用100mM荧光素(Promega)涂抹,并置于黑暗中5分钟。用NightSHADE LB 985体内植物成像系统(Berthold,德国)观察和成像转化的N.benthamiana叶片。每个实验至少进行3个独立的生物学重复。
2 结果
2.1 外源赤霉素处理对‘峰后’葡萄果实早期发育的影响
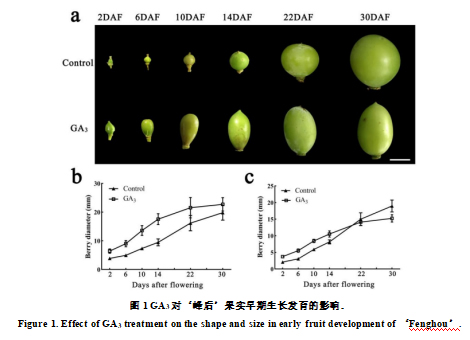
开花前利用5ppm外源赤霉素对已去雄的‘峰后’葡萄花序进行处理,发现处理后果实迅速膨大,果实纵径明显长于对照(图1a)。对果实生长曲线进行测量,在开花后2-14天,GA3处理的果实纵径和横径均明显大于同时期的对照果实(图1b,c)。开花后22-30天,虽然GA3处理的果实纵径依然大于同时期的对照果实,但与对照之间的差距越来越小(图1b),而果实横径GA3处理明显低于同时期的对照(图1c)。
2.2 外源赤霉素对果实解剖结构的影响
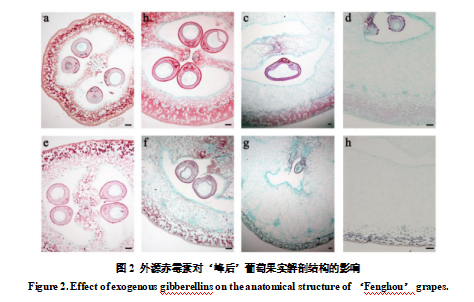
为了确定 GA3 处理对葡萄果实结构和果皮细胞的影响,将 2 至 14 DAF 的 GA3 处理和未处理‘峰后’幼果的石蜡切片用番红和固绿染色,并使用光学显微镜观察。 2 DAF 时,GA3 处理的子房壁及中果皮略大于对照(图 2a、e)。 在6 DAF时,GA3处理的子房的中果皮开始转变为薄壁细胞,并且子房壁明显变厚(图2b,f)。 在 10 和 14 DAF 时,对照果实中的外果皮细胞排列紧密,一些中果皮细胞变成薄壁组织细胞(图 2c,d)。 GA3处理后,所有中果皮细胞都变成薄壁细胞(图2g,h),特别是在14 DAF时,只有靠近表皮的几层外果皮细胞排列紧密,而其余的则发育成大的、不规则的薄壁细胞(图2h)。
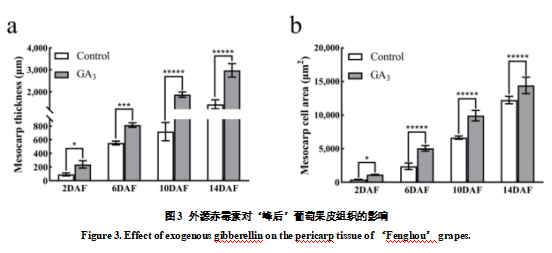
对开花后2天至14天幼果的外果皮、中果皮、内果皮的厚度,细胞层数,细胞大小进行了统计分析。GA3处理与对照果实的外果皮和内果皮厚度在不同发育时期差异不大,但中果皮厚度GA3处理的果实明显大于对照(图3-a和补充图S1a,b)。而GA3处理与对照的果实外、中、内果皮细胞层数没有明显差异(补充图S1c-e)。同时外果皮和内果皮的细胞大小也差异不大(补充图S1f-g),但是外源GA3处理的果实中果皮细胞面积从开花后2天明显大于同时期发育的对照果实(图3b)。
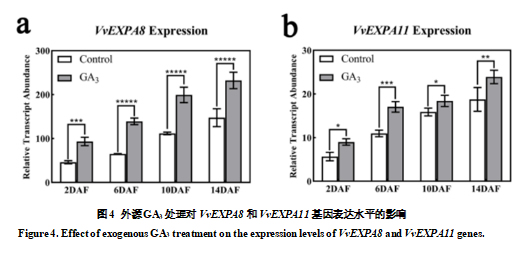
2.3 外源GA3对VvEXPAs基因表达水平的影响
由于外源GA3处理后,中果皮细胞显著增大。对此,我们测定了细胞膨大相关基因VvEXPA8和VvEXPA11(参与细胞壁的扩张)在赤霉素处理后的表达水平,发现VvEXPA8和VvEXPA11在处理后各个时期均显著高于对照(图4a,b)。这说明外源GA3处理可能通过促进细胞壁松弛基因VvEXPA8和VvEXPA11的表达,使果皮细胞的细胞壁松弛,进而使细胞膨大。
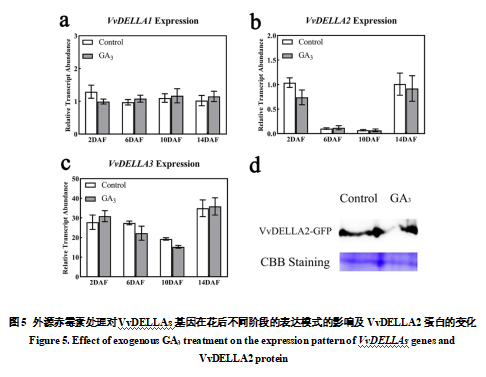
2.4 外源GA3对VvDELLAs基因表达及其蛋白水平的影响
由于GA途径中DELLA蛋白是关键节点,我们测定了外源GA3处理后对VvDELLAs基因和蛋白在幼果期的表达水平变化,发现VvDELLA1基因在处理后2天略低于对照,其余处理后6、10、14天的VvDELLA1 基因表达均高于对照(图5-a)。VvDELLA2基因在GA3处理后的2天和14天都低于对照,尤其是处理后6天和10天VvDELLA2基因的表达,无论是处理还是对照都显著降低(图5-b)。VvDELLA3表达在GA3处理后的2天和14天略高于对照,而在GA3处理后的6天和10天则VvDELLA3表达则低于对照(图5-c)。从基因表达可以看出,VvDELLA2可能在果实早期发育中起主要作用,对此,利用葡萄子叶分析VvDELLA2蛋白是否受到外源GA3的影响,结果显示,外源赤霉素处理后VvDELLA2蛋白表达量明显低于对照(图5-d)。
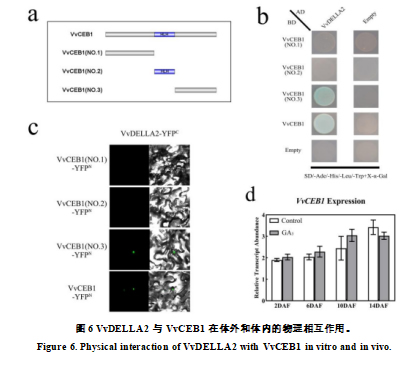
2.5 GA 信号抑制因子 VvDELLA2 与转录因子 VvCEB1 相互作用
DELLA 蛋白不具有任何已知的 DNA 结合结构域,主要与转录因子相互作用来调节赤霉素介导的植物发育 [27]。 先前的研究表明,葡萄中的转录因子VvCEB1参与果实细胞的扩张[43]。同时,对幼果膨大期VvCEB1基因表达的分析表明,GA3处理导致比对照更高的表达(图6d)。 因此,我们假设VvDELLA2与VvCEB1相互作用共同调节早期葡萄果实膨大。为了测试 VvDELLA2 和 VvCEB1 是否直接相互作用,我们进行了 Y2H 测定。 我们发现在此测定中 VvDELLA2 确实与 VvCEB1 相互作用(图 6b)。 此外,VvCEB1 的 C 端对于这种相互作用是充分且必要的(图6a,b)。 双分子荧光互补 (BiFC) 测定显示 VvDELLA2-YFPC 和 VvCEB1-YFPN 在本氏烟草细胞的细胞核中相互作用(图 6c)。 这些结果支持了赤霉素可能通过 VvDELLA2 和 VvCEB1 的相互作用调节早期葡萄果实膨大的假设。
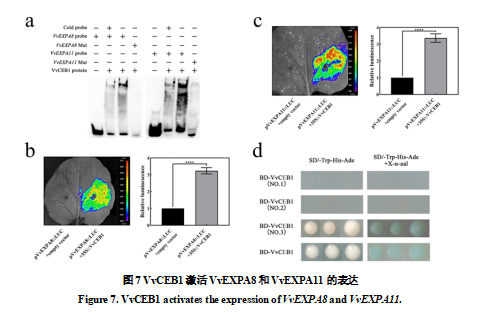
2.6 VvCEB1激活VvEXPA8, VvEXPA11基因表达
上述研究表明,外源GA3处理促进了VvEXPA8和VvEXPA11基因表达(图4),因此我们分析了转录因子VvCEB1与VvEXPA8和VvEXPA11基因之间的关系。 我们对 VvEXPA8 和 VvEXPA11 基因启动子的分析揭示了 VvEXPA8 和 VvEXPA11 启动子中处存在 VvCEB1 结合位点,EMSA 测定结果表明 VvCEB1 蛋白能够与 VvEXPA8 和 VvEXPA11 启动子中G-box 位点的 DNA 探针形成复合物。 当存在非生物素标记的竞争探针时,结合带显着减弱;当探针突变时,结合带完全消失(图7a),表明VvCEB1可以在体外与VvEXPA8和VvEXPA11启动子结合。荧光素酶检测结果显示,VvCEB1可以激活分别与VvEXPA8和VvEXPA11启动子连接的报告基因LUC的表达(图7b,c),表明VvEXPA8和VvEXPA11启动子受到VvCEB1的调控。 结果表明,VvCEB1可以激活VvEXPA8和VvEXPA11基因的表达。
2.7 VvDELLA2抑制VvCEB1对下游靶基因的激活
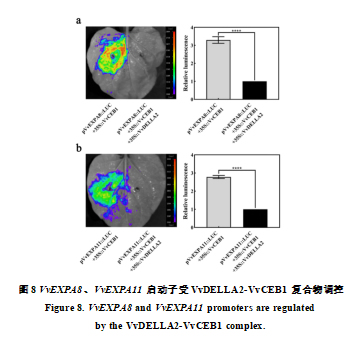
由于VvCEB1可以激活VvEXPA8,VvEXPA11基因启动子,而VvDELLA2与VvCEB1全长和C端之间存在互作关系,VvCEB1 及其 C 末端在酵母中显示转录激活活性(图 7d)。 这些结果使我们怀疑VvDELLA2和VvCEB1之间的相互作用影响VvCEB1对VvEXPA8和VvEXPA11基因的调节。我们利用荧光素酶试验结果显示,只有VvCEB1表达时,可以分别激活与VvEXPA8,VvEXPA11启动子相连的报告基因LUC的表达(图8-a,b),而当VvDELLA2与VvCEB1共表达时,则报告基因LUC的表达受到抑制(图8-a,b), 这说明VvDELLA2与VvCEB1结合时,抑制了VvCEB1的转录激活功能。