制干鲜食兼用品种改良岗位
李玉玲 苏来曼·艾则孜 王勇 孙锋 伍国红
摘要:采用不同生长素类和细胞分裂素类生长调节剂对昆香无核葡萄花前 2 周进行不同浓度的处理, 对果实的单果胚珠数、胚珠重量从35d开始每隔5d统计一次,同时以 ER 固液双相培养基作为胚发育培养基,WPM 固体培养基作为胚萌发培养基进行胚挽救,研究花前植物生长调节剂的施用对昆香无核胚挽救效果的影响。结果表明BA、IBA、KT、CCC 不同浓度的处理都能使昆香无核胚珠数增多; 用10 mg/L BA花前处理,种子(胚珠)大小指数为72.9%, 为最大, 而 5 mg/L CPPU 花前处理,种子(胚珠)大小指数为48.8%, 为最小;BA 5 mg/L 处理单果的平均种子(胚珠)数 2.9粒, IAA处理单果的平均种子(胚珠)数为1.0粒。花前BA5 mg/L 和10 mg/L 处理,IBA10 mg/L 和20 mg/L处理产生的胚珠进行胚珠培养都可以提高昆香无核的剥胚率和成苗率;花前喷施BA和IBA可以延缓胚珠败育5d以上。结果表明, 生长素类和细胞分裂素类生长调节剂可以提高无核葡萄坐果率, 可以延缓胚珠败育,可为提高无核葡萄育种效率。
关键词:昆香无核;花前;激素处理;胚珠发育;剥胚率
葡萄是世界四大果树之一,除了鲜食,还可以制干、制汁、酿酒,具有很高的经济价值[1-2]。其中无核葡萄因为口感怡人获得更高的市场价值,无核也成为制干和鲜食葡萄中一个重要指标,胚挽救技术在葡萄育种中的应用,使得无核育种效率极大的提高[ 3-7],获得较多的胚挽救苗是葡萄新品种选育的重要条件,而提高杂交育种过程中胚珠的剥胚率和成苗率对于胚挽救至关重要。种子败育型无核葡萄胚的发育程度与败育时间,除了与品种基因型有关外,还与植株所处的营养水平以及激素紧密相关。不少学者研究花前喷施植物生长调节剂对葡萄胚发育的影响[8-11],但喷施不同种类、不同浓度植物生长调节剂对幼胚发育的作用不同。本研究在借鉴前人研究的基础上,选择了8种植物生长调节剂,在花前14d,进行沾穗处理,研究其对昆香无核胚挽救效果的影响,以期为提高无核葡萄胚挽救效率提供依据。
1 材料和方法
1.1 材料
于2021-2022年在新疆维吾尔自治区葡萄瓜果研究所葡萄育种园内进行,试材为8年生假单性结实葡萄品种昆香无核[属假单性结实类型, 有残核],取树势相近的12株树为试材。
1.2 方法
1.2.1花前植物激素处理
在开花前2w随机选取花穗, 用不同浓度不同植物生长调节剂分别处理5s,试验设17个处理, 每处理4 个花穗, 3 次重复。设处理分别为: 1.BA 10 mg/L, 2. BA 5 mg/L, 3. IBA 20 mg/L, 4. IBA10 mg/L, 5.CPPU 10 mg/L, 6. CPPU 5 mg/L, 7. KT 10 mg/L, 8. KT5 mg/L, 9. IAA 22 mg/L, 10. IAA 10 mg/L,11. NAA 20 mg/L, 12. NAA 10 mg/L, 13. TDZ10 mg/L,14. TDZ5mg/L,15.CCC1000mg/L,16. CCC500mg/L, 17清 水 对 照( CK) 。
1.2.2 取样。分别在花后 35d、40d、45d、50d、55d、60d、65d、70d采取果粒,每个果穗上中下均采4粒,置于4℃冰箱备用。
1.2.3 果实种子检测方法
采取陶建敏果实种子检测方法[8]进行分级检测,每个处理随机取采取50粒成熟浆果, 统计出每粒浆果中种子(胚珠)数目、大小。每处理随机取50 粒种子(胚珠)用吸水纸吸干种子表面水分称重,重复3次。
1.2.4 胚珠培养
将幼果先用水冲洗30min,再用 70%酒精消毒30sec后用无菌水冲洗1遍,然后用有效氯含量为0.5-1%的NaClO溶液表面消毒,然后无菌水冲洗2-3 次。在超净工作台上,将胚珠取出,接种到ER固液双相培养基中(附加有0.5 g/L水解酪蛋白、0.5mg/L IBA、60 g/L 蔗糖、3 g/L 活性炭、4.5 g/L琼脂粉,p H 值 5.8)。暗培养8周。
1.2.5 胚萌发培养
从胚珠中剥取裸胚,接种于试管中胚萌发培养基上,置于组培室培养(室温 23℃,每日光照16 h)。胚萌发培养基为:WPM+0.25 mg/L 6-BA+20 g/L 蔗糖+3.0 g/L 活性炭+4.5 g/L 琼脂粉,p H 值 5.8。
1.2.6 残核及种子处理
采收充分成熟的浆果,收集果实残核。将残核放入盛水的烧杯中,以分离出下沉的种子(可能萌发的)。然后将下沉种子(胚珠)洗净,计数后放入冰箱中层积,2~3个月后进行种子萌发试验[9]。
1.3 数据统计
统计剥胚率,出苗率,数据用DPS数据统计分析软件,Duncan新复极差法进行统计分析。
剥胚率(%)=(剥取裸胚的个数/胚珠数)×100
成苗率(%)=(成苗数/胚珠数)×100
2.结果与分析
2.1 植物生长调节剂对坐果率的影响
据观察,IAA和NAA处理的花穗在处理后4- 9天表现出落花现象,甚至整个花穗全部脱落,同时坐果后有部分单性结实,应该是对其葡萄花序的正常发育有影响,而CCC、6-BA、IBA、CPPU处理的果穗,果粒明显变紧,说明这几种激素在昆香无核花前处理可以促进葡萄坐果。
2.2 植物生长调节剂对胚发育和萌发的影响
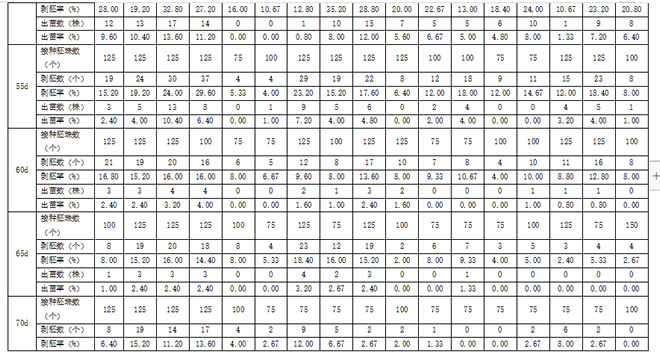
授粉后35-70d接种的胚珠发育及萌发情况(见表1)表明, 花前6-BA、IBA、CCC500mg/L、TDZ处理都有利于胚珠的发育,剥胚率、成苗率较对照有明显提高。IBA20mg/L处理在50d胚珠培养的成苗率是13.6%,对照为6.4%,成苗率是对照的2倍。
2.3 植物生长调节剂对取样时间的影响
由表1可见,花前用6-BA、IBA处理能延长昆香无核的取样时间,对照在花后55d取样时成苗率只有1.00%,而经过6-BA、IBA花前处理的70d取样进行胚珠培养仍能有一定的成苗率,特别是IBA处理的成苗率更高。说明花前6-BA和IBA处理可能通过改变了昆香无核葡萄内源激素水平,从而延缓或阻碍种胚败育,为胚挽救争取时间,提高胚挽救效率。
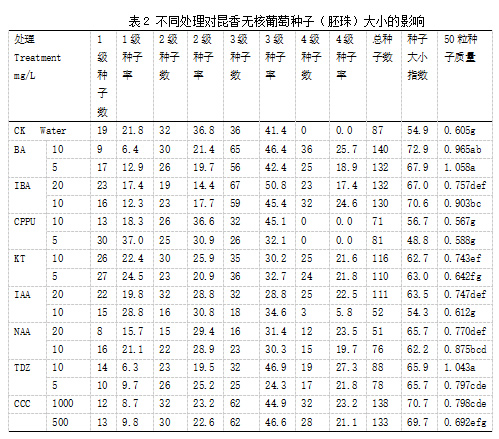
2.4 植物生长调节剂对昆香无核种子(胚珠)大小的影响
对不同处理的果实, 待完全成熟后检测形成种子(胚珠)大小。由表 2 可以看出, 不同处理诱导昆香无核葡萄形成种子(胚珠)大小是不一样的。 6-BA、IBA、CCC花前处理均能促使昆香无核种子(胚珠)发育,其中 6-BA5 mg/L 的处理 4级种子(胚珠)占 25.7%,种子(胚珠)大小指数为72.9%,较其它处理最高,其次为CCC1000 mg/L和处理, 其中CCC1000mg/L4级种子(胚珠) 23.2%, 种子(胚珠)大小指数为 70.7%, IBA10mg/L四级种子(胚珠)占24.6,种子(胚珠)大小指数为70.7,CPPU10 mg/L处理的种子(胚珠)大小指数低, 为48.8%,较其他处理最低。BA 5 mg/L 和 10 mg/L的处理诱导产生种子(胚珠)数量较多, 且种子(胚珠)质量较其他处理大。
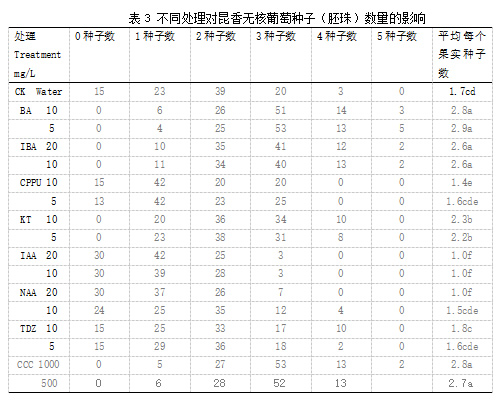
2.5 植物生长调节剂对昆香无核种子(胚珠)数量的影响
由表3可见,不同处理的昆香无核葡萄,最多1粒葡萄果实产生5 粒种子(胚珠), 其中BA 5 mg/L 和 10mg/L处理分别为2.9 粒和 2.8粒;CCC1000mg/L和500mg/L处理平均每果粒种子(胚珠)数分别是 2.8和2.7粒;IBA10mg/L和20mg/L平均每粒种子(胚珠)数2.6;IAA10mg/L和20mg/L及NAA20mg/L处理平均每果1.0粒, 较其他处理最低。
2.6 种子催芽播种
沙藏后的种子放在28℃恒温培养箱催芽,露白后播种,有部分种子霉烂, 30 d 后统计发芽率,只有6-BA5mg/L和IBA10mg/L的处理有少量成苗,6-BA处理的得到1株苗子,IBA处理的得到2株苗子。
3.结果与讨论
Razi 等[7]在以‘Askari’בRuby Seedless’组合中发现花前7 d施用30mg/L 6-BA胚萌发率最高。Khoshandam 等[8]发现,花前14 d 和花后 7 d 2 次叶面喷施 100 mg/L 6-BA对波尔莱特杂交胚的培养效果最好;陶建敏采用几种生长素类和细胞分裂素类生长调节剂都能诱导火星无核葡萄产生种子, 得出低浓度 BA 和 KT处理效果较好,本研究采用几种生长调节剂花前处理得出低浓度的6-BA和IBA能延缓或阻碍种胚败育,为胚挽救争取时间,提高胚挽救效率。
该试验认为,花前6-BA和IBA处理可以改变昆香无核葡萄内源激素水平,延缓其胚珠败育,延长胚珠在母体内生长时间,从而提高了剥胚率和成苗率。虽然采用生长素类和细胞分裂素类生长调节剂诱导昆香无核葡萄产生的种子具有生活力和发芽力, 但效率很低。花前处理结合胚珠培养技术,可明显提高昆香种子萌发率和成苗率。