鲜食葡萄品种改良岗位
1 材料与方法
1.1 试验材料
供试材料为2010年 ‘瑞都香玉’与 ‘摩尔多瓦’杂交构建的F1代群体及亲本。该群体于2011年定植于北京市农林科学院林业果树研究所葡萄试验园内,共236株,从中随机选出160个健壮单株构建作图群体。
1.2 样品采集
于2018年对F1代群体及亲本进行果实样品采集。研究表明玫瑰香型葡萄果实单萜化合物积累从转色期开始,基于此本研究取样主要分为两个时期:转色期和成熟期。因为杂交群体各个样本的转色和成熟时间都不相同,依据往年物候期记载,转色时间主要分布在6月下旬至7月中旬,每5天对样本植株的果实成熟度进行跟踪观察,发现果实转色后(50%果粒变红或者变软)随即进行取样。果实的成熟期是根据果实种子颜色变褐状况并结合可溶性固形物含量(°Brix ≥16)进行判断。成熟时间主要分布在8月中旬至9月下旬,同转色期取样一致,每5天对果实成熟度进行观察,发现果实成熟随即进行取样。
在每一杂交株上随机选取3穗果实,每一穗从不同位置选取大约10-20个果实作为一个重复。采收后样品用液氮速冻,放入-80 ℃冰箱中冷冻保存。
两个亲本不同发育时期果实样品采集分为三个时期:幼果期(花后20d),转色期(50%果粒变红或者变软)和成熟期(°Brix ≥16),在两个亲本品种的葡萄苗上随机取3-5穗果实,每一穗从不同位置选取大约15-20个果实作为一个重复,每个时期采3个重复,采集后马上用液氮速冻,置于-80 ℃冰箱中备用。
1.3 RNA提取和cDNA合成
取大约10粒葡萄果实置于预冷的研钵中,在液氮保护条件下将葡萄碾碎、去籽去梗,磨成粉末,取1g粉末用于总RNA提取,总RNA提取采用植物RNA快速提取试剂盒(北京华越洋生物科技有限公司)来完成,提取步骤详见试剂盒说明书。RNA质量和浓度采用琼脂糖凝胶电泳和NanoDrop 3300(Eppendorf)进行检测。然后使用反转录试剂盒(Promega,A3500),参照说明书反转录成cDNA,置于-80 ℃保存备用。
1.4 实时荧光定量PCR分析
利用伯乐CFX 96实时荧光定量PCR仪(Bio-Rad,Richmond,CA)分析转录本的数量,反应体系为:10 μL SYBR Green RT-PCR Master Mix (ABI 4385612),1 μL cDNA,和0.5 μL引物,8 μL ddH2O,共20 μL。反应条件:95 ℃预变性20 s,95 ℃ 10 s,60 ℃ 31 s,进行40个循环。
基因表达相对定量分析采用2-ΔΔCT法,选取VvUbiquitin和VvGAPDH2个内参基因作为葡萄果实基因表达的参比标准。每个基因PCR扩增有3个重复。在单萜生物合成途径中7个关键基因及内参基因的引物序列参照孙磊等的合成。
1.5 单萜合成基因eQTL检测
基于已经构建好的葡萄高密度遗传图谱,采用QTL分析软件mapQTL6.0及区间作图法,进行eQTL定位和效应分析,首先通过PT检验1000次设定LOD阈值,先考虑0.99置信度对应的阈值,若没有定位区间则考虑0.95置信度对应的阈值;若没有定位区间则考虑0.90置信度的阈值。若仍没有结果则不考虑PT检验的结果,手动降低LOD阈值到3.0;若3.0没有区间则降到2.5;若2.5没有区间则降到2。确定主要eQTLs,并将eQTL连锁标记定位到基因组区域,通过Ensembl Plants(http://plants.ensembl.org/index.html)和 NCBI(https://www.ncbi.nlm.nih.gov/)数据库进行基因注释;如果在此区间内存在单萜合成基因则该eQTL为cis-eQTL,表明基因自身定位于此;如果此区段未发现单萜合成基因,则该eQTL为trans-QTL,表明该eQTL可能为该基因上游调控基因的所在位点。
1.6 基因表达芯片检测
亲本不同发育时期果实样品总RNA采用QIAGEN的Micro Kit试剂盒纯化(加入PolyA control),具体步骤参照说明书;cDNA合成使用Affymetrix one-cycle cDNA Synthesis Kit;之后采用Affymetrix Gene Chip Sample Cleanup Module进行纯化;cDNA标记使用Affymetrix Gene Chip IVT Labeling Kit,纯化使用Affymetrix Genechip Sample Cleanup Module,所有操作参考说明书。本研究所用的葡萄基因芯片为美国Affymetrix公司Vitis vinifera基因芯片(GeneChip® Vitis vinifera Genome Array)。葡萄基因芯片与样品杂交由北京中康博科技有限公司完成,具体杂交过程按照芯片杂交要求完成。芯片杂交信号数据采用GeneChip 3000 7G扫描仪进行扫描。扫描仪通过捕获荧光信号,并通过GCOS软件将信号转化,从而获得每个探针的信号值,生成CEL文件。差异表达的基因使用Ensemble plant、NCBI和Swissprot数据库进行基因注释。
1.7 数据处理与统计分析
数据统计利用分析软件Excel 2007,采用SPSS 13.0进行Spearman和pearson相关性分析,最低显著水平P<0.05;聚类分析采用MetaboAnalyst 5.0;绘图采用Sigma Plot 10.0。
2 结果与分析
2.1 杂交后代及亲本果实单萜合成途径关键基因表达遗传规律分析
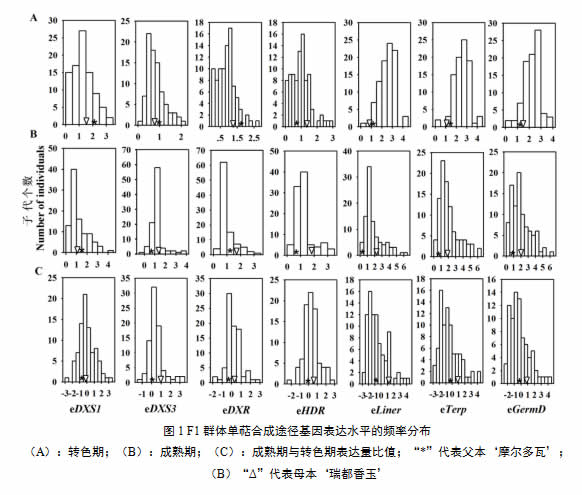
利用荧光定量PCR技术,研究了转色期和成熟期单萜合成途径关键基因VvDXS1、VvDXS3、VvDXR、VvHDR、VvLiner、VvTerp和VvGermD在亲本和F1后代群体果实中的基因表达规律。由图1A可见,在转色期,大部分单萜合成途径基因在双亲中表达并不存在明显差异,在父本‘摩尔多瓦’中的表达水平略高于母本‘瑞都香玉’。在F1群体中均表现连续的分布模式,呈现多基因控制的数量性状遗传特点。到成熟期,除了VvDXS1,大部分检测基因表达水平高于转色期,且在母本‘瑞都香玉’中的表达水平明显高于父本,在F1杂交后代中亦表现连续的分布模式(图1B)。进一步对各个基因成熟期与转色期表达量比值进行了分析,由图1C所示,在果实成熟过程中,各个基因在‘瑞都香玉’中的表达变化明显高于父本‘摩尔多瓦’,并且在F1群体中呈现连续分布数量遗传特征(图1C)。
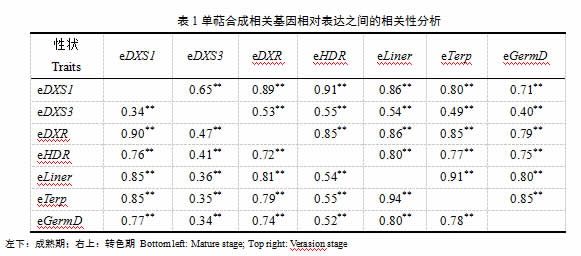
此外对这7个基因表达量之间的相关性进行了分析(表1),结果表明在两个不同的发育时期这7个单萜合成基因之间均存在显著的正相关。在转色期,各个单萜基因之间相关系数在0.40-0.91之间(表1右上);在成熟期,各个单萜基因之间相关系数在0.34-0.94之间(表1左下)。相较于其它单萜合成相关基因,VvDXS3的相关系数较低(转色期0.4-0.6;成熟期0.3-0.5),可能该基因存在不一样的调控位点。不同单萜合成途径基因之间具有非常显著的相关性,表明它们之间不是互相独立的,推测它们可能具有相同的上游调控基因。
2.2 单萜合成途径关键基因eQTL分析
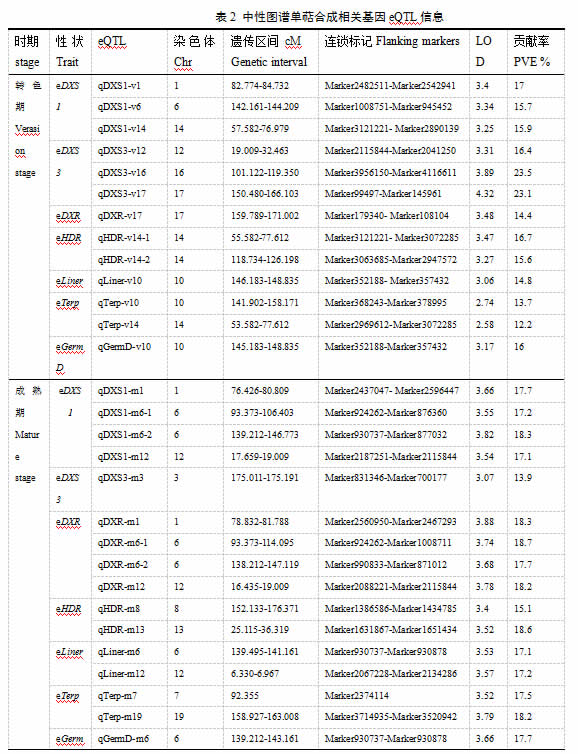
基于7个单萜合成途径基因在后代群体转色期和成熟期果实中的表达数据,利用父母本整合图谱进行了eQTL分析。由结果可知(表2),在转色期,七个基因表达性状一共定位到13个eQTLs,主要位于1号、6号、14号、16号、17号、10号和12号等染色体上,表型解释率介于12.2% - 23.5%之间。其中VvDXS1基因检测到3个eQTLs(qDXS1-v1、qDXS1-v6和qDXS1-v14),分别位于1号、6号和14号染色体,表型解释率为17%、15.7%和15.9%;VvDXS3基因也定位到3个eQTLs:qDXS3-v12、qDXS3-v16和qDXS3-v17,分别位于12号、16号和17号染色体,表型解释率介于16.4%-23.5%之间;与VvDXR基因表达量连锁的eQTL有1个(qDXR-v17),位于17号染色体上标记Marker179340和Marker108104之间,解释率为14.4%;VvHDR基因在14号染色体检测到2个eQTL(qHDR-v14-1和qHDR-v14-2),表型解释率分别为16.7%和15.6%;而三个单萜合成酶基因VvLiner、VvTerp和VvGermD均在10号染色体检测到eQTL(qLiner-v10、qTerp-v10和qGermD-v10),解释率介于13.7%和16%之间,这三个eQTL共定位到相同的遗传区间146.183-148.835 cM,说明在这个位点可能存在同时调控3个基因表达的重要基因。此外VvTerp基因还在14号染色体检测到一个eQTL(qTerp-v14),这个eQTL与qDXS1-v14和qHDR-v14-1定位到相同的遗传区间57.582-76.979 cM,说明这个位点可能与VvDXS1和VvHDR这两个基因表达相关。
在成熟期,七个基因的表达量性状数据共定位到16个eQTLs,主要位于1号、6号、12号、8号、13号、3号和19号等染色体(表2)。其中与VvDXS1和VvDXR相连锁的eQTL位于1号、6号和12号染色体,qDXS1-m1和qDXR-m1、qDXS1-m6-1和qDXR-m6-1、qDXS1-m6-2和qDXR-m6-2、qDXS1-m12和qDXR-m12均定位到相同遗传区域,该区间可能有共同的基因调控这两个基因的表达;VvDXS3相关eQTL位于3号染色体,介于Marker831346和Marker700177之间,解释率13.9%;与VvHDR表达量相关的eQTL分别位于8号(qHDR-m8)和13号(qHDR-m13)染色体;VvLiner和VvGermD基因表达量也在6号染色体定位到eQTL,说明6号染色体上存在调控单萜合成的关键基因;与VvTerp基因连锁的eQTL位于7号和19号染色体。
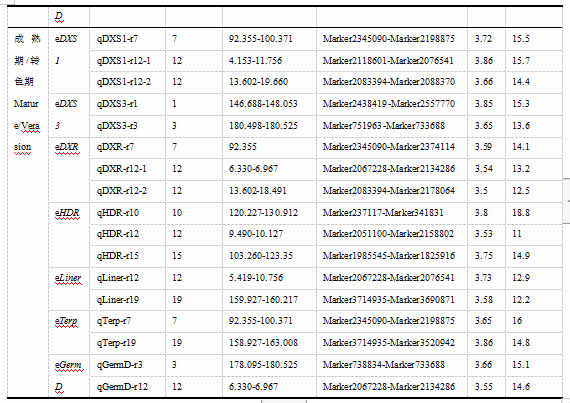
进一步以成熟期与转色期各个基因的表达量比值变化作为表型数据进行分析,在遗传图谱上,一共检测到18个eQTLs,分别位于1号、3号、7号、10号、12号、15号和19号等染色体(表2)。qDXS1-r12-1、qDXR-r12-1、qHDR-r12、qLiner-r12和qGermD-r12覆盖相同的遗传区间6.330-6.967cM,在此位点可能存在重要因子调控这些基因的表达。VvDXS3和VvGermD基因均在3号染色体检测到覆盖相同遗传区间的eQTL(qDXS3-r3和qGermD-r3);VvLiner和VvTerp这两个基因分别在19号染色体上检测到qLiner-r19和qTerp-r19,覆盖相同的遗传区间。
此外,在不同的发育时期,七个基因的表达性状检测到不同的遗传位点(表2)。在转色期与VvDXS1相连锁的eQTL位于1号、6号和14号染色体,而在成熟期检测到的eQTL主要位于1号、6号和12号染色体。但是位于6号染色体的qDXS1-m6-2与转色期eQTL位点qDXS1-v6覆盖相同遗传区间,说明在6号染色体上存在调控VvDXS1表达的基因,并且该基因可能在整个果实成熟期发挥作用。其它6个基因在2个不同发育时期并未检测到相同的遗传调控位点。
不同于传统的数量性状位点定位,表达数量性状位点分析还可以鉴定表达性状变异的调控模式即顺式作用(cis-)或反式(trans-)调控。本研究所检测的7个单萜合成途径基因VvDXS1、VvDXS3、VvDXR、VvHDR、VvTerp和VvGermD分别位于5号、4号、17号、3号、13号和18号染色体上,而VvLiner(VIT_00s0271g00060)并未锚定到任何一个染色体[1]。综合以上分析发现,并未在这七个单萜合成相关基因所分布染色体相关区域检测到连锁的eQTL,所检测到的eQTL均是trans-类型。
2.3 关键候选基因的挖掘
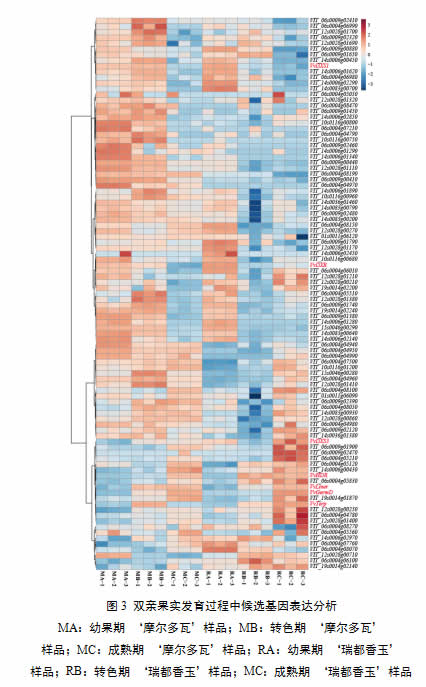
利用已公布的葡萄基因组序列信息,将与多个单萜合成基因表达量相关的eQTL位点连锁标记定位到葡萄基因组上,在对应基因组区域内提取基因,根据这些基因的功能注释分析结果,筛选区域内所有的转录因子及与萜类合成相关的基因共90个(图3)。为了进一步确定可能的候选基因,对两个亲本不同发育时期样品进行了全基因组芯片检测。将单萜合成途径基因及候选转录因子基因进行了共表达分析(图3),由结果可见,在果实发育过程中,VvDXS1和VvDXR基因在早期表达量高,后期随着果实成熟表达量降低,其中候选基因VIT_14s0006g01620和VIT_06s0004g06980等表现出相似的表达模式;其它5个单萜合成基因表达模式聚为一类,随着果实成熟表达量升高,有包含VIT_06s0004g05830等在内的10个候选基因的表达模式与之相一致(图3)。
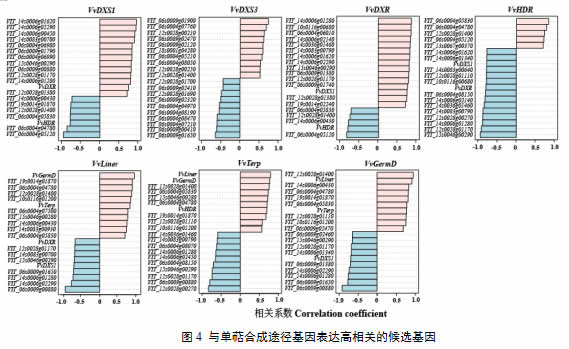
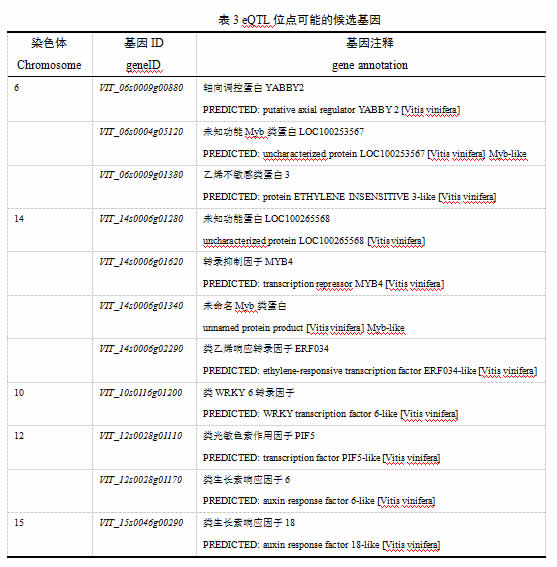
进一步依据各个基因表达量进行了Spearman相关分析,并针对每一个单萜合成基因筛选出与之表达相关度最高的20个基因(图4),与VvDXS1基因高度关联的候选基因有VIT_14s0006g01620、VIT_14s0006g02290、VIT_06s0009g00880、VIT_12s0028g01170、VIT_14s0006g01280、VIT_12s0028g01380、VIT_14s0006g00430、VIT_19s0014g01870、VIT_12s0028g01400、VIT_06s0004g05830、VIT_06s0004g04780和VIT_06s0004g05120等。其中VIT_14s0006g01620和VIT_14s0006g02290等8个基因与VvDXR和VvHDR等相关系数也较高,而VIT_14s0006g01280、VIT_12s0028g01170和VIT_06s0004g05830等这些候选基因也与单萜合成酶基因(VvLiner、VvTerp和VvGermD)的表达高度相关。但是和VvDXS3高度关联的候选基因与其它单萜合成基因表达的相关度并不高,这与eQTL定位结果相一致,可能其具有不同的调控基因位点。将高相关度基因进行两两比对分析,最终筛选出与多个单萜基因表达高度相关的潜在候选基因11个(表3),其中四个候选基因(VIT_06s0009g01380、VIT_14s0006g02290、VIT_12s0028g01170和VIT_15s0046g00290)与激素信号通路调控相关,一个候选基因(VIT_12s0028g01110)与光响应相关,还有一些编码Myb类、WRKY类转录因子和未知功能蛋白。