石家庄综合试验站
葡萄是世界第二大水果,无核葡萄更是由于食用方便、酿酒制干快捷等优势,成为产业发展及育种研究的热点。目前在葡萄无核相关基因的研究方面,发现了一些与葡萄胚发育和败育相关的基因。其中,VvAGL11、VvMADS39、VvMC1、VvHDZ28、VvHDZ13、VvWRKY20、VvGA3ox2、VvGA2ox3等基因在葡萄无核过程中与胚败育显著相关。本研究以火焰无核为试材,监测无核过程中胚珠的形态与生理指标变化,结合上述无核基因的差异表达,以期为探究无核机理、开发无核标记筛选无核种质奠定基础。
1 材料与方法
1.1 各时期葡萄胚珠材料及相关辅助数据的采集
在盛花后20d-50d内,间隔3-5d采集火焰无核的胚珠。随机选取2穗,挑选果粒大小均匀一致的果粒,剥取胚珠,测量10粒果的质量、纵横径,且随机选取一定数量胚珠称量其质量,折算为百粒胚珠重。胚珠液氮速冻,置于-80℃超低温冰箱中保存备用。
1.2 无核相关基因的表达分析
采用FinePure多糖多酚植物RNA提取试剂盒(济凡生物,北京)提取RNA,NanoDrop 2000 微量分光光度计检测RNA浓度和纯度,用Hifair® Ⅱ 1st Strand cDNA Synthesis Kit(奕圣生物,上海)将RNA反转录为cDNA,-20℃保存。根据NCBI上各基因序列,采用NCBI的Primer-BLAST在线软件设计表达引物,同时参考文献中引物,共得8对引物,由生工生物工程(上海)股份有限公司合成(表1)。
以火焰无核不同时期的cDNA为模板,葡萄Actin作为内参基因,使用ChamQ Universal SYBR qPCR Master Mix(诺唯赞,上海)进行PCR扩增。qPCR反应体系:cDNA 3μL、上下游引物各0.5μL,Mix 10μL、加灭菌双蒸水至总体积20μL。qPCR程序为:95℃ 3min;95℃ 10s,60℃ 30s,40个循环。反应结束后分析溶解曲线,每个样品3次重复。基因的相对表达量按Agilent AriaMx定量PCR仪使用说明进行分析。

2 结果与分析
2.1 火焰无核葡萄胚珠发育动态
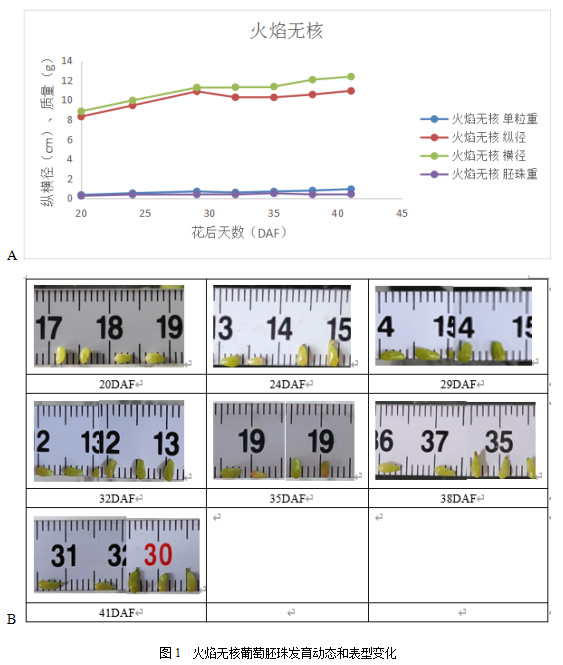
由图1A可以看出,火焰无核的粒重和胚珠质量均较小,平均粒重不超过1g,百粒胚珠质量不超过0.5g。由图1A、B可以看出火焰无核胚珠纵横径在花后20DAF-29DAF呈现较快的增长趋势,之后稍显停滞,35DAF后胚珠开始变黄、纵横径开始缓慢增加。采集胚珠时,35DAF的火焰无核胚珠开始发黄变软,41DAF时几乎全部的胚珠变黄变软变瘪。
2.2 无核相关基因在火焰无核中的表达分析
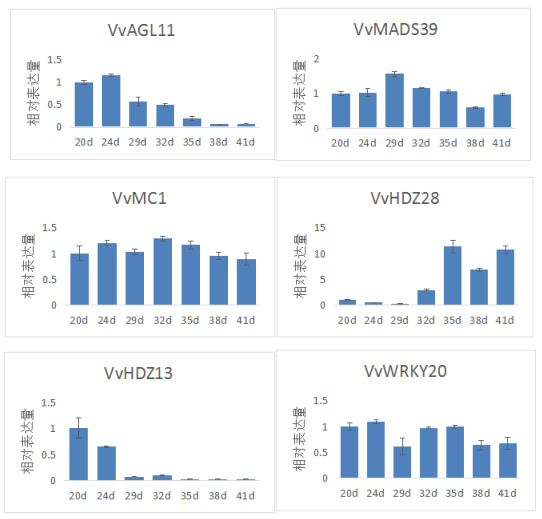
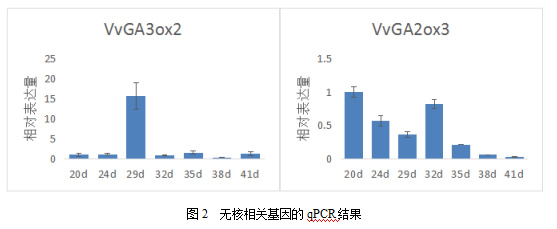
由图2可知,8个无核相关基因在火焰无核胚珠发育过程中呈现不同的表达趋势。其中,VvMADS39、VvMC1、VvWRKY20的表达量在胚珠发育的各个时期相差不大,但VvMADS39在花后29d的胚珠中表达量最高,VvWRKY20则最低。VvAGL11、VvHDZ13、VvGA2ox3随着胚珠发育表达量明显降低,其中VvAGL11、VvHDZ13在花后29d的表达量仅有花后24d表达量的1/2、1/6。VvGA3ox2只在花后29d大量表达,相对表达量到达15。VvHDZ28的表达量在花后32d开始增加,随后保持高表达。
3 讨论与结论
胚珠发育动态显示粒重和果粒纵横径在29DAF-35DAF出现停滞,胚珠质量在24DAF-32DAF增长停滞,且29DAF达到最高,可以推断火焰无核胚珠在花后29d开始败育。
基因差异表达分析结果显示,部分基因表达趋势与现有研究相近。比如,VvMADS39基因在火焰无核花后29d的胚珠中表达量最高,而后逐渐降低,与前人研究相同(王莉,2017)。但部分基因表达量及表达趋势则差异较大,如VvMC1在无核白葡萄胚珠发育10DAF-30DAF时表达趋势一致且表达量较稳定,而在胚珠发育至35DAF时VvMC1突然上调,40DAF后下调至正常水平(巩培杰,2013),本研究中VvMC1的表达量则一直较平稳,表达差异不明显。因此推测,现有的无核相关基因可能具有一定的品种特异性。