病毒病防控岗位
胡国君 张尊平 范旭东 任芳 董雅凤
沙地葡萄茎痘伴随病毒(grapevine rupestris stem pitting- associated virus,GRSPaV)GRSPaV隶属于β线性病毒科(Betaflexiviridae)凹陷病毒属(Foveavirus),基因组全长约8.7bp,3′末端含聚合A尾,含有5个开放阅读框(open reading frames,ORFs)。该病毒为韧皮部限制性病毒,主要通过嫁接传播。研究发现,GRSPaV的基因组具有广泛的遗传多样性,存在大量的分子变种。大量分子变种的存在给GRSPaV的检测效率造成严重影响。建立准确、高效、低成本的GRSPaV检测技术体系需求迫切。本研究在GRSPaV的两个基因上同时进行巢式扩增,通过体系优化,建立双重巢式RT-PCR检测方法,以期在保证GRSPaV检测效率的基础上,降低检测成本,为该病毒病的防控提供技术支撑。
1 材料与方法
1.1 供试材料
感染GRSPaV的葡萄样品京秀、达米娜、里扎马特和87-1以及阴性对照无毒贝达砧木葡萄均采自中国农业科学院果树研究所国家落叶果树脱毒中心的保存圃。供检样品为实验室保存的84份葡萄样品的试管苗和25份田间葡萄样品。
1.2 试剂
Taq DNA聚合酶、dNTPs和大肠杆菌感受态细胞 DH5α等,购自宝生物工程(大连)有限公司;莫洛尼鼠白血病病毒(maloney-Murine leukemia virus,M-MLV),购自普洛麦格(北京)生物技术有限公司;胶回收纯化试剂盒,购自爱思进公司(Axygen);pTOPO-TA Vector载体,购自北京艾德莱生物科技有限公司;gel red核酸染料,购自Biotium公司;其它试剂均为国产分析纯;引物由生工生物工程(上海)股份有限公司合成。
1.3 引物设计
参照NCBI上的GRSPaV全基因组序列(105条),设计了2组巢式扩增引物:repF1R1→repF2R2和cpF1R1→cpF2R2(表1)。
1.4 扩增片段的克隆转化和测序分析
将引物组合repF1R1→repF2R2和cpF1R1→cpF2R2的扩增产物分别进行回收纯化,连接到载体pTOPO-TA Vector上,然后转化到大肠杆菌感受态细胞DH5α中。挑选单一的菌落进行摇菌,并进行菌液PCR验证,最后挑选阳性克隆送北京诺赛基因组研究中心有限公司进行测序。
1.5 总RNA提取
取0.05-0.1 g葡萄叶片放入塑料袋中,加入1 mL裂解液研磨,将匀浆转入已加入150 μL 10% N-lauroylsarcosine (NLS) 的1.5 ml离心管中,参照胡国君等[16]的方法进行总RNA的提取。
1.6 cDNA合成
取上述总RNA 3 μL、6碱基随机引物1 μL、DEPC处理去离子水6 μL于一离心管中,混匀后在沸水中变性6 min,然后放冰上3 min。向上述溶液中依次加入:5× RT buffer 2 μL、dNTPs(10 mmol/L)1 μL、M-MLV(200U/µl)0.5 μL,用水补足总体系为20 μL。将上述溶液混匀后42℃ 10min,37℃ 50 min,70℃灭活5 min,冰上3 min,置于-20℃备用。
1.7 普通PCR 扩增
取上述cDNA模板2 μL 加到如下PCR扩增体系中:10× PCR buffer 2.5 μL,dNTPs (2.5 mmol/L each)0.5 μL,RSP 52/53(或RSP 9F/9R)(10 μmol/L)各0.5 μL,Taq DNA聚合酶(5 U/μL)0.125 μL,最后加水定容至25 μL。
引物RSP52/53扩增程序为:94 ℃预变性3 min;94 ℃ 30 s,53 ℃ 40 s,72 ℃ 50 s,共35个循环;72 ℃ 10 min。
引物RSP9P/9R扩增程序为:94 ℃预变性3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 40 s,共35个循环;72 ℃ 10 min。
扩增结束后取6 μL PCR产物和1 μL 6× Loading buffer(含gel red染料)在1.2%的琼脂糖凝胶中进行分离,在BIO-RAD凝胶成像系统中,观察扩增结果。
1.8 单一巢式PCR扩增
第1轮PCR扩增体系:取合成的cDNA 2 μL,依次加入10× PCR buffer 2.5 μL、dNTPs(2.5 mmol/L each)0.5 μL、引物repF1/R1或cpF1/R1(10 μmol/L)各0.5 μL、Taq DNA聚合酶(5 U/μL)0.125 μL,加水定容至25 μL。
引物repF1/R1扩增程序:95 ℃预变性3 min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 40 s,共30个循环,72 ℃延伸 7 min。
引物cpF1/R1扩增程序:95 ℃预变性3 min,变性94 ℃ 30 s,退火55 ℃ 40 s,延伸72 ℃ 50 s,共30个循环,72 ℃延伸 7 min。
第2轮PCR扩增体系:以第1轮PCR扩增的产物为模板,用量为1 μL,依次加入10× PCR buffer 2.5 μL、dNTPs(2.5 mmol/L each)0.5 μL、引物repF2/R2或cpF2R2(10 μmol/L)各0.5 μL、Taq DNA聚合酶(5 U/μL)0.125 μL,定容至25 μL。
引物repF2/R2扩增程序:95 ℃预变性3 min,变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 40 s,共35个循环,72 ℃延伸 7 min。
引物cpF2R2扩增程序:95 ℃预变性3 min,变性94 ℃ 30 s,退火57 ℃ 40 s,延伸72 ℃ 50 s,共35个循环,72 ℃延伸 7 min。
第2轮扩增结束后进行琼脂糖凝胶电泳。
1.9 双重巢式PCR扩增及反应条件优化
第1轮PCR体系:cDNA、10× PCR Buffer 2.5 μL、2.5 mmol/L dNTPs、引物组合repF1/R1-cpF1R1(10 μmol/L)、Taq DNA聚合酶(5 U/ μL),定容至25 μL。其中,引物组合repF1/R1-cpF1/R1设置0.2/0.2-0.6/0.6、0.4/0.4-0.4/0.4和0.6/0.6-0.2/0.2 μL 3个用量,dNTPs设置1.0、0.7和0.4 μL 3个用量,Taq DNA聚合酶设置0.25、0.15和0.05 μL 3个用量,cDNA设置4.0、3.0和2.0 μL 3个用量。
引物组合repF1/R1-cpF1R1扩增程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 50 s,共30个循环;72 ℃ 10 min。
第2轮PCR体系:以第1轮PCR扩增产物为模板,用量为1 μL,其余成分为10× PCR Buffer 2.5 μL、2.5 mmol/L dNTPs、引物组合repF2/R2-cpF2R2(10 μmol/L)、Taq DNA聚合酶(5 U/ μL),定容至25 μL。其中引物组合repF2/R2-cpF2R2设置0.3/0.3-0.3/0.3、0.2/0.2-0.4/0.4和0.4/0.4-0.2/0.2 μL 3个用量,dNTPs设置1.0、0.75和0.5 μL 3个用量,Taq DNA聚合酶设置0.25、0.15和0.05 μL 3个用量。
引物组合repF2/R2-cpF2R2扩增程序:94 ℃预变性3 min;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 50 s,共35个循环;72 ℃ 10 min。
第2轮扩增结束后进行琼脂糖凝胶电泳。
1.10 检测效果比较
利用普通RT-PCR、单一巢式RT-PCR和双重巢式RT-PCR分别对84份葡萄试管苗进行检测。
2 结果与分析
2.1 引物的验证
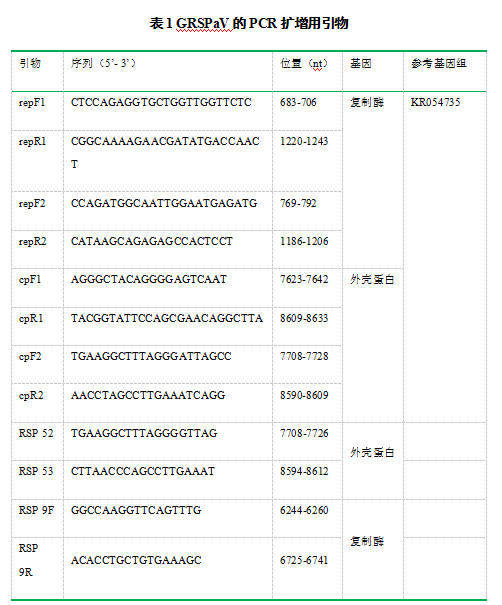
由图1可以看出,所设计的2组巢式引物repF1R1→repF2R2和cpF1R1→cpF2R2均能在阳性样品中扩增出单一、且与预期片段大小一致的条带,而阴性对照中没有扩增条带。将扩增产物进行克隆转化及测序分析,并将获得的病毒序列在NCBI数据库进行BLAST比对。结果显示,巢式引物repF1R1→repF2R2和cpF1R1→cpF2R2分别特异性的扩增GRSPaV复制酶和外壳蛋白基因序列,片段的大小分别为902bp和438bp。
2.2 双重巢式PCR扩增中第1轮PCR体系的优化
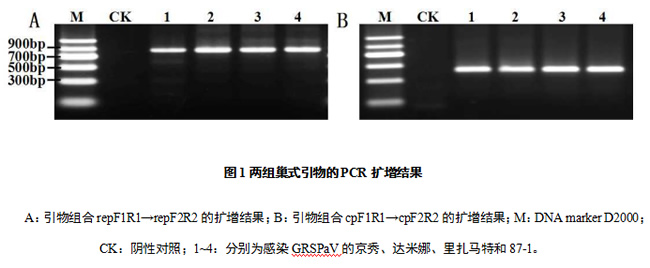
分别对引物、dNTPs、Taq DNA聚合酶和cDNA的用量进行优化,结果显示,引物组合repF1/R1-cpF1R1的用量(10 μmol/L)为0.4/0.4-0.4/0.4 μL、2.5 mmol/L dNTPs的用量为0.7 μL、5 U/ μL Taq DNA聚合酶的用量为0.05 μL、cDNA的用量为2 μL时,第2轮扩增效果最佳。
2.3 双重巢式PCR扩增中第2轮PCR体系的优化
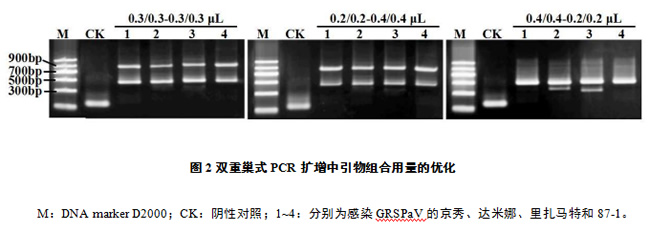
分别对引物、dNTPs和Taq DNA聚合酶的用量进行优化,结果显示,引物组合repF2/R2-cpF2R2的用量(10 μmol/L)为0.3/0.3-0.3/0.3 μL(图2),2.5 mmol/L dNTPs的用量为1.0 μL、5 U/ μL Taq DNA聚合酶的用量为0.25 μL时(表2),扩增产物无杂带干扰,琼脂糖凝胶中出现两条清晰的条带,且两条带的亮度一致。
2.4 检测效果比较
分别采用普通、单一巢式和双重巢式RT-PCR对葡萄试管苗样品进行病毒检测,结果显示,两对普通引物RSP52/53和RSP9F/R对GRSPaV的检出率均为51.4%,合计为65.1%;两对巢式引物repF1R1→repF2R2和cpF1R1→cpF2R2对GRSPaV的检出率分别为88.1%和80.7%,总和为93.6%;而双重巢式引物组合repF1R1-cpF1R1→repF2R2-cpF2R2对GRSPaV的检出率与两个单一巢式RT-PCR的检测率总和一致,较两个普通RT-PCR的总和提高28%。