南疆综合试验站
白世践 户金鸽 赵荣华 陈光 古丽加汗·克然木 蔡军社
葡萄是世界上栽培最早、分布最广的果树之一,我国葡萄栽培面积和产量分居世界第三位和第一位。‘新郁’葡萄是我国自主培育的优良鲜食葡萄品种,其亲本为‘红地球’自然杂交后代E42-6×里扎马特,该品种穗型美观,果粒大,鲜红-紫红色,肉脆味甜,贮运性能较好,栽培适应性强,因栽培经济效益好,栽培面积不断扩大。在西北干旱区种植的‘新郁’葡萄因生育期光照辐射强,常导致着色过深,降低了外观品质及商品性。亟需通过栽培措施优化生育期果际光环境,改善果实色泽,提高品质。
套袋是优质葡萄生产过程中的重要环节,套袋可以防止鸟类、昆虫对果实的危害,同时阻碍病菌、灰尘、农药的侵染,保持果面的清洁和果粉的完整,葡萄着色更均匀,套袋生产的葡萄更为绿色、安全、优质。套袋通过改变果实生长发育的微环境对品质产生影响[4]。光照条件改变是套袋引起果实品质变化的重要因素,光可作为一种重要的信号激发植物体内的光受体,调节植物的形态建成、光周期反应与生理节律,并与植物体内的ABA、乙烯等其他信号分子相互协作,共同调控。不同光质通过与特定的色素互作来影响植物次生代谢物的合成,如光敏色素吸收红光、远红光,而隐花色素和向光素吸收的是紫外光和蓝光[7-8]。大量研究证实,果实品质中的糖、酸及花色苷含量均受到光条件的影响,如葡萄套袋后造成的弱光胁迫会降低可溶性固形物含量,导致葡萄着色不完全,延迟成熟,而去袋后果实色泽和可溶性固形物含量可迅速恢复正常蓝光能够显著增加赤霞珠葡萄锦葵色素-3-O-葡萄糖苷和芍药花素-3-O-葡萄糖苷、醇类和酚类挥发性物质及可溶性糖中的葡萄糖、果糖含量,降低柠檬酸和苹果酸含量。光能够通过调控花色苷合成相关结构基因和调控基因的表达来调控花色苷的积累,如太阳紫外光照射能够诱导‘Tempra-nillo’葡萄花色苷合成途径中的PAL、CHS、C4H、FLS1、VvGT5、VvGT6、VvMYB24、VvMYBF1等多个基因上调表达;不同颜色果袋通过影响光信号转录因子VvHY5的表达,进而调控花青苷合成调控基因VvMYBA1和结构基因VvCHS、VvLDOX、VvUFGT等的表达,影响葡萄果皮花色苷的合成 [15]。
西北干旱区葡萄园光照辐射强,容易造成‘新郁’葡萄着色过深,关于不同颜色果袋对西北干旱区‘新郁’葡萄果实品质及着色的调控研究未见报道。本研究拟采用不同颜色果袋(红、黄、蓝、绿、白)对‘新郁’葡萄进行套袋,以不套袋为对照,分析不同颜色果袋引起的光环境差异对‘新郁’葡萄果实品质及着色的影响,旨在为生产优质‘新郁’葡萄果袋的选择提供依据。
1 材料与方法
1.1 试验材料
试验于2021年在新疆维吾尔自治区葡萄瓜果研究所葡萄栽培示范基地(42°91′ N,90°30′ E)进行。试验地海拔419 m,年降雨量25.3 mm,年蒸发量2 751 mm,全年日照时数3 122.8 h,10℃以上有效积温4 525℃以上,无霜期192 d,属于典型的大陆性暖温带荒漠气候,为极端干旱区气候类型。土壤质地为砾石沙壤土。供试材料为长势一致的5 a生欧亚种(Vitis vinifera L.)鲜食葡‘新郁’,采用顺行龙干+(V+水平)叶幕模式栽培,东西行向,株行距2.0 m×3.5 m,新梢间距15 cm,单株果穗数20~24穗,豆果期疏去穗尖和副穗,疏果至单穗果粒数80左右。田间水肥和病虫害防治常规管理。
1.2 试验设计及样品采集
花后30 d(2021年6月20日)进行套袋处理。连续4株为一个小区,统一选取南面大小一致的果穗进行不同颜色果袋(红色、黄色、蓝色、绿色、白色)套袋,以不套袋为对照,果袋下端开口以保证各颜色果袋内温、湿度与环境一致,每种颜色果袋每小区随机套6穗,3次重复,共18个果穗。果实采收期(8月12日)统一带袋采收,从每小区果穗的上、中、下部位随机取样,每穗取15粒,共90粒,混匀均分成3份,2份用于常规理化指标测定,另1份用手术刀片剥取果皮,液氮速冻后存于-80℃,供花色苷单体测定。3次重复。
1.3 测定指标及方法
1.3.1果袋内光谱测定
使用Uni Spec-SC单通道便携式光谱测定仪(PP SYSTEMS,USA)测定不同颜色果袋内的透射光谱,测定时间为上午11:30。
1.3.2果实品质指标测定
果穗质量、果粒质量采用电子天平称量;果粒纵径、横径及果柄粗度、果刷长度采用游标卡尺测量;果实耐压力采用GY-4型数显果实硬度计(托普仪器,中国浙江)测定;果柄耐拉力采用NK-50型数显推拉力计(Algol仪器,中国台湾)测定;用CR-400手持色差计(Konica Minolta,日本) 测定每个果实赤道部位的色泽指标L*(亮度)、a*(红绿色差)、b*(黄蓝色差)。计算出色泽饱和度(chroma,C*)、色调角(hue angle,h°)和葡萄果实色泽指数( color index of red grape , CIRG ),其中C*=[ a*2+ b*2] 1/2,h°=arctangent(b*/ a*),CIRG =(180–h°)/(L*+C*),果实外观色泽的标准为:CIRG<2 为黄绿,2<CIRG<4 为粉红,4<CIRG<5 为红色,5<CIRG<6 为深红,CIRG>6为蓝黑色。以上果粒相关指标均读取30个数据。
新鲜葡萄榨汁,采用PAL-1型手持数显折射仪(Atago, Tokyo, Japan)测定可溶性固形物(total soluble solid, TSS);可滴定酸(titratable acidity, TA)采用0.05 mol·L -1 NaOH滴定法测定;维生素C(VC)含量采用钼蓝比色法测定。以上指标每个样品平行测定3次。固酸比(TSS/TA)为可溶性固形物含量与可滴定酸含量的比值。
1.3.3 花色苷单体测定
果皮液氮速冻后真空冷冻干燥,利用球磨仪研磨(30 Hz,1.5 min)至粉末状,称取50 mg的粉末溶解于500 μL提取液(50%的甲醇水溶液,含0.1%盐酸)中,涡旋10 min,超声10 min,离心(转速12,000 r/min,30 min),吸取上清液,重复操作1次,合并两次上清液,用微孔滤膜(0.22 μm pore size)过滤样品,并保存于进样瓶中,用于LCMS/MS分析。
采用超高效液相色谱(Ultra Performance Liqiud Chromatography, UPLC)和串联质谱(Tandem Mass Spectrometry, MS/MS)进行样品定性定量分析。
液相条件主要包括:色谱柱:ACQUITY BEH C18 1.7 μm,2.1 mm*100 mm;流动相:A相为超纯水(加入0.1%的甲酸),B相为甲醇(加入0.1%的甲酸);洗脱梯度:0.00 min B相比例为5%,6.00 min增至50%,12.00 min增至95%,保持2 min,14 min降至5%,并平衡2 min;流速0.35 ml/min;柱温40℃;进样量2 μL。
质谱条件主要包括:电喷雾离子源(Electospray Ionization,ESI)温度550℃,正离子模式下质谱电压5500 V,气帘气(Curtain Gas,CUR)35 psi。在Q-Trap 6500+中,每个离子对是根据优化的去簇电压(Declustering Potential,DP)和碰撞能(Collision Energy,CE)进行扫描检测。
基于标准品构建MWDB (Metware Database)数据库,对质谱检测的数据进行定性分析;利用三重四级杆质谱的多反应监测模式(Multiple Reaction Monitoring, MRM)完成定量分析;利用软件Analyst1.6.3处理质谱数据。
1.4 数据处理
用Microsoft Excel 2007 软件整理数据及绘制光谱分布特征图,用Origin 8.0软件绘制相关性热图;用SPSS 25.0软件进行统计分析,单因素方差(ANOVA)分析采用Duncan’s法,差异显著性定义为P<0.05。
2 结果与分析
2.1 不同颜色果袋内光谱特征
不同颜色果袋内及对照光谱分布存在明显差异,果袋均不同程度降低了各波段辐射强度,果袋相比对照对700~930 nm波段辐射强度降幅最大,白袋、红袋和黄袋主、次峰值波长与对照基本一致,蓝袋和绿袋次峰不明显,绿袋主峰值波长出现明显偏移,主峰值(辐射强度)大小顺序为对照>白袋>红袋>黄袋>蓝袋>绿袋(图1)。
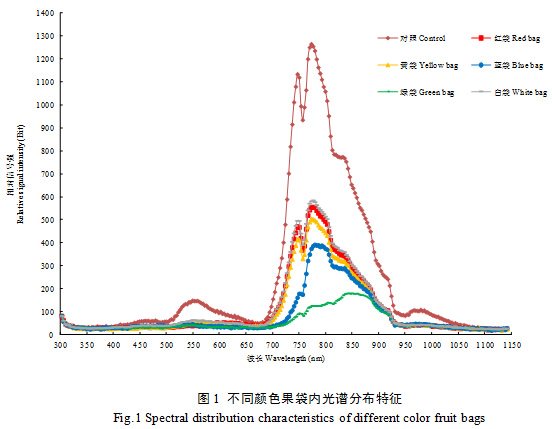
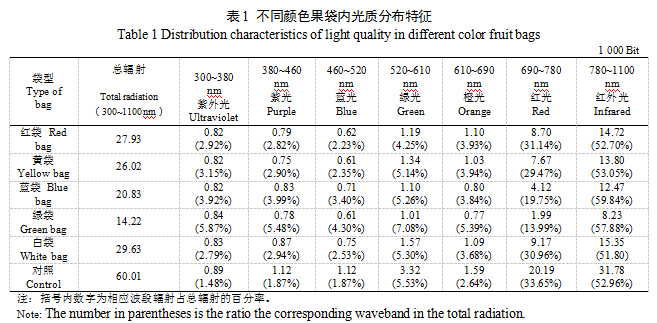
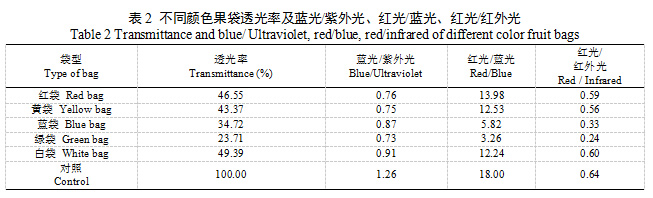
不同颜色果袋相比对照总辐射及透光率均明显降低,大小顺序均为对照>白袋>红袋>黄袋>蓝袋>绿袋,且不同颜色果袋各波段光辐射强度较对照均降低,红光、红外光降幅最大,降幅均在50%以上。各颜色果袋紫外光辐射强度差异不大,蓝袋和白袋紫光、蓝光辐射强度大于其他果袋,黄袋和白袋绿光辐射强度大于其他果袋,蓝袋和绿袋橙光、红光辐射强度小于其他果袋,绿袋红外光辐射强度最小。5种颜色果袋均增大了紫外光、紫光、蓝光和橙光的比例,其中绿袋和蓝袋紫外光、紫光、蓝光增幅均较大,绿袋橙光增幅最大;红袋降低了绿光占比,绿袋则增大了绿光占比;蓝袋和绿袋大幅降低了红光占比,占比仅19.75%和13.99%,提高了红外光的占比。不同颜色果袋均降低了蓝光/紫外光值、红光/蓝光值和红光/红外光值,蓝袋和白袋蓝光/紫外光值较大,蓝袋和绿袋红光/蓝光值和红光/红外光值较小(表1、表2)。可见,不同颜色果袋内光强和光质分布有较大差异,果袋均不同程度降低了袋内总辐射,蓝袋和绿袋对橙光、红光和红外光透过性较差,大幅降低了红光的占比。
2.2 不同颜色果袋对‘新郁’葡萄果实品质的影响
2.2.1 果穗、果粒性状
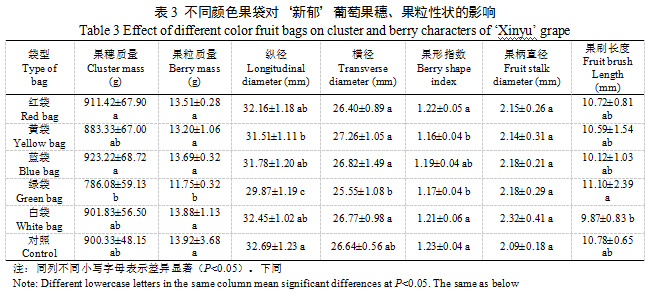
绿袋果粒质量及纵、横径最小,显著小于其他颜色果袋及对照,果粒质量(11.75 g)相比对照减小15.59%,且果穗质量显著小于红袋和蓝袋;黄袋纵径显著小于对照,降幅3.61%;果形指数以黄袋和绿袋最小,显著小于其他颜色果袋及对照。不同颜色果袋及对照的葡萄果柄直径无明显差异,绿袋果刷长度显著大于白袋(表3)。可见,绿袋减小‘新郁’果粒质量及果形指数,略增大了果刷长度,黄袋减小了果形指数,白袋略减小了果刷长度。
2.2.2 果实理化指标
白袋相比对照果柄耐拉力显著减小,减幅22.37%,黄袋、红袋和白袋相比对照果实耐压力显著减小,减幅21.07%、9.92%和9.92%。不同颜色果袋果实可溶性固形物含量较对照均显著减小,以蓝袋和绿袋最小,较对照分别减小19.25%和19.06%,黄袋、红袋和白袋较对照分别减小13.80%、11.53%和9.79%;绿袋可滴定酸含量相比对照显著增大,增幅13.95%,其他颜色果袋与对照差异均不显著;白袋固酸比与对照差异不显著,其他颜色果袋固酸比均显著小于对照,以绿袋和蓝袋最小,相比对照减幅29.55%和23.54%,红袋和黄袋减幅16.21%和13.79%。绿袋相比对照维生素C含量显著增大,而红袋则显著减小,其他颜色果袋与对照差异均无明显差异(表4)。可见,白袋对‘新郁’葡萄理化指标的影响最小,其次是红袋和黄袋,蓝袋和绿袋对‘新郁’葡萄内在品质产生了较大的负面影响。
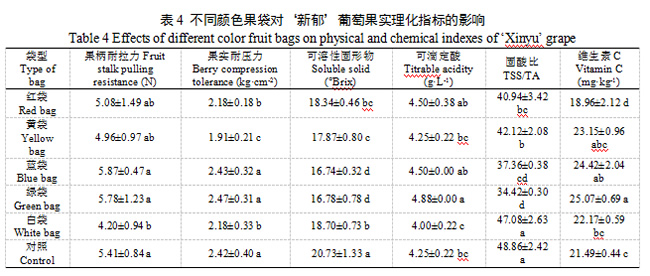
2.2.3 果实色泽
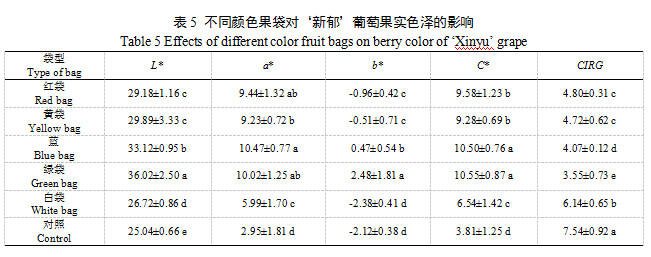
L*代表色泽的亮度,不同颜色果袋均显著增大了‘新郁’葡萄L*值,增大了葡萄亮度,其中绿袋最大,其次是蓝袋,白袋与对照L*值差异最小,亮度最接近;a*值代表红绿色差,5中颜色果袋的a*值显著大于对照,且红袋、黄袋、蓝袋和绿袋的a*值显著大于白袋和对照,说明这四种果袋的葡萄红色调较深,而白袋和对照红色较浅;b*值代表黄蓝色差,b*为负值时表示蓝色,数值越小表示蓝色越深,表明葡萄着色越深,白袋和对照b*值最小,显著小于其他果袋,表明二者着色最深,绿袋和蓝袋b*为正值,表明二者着色最浅。C*代表色泽饱和度(彩度),对照C*值最小,饱和度最小,其次是白袋,其他颜色果袋葡萄具有较高的饱和度,说明套袋后的果实更加鲜艳。对照CIRG值显著大于不同颜色果袋,葡萄着色过深,白袋CIRG>6,葡萄也存在着色过深现象,绿袋葡萄为粉红色,蓝袋、红袋和黄袋葡萄为红色,但红袋和黄葡萄CIRG值显著大于蓝袋,着色最好(表5)。可见,白袋存在着色过深的问题,而蓝袋和绿袋着色不良,从色泽指标上看,红袋和黄袋着色最好。
2.3 不同颜色果袋对‘新郁’葡萄果皮花色苷组成的影响
2.3.1 果皮花色苷组分及含量
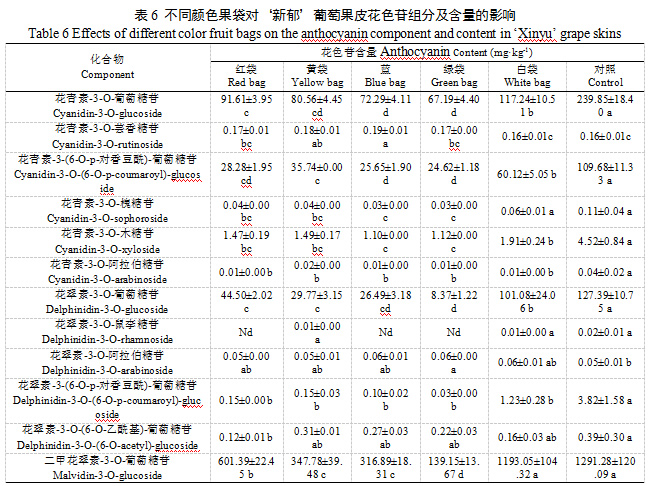
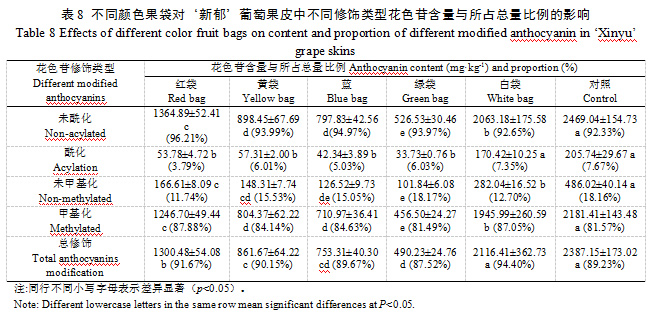
成熟‘新郁’葡萄果皮中共检测到27种花色苷。白袋和对照均检测到27种花色苷,红袋检测到25种花色苷(未检测到花翠素-3-O-鼠李糖苷和甲基花翠素-3-O-阿拉伯糖苷),黄袋检测到25种花色苷(未检测到二甲花翠素-3-O-(6''-乙酰基葡萄糖苷)-5-葡萄糖苷和甲基花翠素-3-O-阿拉伯糖苷),蓝袋检测到24种花色苷(未检测到花翠素-3-O-鼠李糖苷、二甲花翠素-3-O-(6''-乙酰基葡萄糖苷)-5-葡萄糖苷和甲基花翠素-3-O-阿拉伯糖苷),绿袋检测到23中花色苷(未检测到花翠素-3-O-鼠李糖苷、二甲花翠素-3-O-(6''-乙酰基葡萄糖苷)-5-葡萄糖苷、二甲花翠素-3-O-(6-O-丙二酰-β-D-葡萄糖苷)和甲基花翠素-3-O-阿拉伯糖苷)。不同颜色果袋及对照‘新郁’葡萄果皮含量较大的花色苷均为二甲花翠素-3-O-葡萄糖苷、甲基花青素-3-O-葡萄糖苷、花青素-3-O-葡萄糖苷、花翠素-3-O-葡萄糖苷、花青素-3-(6-O-p-对香豆酰)-葡萄糖苷、甲基花青素-3-(6-O-p-对香豆酰)-葡萄糖苷、甲基花翠素-3-O-葡萄糖苷等7种。其中,含量最大的二甲花翠素-3-O-葡萄糖苷以对照和白袋最大,显著大于其他颜色果袋,且二者无显著差异,红袋、黄袋、蓝袋和绿袋相比对照分别降低56.03%、73.07%、75.46%和89.22%;含量较大的甲基花青素-3-O-葡萄糖苷以对照最大,其次是红袋,白袋次之,红袋、白袋、黄袋、蓝袋和绿袋较对照分别降低15.74%、21.14%、40.74%、48.46%和55.78%;其他5种含量较大的花色苷基本呈对照>白袋>红袋>黄袋>蓝袋>绿袋的趋势;总花色苷含量大小顺序为对照>白袋>红袋>黄袋=蓝袋>绿袋,白袋、红袋、黄袋、蓝袋和绿袋总花色苷含量较对照分别降低16.49%、46.96%、64.27%、68.59%和79.05%(表6)。可见,套袋均不同程度降低了‘新郁’葡萄果皮中总花色苷及各主要花色苷单体含量,同时也会减少花色苷单体种类,白袋影响相对较小,绿袋影响最大,而黄袋跟蓝袋的影响效果较一致。
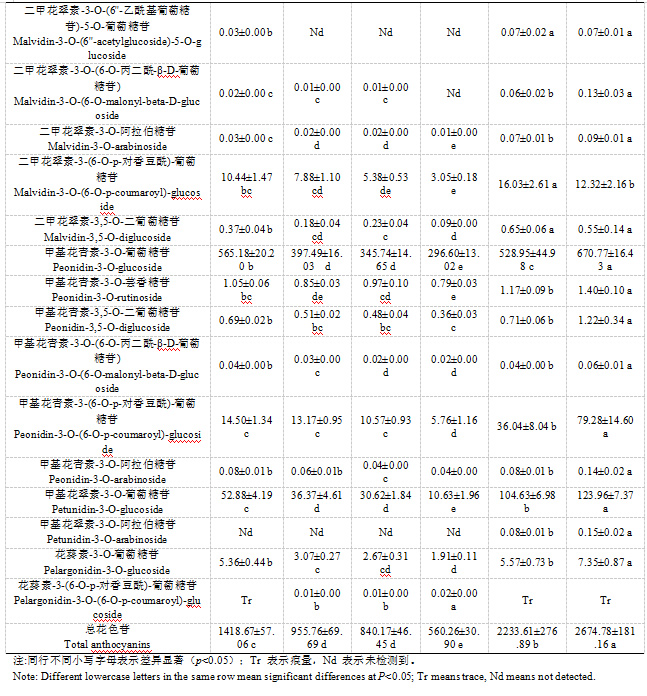
2.3.2各类花色苷组成比例
成熟‘新郁’葡萄果皮中主要包括二甲基花翠素类、甲基花青素类、花青素类、花翠素类和甲基花翠素类花色苷,花葵素类花色苷含量极少。除白袋与对照二甲基花翠素类花色苷含量无显著差异外,套袋均不同程度降低了各类型花色苷含量,不同果袋各类型花色苷含量大小顺序基本呈对照>白袋>红袋>黄袋>蓝袋>绿袋的趋势。红袋、黄袋和蓝袋间花青素类花色苷和花翠素类花色苷含量差异均较小,未表现出明显差异;黄袋和蓝袋间甲基花翠素类花色苷、二甲基花翠素类花色苷和花葵素类花色苷含量差异均较小,未表现出明显差异;蓝袋和绿袋间花青素类花色苷、花翠素类花色苷及花葵素类花色苷差异均较小,未表现出明显差异,说明不同颜色果袋对某些类型花色苷含量的影响结果一致。白袋、红袋、黄袋和蓝袋相比对照均降低了花青素类花色苷的占比,以白袋和红袋降幅最大,分别降低5.10%和4.66%,而绿袋花青素类花色苷占比则提高了3.39%;白袋相比对照甲基花青素类花色苷占比降低2.40%,其他颜色果袋则提高12.80%~26.01%;不同颜色果袋相比对照花翠素类花色苷占比降低了0.37%~3.88%;白袋相比对照甲基花翠素类花色苷占比提高0.05%,其他颜色果袋则降低0.86~2.75%;白袋相比对照二甲基花翠素类花色苷占比提高7.83%,其他颜色果袋则降低5.56~23.36%;白袋比相比对照花葵素类花色苷占比降低0.02%,其他颜色果袋则提高0.05%~0.11%(表7)。除白袋3’5’-羟基取代类花色苷含量与对照未表现出明显差异外,套袋相比对照均显著降低了3’-羟基取代类和3’5’-羟基取代类花色苷含量,蓝袋和绿袋3’-羟基取代类花色苷含量无显著差异,黄袋与蓝袋3’5’-羟基取代类花色苷含量无显著差异,说明不同颜色果袋对某些类型花色苷含量的影响结果一致。白袋相比对照3’-羟基取代类花色苷占比降低了7.49%,而3’5’-羟基取代类花色苷占比提高7.25%,其他颜色果袋则3’-羟基取代类花色苷占比提高8.15%~29.41%,3’5’-羟基取代类花色苷占比降低8.25%~29.47%。可见,套袋不仅改变了‘新郁’葡萄果皮中各类型花色苷含量,还会改变各类型花色苷占比。白袋能够提高花翠素类(3’5’-羟基取代)花色苷占比,降低花青素类(3’-羟基取代)及花葵素类花色苷占比;其他颜色果袋则会提高花青素类(3’-羟基取代)及花葵素类花色苷占比,降低花翠素类(3’5’-羟基取代)花色苷占比。白袋及对照总花色苷含量高及花翠素类(3’5’-羟基取代)花色苷占比大是引起‘新郁’葡萄着色过深的主要原因。
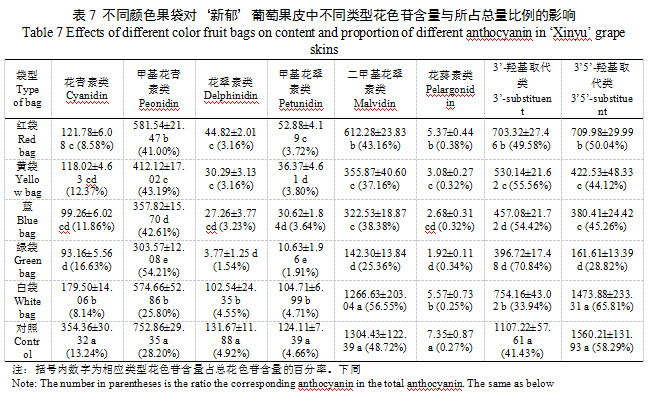
白袋酰化修饰花色苷含量与对照未表现出明显差异,红袋、黄袋、蓝袋和绿袋均显著降低酰化修饰类型花色苷含量,且4种颜色果袋间差异均未达显著水平,酰化修饰类花色苷占比降低1.64%~3.88%;套袋降相比对照显著降低甲基化修饰类型花色苷含量,大小顺序为对照>白袋>红袋>黄袋=蓝袋>绿袋,白袋、红袋、黄袋和蓝袋相比对照甲基化修饰花色苷占比提高2.57%~6.31%,绿袋则与对照差异不大;白袋与对照总修饰类花色苷含量无显著差异,其他果袋均显著降低总修饰类花色苷含量,整体呈红袋>黄袋>蓝袋>绿袋的趋势,蓝袋与对照总修饰类花色苷占比差异不大,绿袋则降低1.71%,白袋、红袋和黄袋则分别提高5.17%、2.44%和0.92%。可见,白袋对‘新郁’葡萄果皮中酰化、总修饰类花色苷含量无明显影响,但会降低甲基化修饰类花色苷含量,而红袋、黄袋、蓝袋和绿袋均会显著降低酰化及甲基化花色苷含量。5种颜色果袋均降低了酰化修饰类花色苷占比,白袋、红袋、黄袋和蓝袋提高了甲基化修饰花色苷占比;绿袋降低了总修饰类花色苷占比,白袋、红袋和黄袋则提高了总修饰类花色苷占比。
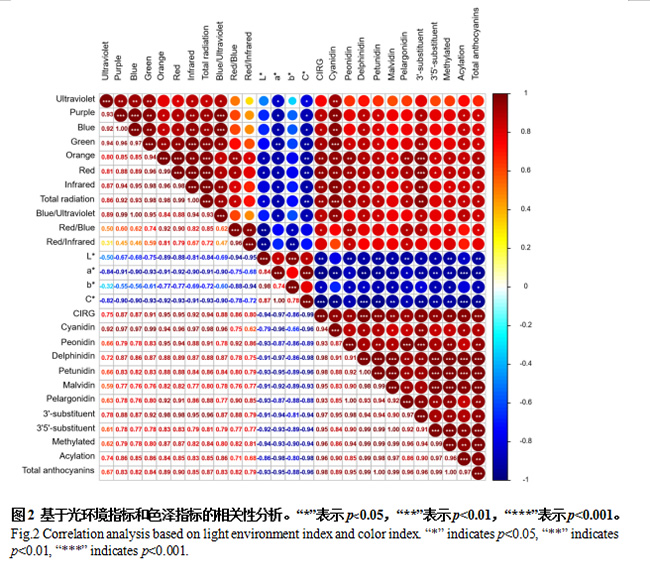
2.4 基于光环境指标和色泽指标的相关性分析
光环境指标与果实色泽指标L*、a*、b*、C*值之间基本呈负相关,而与果实色泽指标CIRG值、果皮各类型花色苷含量、总花色苷含量之间呈正相关。L*值与红光/蓝光值、红光/红外光值呈极显著负相关,a*值与绿光辐射强度呈极显著负相关,b*值与红光/红外光值呈极显著负相关),C*值与绿光、橙光、红光辐射强度及总辐射呈极显著负相关)。CIRG值与橙光、红光、红外光辐射强度及总辐射呈极显著正相关;花青素类花色苷含量与绿光辐射强度和总辐射呈极其显著正相关(p<0.001),与紫外光、紫光、蓝光、橙光、红光、红外光辐射强度及蓝光/紫外光值呈极显著正相关;甲基花青素类花色苷含量与橙光、红光辐射强度及红光/蓝光值呈极显著正相关;花葵素类花色苷含量与橙光呈极显著正相关;3’-羟基取代类花色苷含量与橙光、红光辐射强度呈极其显著正相关(p<0.001),与绿光、红外光辐射强度及总辐射呈极显著正相关(图2)。可见,随着总辐射及各波段光辐射强度的增强,果实色泽指标L*、a*、b*、C*值均减小,而色泽指标CIRG值及各类型花色苷含量均增高,果实着色加深;绿光辐射强度和总辐射的增大会使花青素类花色苷含量极其显著增高,橙光和红光辐射强度的增大会导致3’-羟基取代类花色苷含量的极其显著增高,3’-羟基取代类花色苷含量的增大有利于葡萄着色向红色发展。
3 结论
新疆吐鲁番地区高温强光照条件下,不同颜色果袋套袋的‘新郁’葡萄生长光环境存在明显差异。套袋均不同程度降低了袋内总辐射,蓝袋和绿袋大幅降低了红光的占比。与对照相比,套袋均降低了‘新郁’葡萄果实中可溶性固形物含量,绿袋提高了可滴定酸含量,果粒质量减小。套袋均降低了果皮中总花色苷含量,白袋提高了3’5’-羟基取代类花色苷占比,降低了3’-羟基取代类花色苷占比,红袋、黄袋、蓝袋和绿袋则效果相反。采用红袋套袋的‘新郁’葡萄果皮甲基化、花青素类(3’-羟基取代)花色苷占比增高,酰化修饰类花色苷占比降低,且具有适度的总花色苷含量,有效改善了产区‘新郁’葡萄着色过深问题,果实色泽鲜红,内在品质较优。综合而言,西北干旱区‘新郁’葡萄宜采用红色果袋进行套袋。