生物防治与综合防控岗位
黄晓庆 郑媛萍 张昊 王忠跃
葡萄 (Vitis spp.) 是起源最古老的植物之一,在世界范围内广泛种植。截至 2017 年底,我国葡萄栽培总面积为 87 万 hm²,居世界第二位,是我国农业产业的重要组成部分(田淑芬等, 2018)。由灰葡萄孢(Botrytis cinerea)引起的葡萄灰霉病不仅是葡萄生产中的常见病害, 更是产后贮藏过程中的毁灭性病害,严重影响葡萄的产量和品质,目前在世界各葡萄产区普遍发生。葡萄灰霉病极易在低温高湿的环境下爆发;病原菌主要为害葡萄的花序和果实,有时也会为害葡萄叶片和新梢,导致葡萄减产减收,造成每年20% ~ 50%的损失,极大的制约了世界及我国葡萄和葡萄酒产业的健康发展(王忠跃, 2017)。葡萄灰霉病菌的腐生性强,寄主范围广,且能够在不同寄主植物之间相互传染(陈宇飞等, 2006)。目前对葡萄灰霉病的防治主要是以化学防治为主,常用的杀菌剂主要包括苯并咪唑类、二甲酰亚胺类、苯吡咯类、烟酰胺类、吡咯类和咪唑类杀菌剂等六类。然而,随着杀菌剂的长期大量频繁使用,病菌逐渐对药剂产生了抗性,从而导致化学杀菌剂的防效下降,不仅增加防治成本,给葡萄产业造成巨大损失,还极大的影响环境和食品安全。
长期以来,快速、准确的检测方法是病原菌抗药性监测的重要部分,并成为国内外学者获取最新的病原菌对农药的抗性信息,避免或减缓病原菌抗药性继续发展的重要途径。传统的灰霉病菌抗药性检测通常采用菌丝生长速率法和孢子萌发法,但存在操作繁琐、试验工作量大、周期长、灵敏度差等缺点。随着病原菌抗药性机理分子水平上研究的不断深入,分子生物学检测技术已逐渐在抗药性检测中发挥重要的作用。目前,大多数的分子检测研究集中于靶标抗性方面,即检测靶标基因的突变。常用的方法有限制性内切酶技术、基于PCR的反应技术和测序技术(冯海永等, 2012; Claudio et al., 2009; Shinpei et al., 2007)。其中高通量测序技术能够在突变位点附近直接进行 DNA 测序,无须繁琐的实验,即可得到病原菌抗性基因信息;并且能够一次并行对几十万条到几百万条 DNA 分子进行分析;该方法具有敏感度高、通量高、成本低、检测速度快、覆盖度广等优点(周秉博等, 2017),目前已在害虫等的抗药性监测方面发挥重要作用(马玉婷等, 2017; Benting et al., 2014)。本研究拟根据已明确的灰霉病菌常用杀菌剂抗药性机制,开发同时检测多种药剂抗性的高通量检测技术,为开展大规模的田间病原菌的对常用杀菌剂的抗药性检测奠定基础。
1 试验材料与方法
1.1 供试菌株
采自我国主要葡萄产区山东省蓬莱市、辽宁省北镇市、山西省太谷市、云南省宾川县、湖北省荆州市和黑龙江省哈尔滨市的葡萄灰霉病菌株,共384株。
1.2 DNA提取
使用OMEGA公司的E-ZR96 Fungal DNA Kit提取试剂盒(D3390-02),提取葡萄灰霉病菌株的基因组DNA,具体步骤见试剂盒说明书。
1.3 引物设计
根据已报道的灰葡萄孢对多菌灵、腐霉利、异菌脲、咯菌腈、啶酰菌胺的抗性机制以及多药抗性机制(Yarden et al., 1993; Liu et al., 2008; Yin et al., 2011; Kretschmer et al., 2009),同时为了适合illumina测序平台PE150的测序读长,利用Primer 5.0 software (PREMIER Biosoft, PaloAlto, CA)设计扩增包含上述药剂靶标突变位点的引物(表1),扩增产物均小于 300 bp,双端测序读长可进行拼接。同时设计 40 条 6 碱基长度的 barcode 序列,这些序列均不包含于扩增序列中,其中 24 条用于正向引物标记,16 条用于反向引物标记(表2),经过排列组合,共能生成 384 组特异性引物组合,用来特异性标记一个测序反应中混合的 384 株菌株。
利用上述引物进行PCR扩增后,对PCR产物进行琼脂糖凝胶电泳检验。将所有的扩增产物分别取出5 μl 混合于一个45 ml的离心管中,充分混匀后取400 μl 进行切胶回收,回收产物采用Axygen AxyPrepTM DNA凝胶提取试剂盒建库,illumina xTen系统进行PE150测序(赛墨百合公司)。
1.4 PCR体系的建立
常规PCR:20 μl的PCR反应体系包含40 ng DNA模板,0.3 μM Taq DNA polymerase,2.5 μM 10×buffer,2 μM 2.5×dNTP,Primer F (10pM)和Primer R (10pM)各1 μl,加ddH2O至20 μl;PCR反应程序:95℃5 min;94℃30s,56℃30s,72℃延伸,30个循环;72℃,10 min;4℃无限。
1.5 高通量测序
首先对PCR产物进行琼脂糖凝胶电泳检验。将所有的扩增产物分别取出5 μl混合于一个45 ml离心管中 充分混匀后取400 μl进行切胶回收 回收产物采用Axygen AxyPrepTM DNA凝胶提取试剂盒建库,illumina xTen系统进行PE150测序(赛墨百合公司)。
1.6 灰霉菌抗药性检测程序DFRB 的开发
高通量混合测序结果的分析主要包含5个步骤:
1)首先采用pear 软件根据barcode 序列将混合测序结果分解为单个菌株测序结果 (demultiplexing),并将overlap 的reads 进行拼接;
2)利用bwa 软件将每个菌株的测序结果分别比对到参考基因序列;
3)软件samtools 将比对结果sam 文件转换为二进制bam 文件;
4)采用freebayes 软件进行变异检测 (variant calling);
5)将变异检测结果转换为氨基酸水平的变异,并检验是否为已知突变。
采用python语言编写了灰霉菌抗药性检测程序DFRB.py,程序包含了以上全部5个步骤,可以一步自动处理测序结果,生成抗性结果、已知变异和未知变异三个文件。该程序支持并行运算,能够显著降低运行时间,提高效率。
2. 结果与分析
2.1 葡萄灰霉病菌对常用杀菌剂的抗性频率
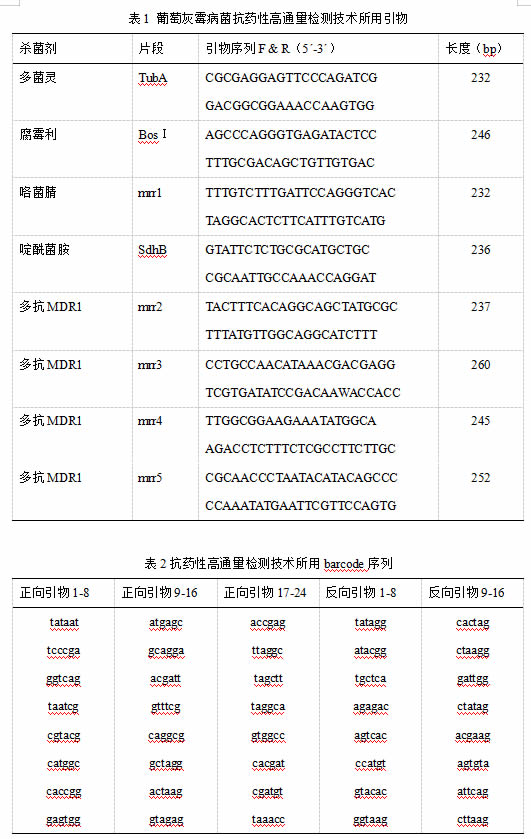
提取384株葡萄灰霉病菌的DNA,合成抗多菌灵、啶酰菌胺的目标片段的引物后进行PCR,并将扩增产物混合均匀后进行产物回收后送去公司进行高通量测序,并得出这384 株葡萄灰霉病菌株对啶酰菌胺、多菌灵、腐霉利/异菌脲和MDR1多抗类型的抗性频率分别为46.61%、92.71%、81.25%、15.63%(图1)。
2.2 葡萄灰霉病菌对上述杀菌剂的抗性突变类型
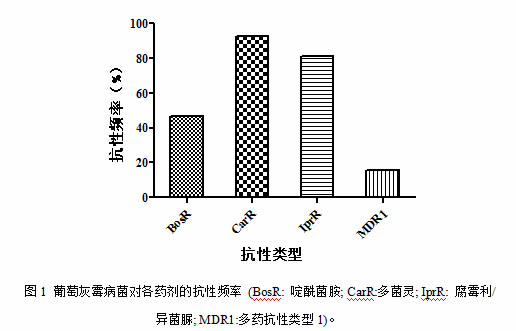
该样品的高通量测试结果显示,384株葡萄灰霉病菌中抗多菌灵菌株的抗性突变位点全部位于β-微管蛋白tubA基因的198位氨基酸上,氨基酸的突变类型为E198A、E198V,分别占比74.72%和25.28%;啶酰菌胺抗性菌株的突变位点主要在SdhB基因的272、230位氨基酸上,氨基酸的突变类型为H272R、H272R、N230I及N230I和H272R,其中H272R突变类型有173个占96.11%,H272Y有8个占比4.44%,N230I有2个占比1.11%,N230I和H272R有1个占比0.56%;腐霉利异菌脲抗性菌株的突变位点主要在BosⅠ 基因的365、369、373位氨基酸上,其中氨基酸的突变类型为I365N、I365S及Q369P和N373S,其中I365N有145个占比46.33%,I365S有142个占比45.37%,Q369P和N373S有26个占比8.31%;多药抗性MDR1基因型的频率为15.63%(图2)。
3. 结论
通过高通量测序检测,能够一次获得上述384株葡萄灰霉病菌对啶酰菌胺、多菌灵、腐霉利/异菌脲和MDR1多抗类型的抗性频率和相应的抗性突变类型。其中对上述各药剂的抗性频率分别为46.61%、92.71%、81.25%、15.63%;而抗多菌灵菌株的抗性突变位点全部位于β-微管蛋白tubA基因的198位氨基酸上,E198A占大多数(74.72%);啶酰菌胺抗性菌株的突变位点主要在SdhB基因的272、230位氨基酸上,H272R占绝大多数(96.11%);腐霉利异菌脲抗性菌株的突变位点主要在BosⅠ 基因的365、369、373位氨基酸上,I365N占比46.33%,I365S占比45.37%;多药抗性表型MDR1的抗性频率为15.63%。上述结果表明高通量检测技术不仅能够同时检测多种药剂的抗性频率,还能明确各药剂的抗性突变类型,甚至能发现一些新的突变,与传统检测方法和其他分子检测技术相比具有高效、灵敏、便捷、低成本等显著优势,适合田间大规模的检测。