微生物岗
刘延琳
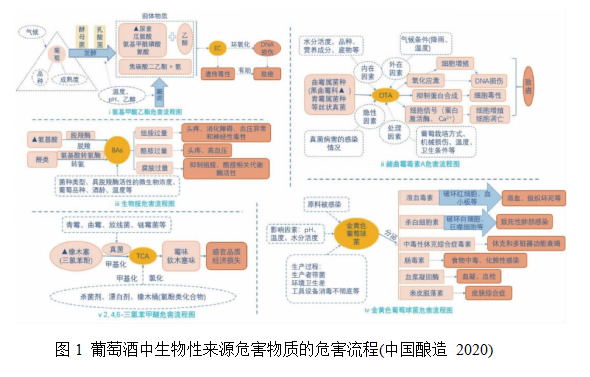
葡萄酒包含丰富的酚类化合物和矿物质元素, 适量饮用有益身心健康。近些年来,随着我国经济的发展,居民生活水平的提高,葡萄酒消费量也在逐年增长,中国已经成为了第5 大葡萄酒消费国。在葡萄酒消费白热化的同时,也要关注其安全风险。葡萄酒中也可能存在一些潜在的有害物质, 比如生物胺和霉菌毒素等(图1)。葡萄酒中的生物性来源有害产物主要是由一些微生物代谢产生的对葡萄酒饮用质量和食品安全造成影响的一些物质,长期过量摄入这些物质可能会引发一系列疾病,如葡萄酒发酵过程中一些微生物可通过尿素循环途径产生氨基甲酸乙酯(ethyl carbamate,EC)、黑曲霉(Aspergillus niger)等真菌污染会产生赭曲霉毒素A(ochratoxinA,OTA)、氨基酸脱羧会产生生物胺(biogenic amine,BAs)(中国酿造 2020)。
为了预防和减少葡萄酒中有害物质的产生和污染,葡萄酒生产和消费量多的国家早在20世纪80年代开始就陆续制定了相应的限量标准(Xia et al. 2018)。由于我国的葡萄酒产业起步相对较晚,生产条件较差,相关的技术人员短缺,普通工作人员生产过程中食品安全控制意识不强,检测条件也相对落后,加上经营者利益至上的生产方式,使得葡萄酒的质量安全状况不容乐观。
1、赭曲霉毒素
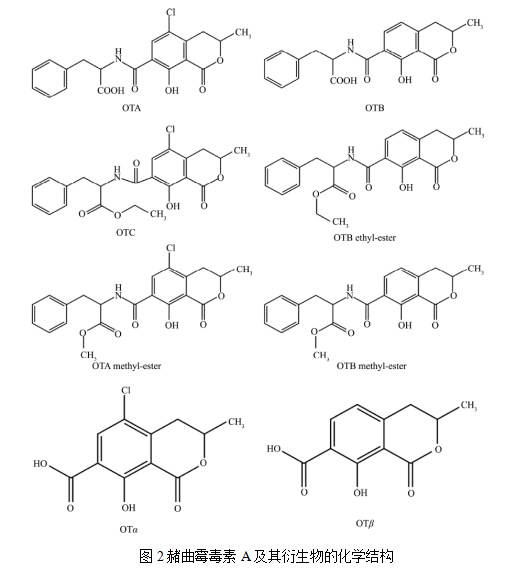
赭曲霉毒素是一类由真菌产生的次级代谢产物,是异香豆素连接β-苯基丙氨酸上的衍生物,其中赭曲霉毒素A(Ochratoxins A, OTA)分布最广,毒性最强,具有很高的化学稳定性和热稳定性,半衰期较长,OTA及其衍生物的化学结构见图2。1993年,国际癌症研究机构将其列为2B 类致癌物,近期被上升为2A 类致癌物(Ubeda et al. 2020) OTA广泛存在于多种食品中,现在被食品添加剂联合专家委员(JECFA)认定的对OTA暴露风险最大的7 种食品依次是谷物、谷物制品、葡萄酒(汁)、咖啡、可可制品、啤酒、猪肉等(Mondani et al. 2020)。1996年,在葡萄酒和葡萄汁中最早发现OTA,其含量仅次于谷物(Zimmerli and Dick 1996)。OTA具有强致癌性,会对人体的肾脏、肝脏、神经有毒性,会加速细胞衰老,影响免疫力(da Rocha et al. 2014, Rasic et al. 2018)。
1.1 OTA的来源及在葡萄酒中的污染情况
1965年,Scott从南非高粱上分离到一株赭曲霉(Aspergillus ochraceus),它是最早发现的OTA产生菌(疏秀林 et al. 2008)。炭黑曲霉(A. carbonarius)和黑曲霉(A. niger)导致葡萄及葡萄酒OTA 感染的主要真菌(Frisvad et al. 2007),炭黑曲霉的产毒能力优于黑曲霉(Perrone et al. 2006)。由于地域等原因,OTA的污染状况轻重不一。不同的气候影响着赭曲霉毒素产生菌的种类及其OTA浓度,在温度高、湿度大的热带地区,比如地中海国家和澳大利亚中葡萄上存在大量的OTA产生菌炭黑曲霉和黑曲霉(Leong et al. 2006),在南非和阿根廷,黑曲霉是产OTA的主要菌株(Magnoli et al. 2003, Perrone et al. 2007)。在寒冷的地区,比如塔斯马尼亚,炭黑曲霉的含量下降(Hocking et al. 2007)。OTA也是青霉属某些种的代谢产物,Battilani和Rousseaux分别在意大利和法国北部的葡萄上分离得到了产OTA的青霉菌(Rousseaux et al. 2014, Mondani et al. 2020)。青霉属菌株产生OTA一般只在气温低于30℃且水分活度较低的地方生长。因此,在寒冷地区,OTA的来源主要是青霉菌产生的。
葡萄酒主要是由葡萄酿造的,如果葡萄被OTA污染,葡萄酒也有被OTA污染的可能。早在1994年就已在葡萄酒中检测到OTA。2006年,通过对欧洲整体膳食的评估发现,人们从葡萄酒中摄取的OTA含量占总量的13%,仅次于谷类。随着对其毒性认识的加深,各国家对食品中OTA的含量也相继规定了限量标准。在2006年,欧盟规定在葡萄及葡萄酒类产品中OTA的限量标准是2 μg/kg (Mondani et al. 2020)。不同国家和地区葡萄酒中OTA含量不同,气候温暖的欧洲南部生成的葡萄酒的OTA有所增加,意大利,西班牙和希腊的葡萄酒中,OTA的含量最高。Espejo等统计发现,欧洲葡萄酒中OTA含量为0.01-3.41μg/L(Espejo and Armada 2009). 由于地中海沿岸国家特殊的环境和气候,葡萄酒受OTA 污染比较严重(Garcia-Cela et al. 2015)。对中国生成的 77 份红葡萄酒中的OTA进行检测,发现阳性率高达57%, 最高值为5.65 μg/kg(Zhang et al. 2013)。但在另一项调研中, 作者认为源自中国的葡萄酒是相对安全的, 葡萄酒的OTA 阳性率只有45%, 含量范围在0.01~0.98 μg/kg(Zhong et al. 2014)。葡萄皮是OTA 的主要来源,由于红葡萄酒带皮浸渍发酵,红葡萄酒比白葡萄酒受污染的趋势更明显(Covarelli et al. 2012)。在欧洲,红葡萄酒中OTA含量达到了5.26–7 μg/L,而在白葡萄酒中仅有17%检测到了OTA(Mondani et al. 2020)。
1.2 葡萄酒中OTA的影响因素
葡萄酒中OTA的含量取决于葡萄本身和酿造过程两部分。气候变化、葡萄园地理位置和葡萄的健康程度被认为是葡萄中产生OTA 的决定因素。研究发现,环境温度与葡萄和葡萄酒中OTA 的分布呈正相关,环境温度较高的南欧国家的葡萄酒中OTA高于环境温度低的北欧国家(Parker et al. 2011),另外来自意大利、西班牙的高温产区葡萄酒样品中OTA 高于2 μg/L的样品达到10 %(De Jesus et al. 2018)。葡萄的健康状况对葡萄中的OTA污染情况具有重要的影响作用。在葡萄的生长过程中,OTA产生菌存在于土壤中和葡萄的表面,在葡萄生长的前期,OTA产生菌很难进入葡萄中,但当葡萄表面由于昆虫、降雨、灌溉或者人为因素受到损伤,产毒真菌会感染葡萄,并产生OTA, OTA含量要远远高于健康的葡萄浆果(Jiang et al. 2013)。葡萄中OTA含量与葡萄成熟度有关,从葡萄转色期开始到成熟期,随着葡萄成熟度的增加,葡萄中OTA产生菌的数量有增加的趋势,且在葡萄成熟期达到最高(蒋春美 2012)。
葡萄酒品种和酿造工艺也影响OTA 的产生,红葡萄酒的带皮浸渍会增加OTA 的产生,因此OTA 多见于红葡萄酒,其次是桃红葡萄酒和白葡萄酒。除了葡萄本身受OTA 污染的影响外, 酿酒过程也将影响葡萄酒最终的OTA 浓度, OTA 含量在完整的酿酒过程中能够降低80%以上(Freire et al. 2020)。OTA 污染主要归因于可以在葡萄上生长并产生毒素的真菌。葡萄皮公认是污染最严重的组织。新鲜的葡萄经破碎后, OTA 会从果皮中转移出来,同时浸渍过程中的高温和有氧条件也促进了某些真菌的生长和OTA 的释放(Lasram et al. 2008),故浸渍会使OTA 的含量增加20%(Fernandes et al. 2013)。研究表明,红葡萄酒酿造过程中的浸渍时期是OTA 浓度升高最明显的时期。而酿酒过程中OTA 含量的降低主要是通过葡萄汁中的固体颗粒或酵母细胞的吸附作用进行的,酿酒酵母细胞壁最外层的多孔甘露糖蛋白可能吸附OTA 并自然沉降, OTA 的含量因此在一定程度上有所减少(Cecchini et al. 2006, Marino-Repizo et al. 2017)。酿酒过程中需要添加澄清剂如活性炭、膨润土、明胶等去除酒中的浑浊成分,这些澄清剂也能够吸附OTA,所以葡萄酒经澄清和过滤这一步骤后, OTA 的含量进一步减少(Zhang et al. 2016)。
1.3 OTA 生物合成途径及其分子调控机制
OTA 是所有赭曲霉中毒性最强的化合物,研究表明OTA的衍生物OTB对大鼠肾脏不会造成明显的损伤, OTα毒性仅为OTA 的五百分之一(Fernandes et al. 1998, Bejaoui et al. 2006)。考虑到OTA 及其衍生物的危害性, 阐明OTA 的生物合成途径及其分子调控机制有助于预防和控制OTA 的污染问题。
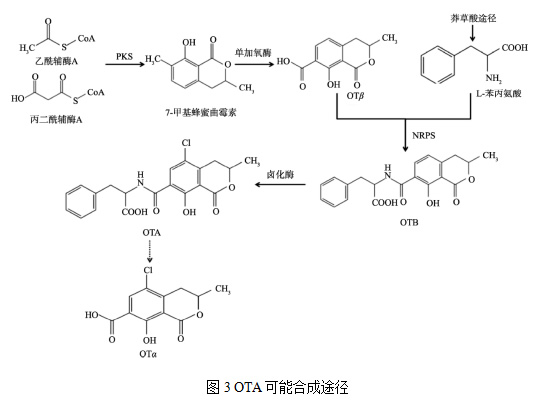
OTA 生物合成途径所涉及的基因簇和酶促步骤尚未完全清楚。早在1979年,Huff 等推测乙酸可以经聚酮合酶(polyketone synthase, PKS)催化合成蜂蜜曲霉素, 随后被甲基氧化为OTβ, 然后将其氯化生成OTα, 最后, OTα 与苯丙氨酸衍生物结合生成OTC, OTC 经去酯化反应生成OTA(Huff and Hamilton 1979)。2001年,Harris 等发现在炭黑曲霉中,此途径中, OTα可直接与苯丙氨酸结合生成OTA,不需要OTC的产生(Harris and Mantle 2001)。Wang 等[16]通过化学方法鉴定了在炭黑曲霉中该合成途径中的潜在中间体, 证实了OTC并非OTA 生物合成的中间体, 而OTB是合成OTA 的关键中间代谢物(Wang et al. 2018)。近期,刘阳等研究发现,OTA合成途径如图3所示。聚酮合酶(PKS)是OTA合成的启动酶,利用乙酰辅酶A和丙二酰辅酶A合成7-甲基蜂蜜曲菌素,进而被单加氧酶(OtaC)催化氧化成OTβ。OTβ 和 L-β-苯基丙氨酸在NRPS (OtaB)催化下合成酰胺键形成OTB。最后,OTB在卤代酶(OtaD)催化下形成OTA(Yan Wang 2018), OTα 可能是OTA 水解的产物(Gallo et al. 2012)。其中所涉及的基因簇可能由编码PKS、NRPS、P450 单加氧酶和卤化酶的4 个结构基因和一个bZIP 转录因子共同构成, 而bZIP 转录因子是在曲霉和青霉属中普遍存在的特异性调控因子(Gallo et al. 2017)。在OTA 生物合成途径中, 关于pks 基因的研究最早, 报道也最多。在纯绿青霉和曲霉中克隆并鉴定了参与OTA 合成的pks 基因(O'Callaghan et al. 2013, Wang et al. 2015)。
虽然, OTA生物合成分子方面的研究取得了一定的进展, 但是真菌的OTA 合成途径因其种类不同而差异很大。从基因组学、转录组学和蛋白组学的方法上挖掘新的OTA 合成调控的关键基因是未来研究OTA 生物合成机制的重点。
1.4 OTA的防治
OTA 污染主要归因于可以在葡萄上生长并产生毒素的真菌。葡萄皮公认是污染最严重的组织。赭曲霉是OTA的主要产生菌。新鲜的葡萄经破碎后, OTA产生菌及OTA 会从果皮中转移出来,进入葡萄酒中,从而影响葡萄酒的品质和安全性。掌握OTA产生菌在实际酿造过程中的生长与产毒,对于降低葡萄酒中的有害真菌及其OTA具有重要的作用。
(1)物理方法
物理方法去除葡萄和葡萄酒中的OTA的主要途径是加强对葡萄园的管理,控制产毒真菌的生长,减少机械造成的和降雨、日晒等引起的枝条和果穗伤害,有效降低产毒真菌侵染葡萄果穗的机率(Varga and Kozakiewicz 2006)。有研究表明通过对葡萄园进行合理的管理可以有效降低(80%)葡萄酒中的污染OTA的概率(Bellí et al. 2004)。由于腐烂的浆果中含有的OTA量较高,挑除腐烂的浆果可有效降低葡萄酒中OTA的含量(Kozakiewicz et al. 2004)。
(2)化学方法
化学方法去除OTA主要是利用真菌杀菌剂控制OTA产生菌的生长而达到降低葡萄和葡萄酒中OTA的目的(蒋春美 2012)。化学方法会产生化学残留,不仅仅危害着人体健康,而且对环境造成严重的污染,化学杀菌剂的大量使用使有害生物产生抗药性,不断地造成恶性循环。于是亟需一种安全有效的防治方法。
(3)生物方法
生物防治作为一种相对安全和无毒的防治手段,已经引起广泛关注,细菌和酵母等均可以应用于葡萄酒中OTA的生物防治。酵母菌可以在不利的环境条件下生长而无需特殊的营养需求,并且不会产生对人体健康有害的化合物。在自然条件下,葡萄上生长着许多能抑制葡萄真菌感染的酵母,可以作为生物防治的潜在来源(Kazem Kasfi 2018)。生防酵母菌作用机理主要包括营养与空间竞争作用、对病原菌的寄生作用、诱导寄主产生抗性作用、分泌抗菌素和挥发性物质等方面(Dukare et al. 2019)。
我们课题组发现分离自葡萄皮上的酿酒酵母GA8对于OTA产生菌青霉菌和曲霉都具有良好抑制作用,从而有可能降低葡萄酒发酵过程中OTA的含量。研究表明酵母菌酿酒过程中OTA 含量的降低还可以通过葡萄汁中的固体颗粒或酵母细胞的吸附作用进行。但是由于酵母菌抑制青霉菌和曲霉的生长和产毒的分子机制还不清楚。利用带有生防酵母和OTA产生菌的葡萄酿酒对于葡萄酒的品质影响规律和内在作用机制也不明确。阐明这些科学问题,对于酿酒酵母更好的商业应用具有重要的作用。
为此,本项目以实验室筛选的对青霉菌和曲霉具有抑制作用的酵母菌GA8为研究对象,拟对其生防效果和生防机理进行研究,并将生防酵母菌与其他物质联用,以改良酵母菌的生防效力。同时,将带有生防酵母的葡萄应用于葡萄酒的生产和发酵,研究生防酵母对于葡萄酒品质和质量的影响。
2、生物胺
生物胺(BA,biogenic amine)是一类含脂肪族(腐胺,尸胺,精胺和亚精胺)、芳香族(酪胺,苯乙胺)或杂环(组胺,吡咯烷)结构的低分子量、极性或半极性的含氮有机化合物,其广泛分布于不同发酵食品中(如奶酪、牛奶、啤酒和葡萄酒)(Kelly et al. 2010)。微量的生物胺是生物体内正常的活性成分,但当人体摄入过量的生物胺时,就会引起头痛、恶心等食源性生物胺中毒,严重的会危及生命(Berbegal et al. 2017)。
2.1 生物胺的来源及在葡萄酒中的污染情况
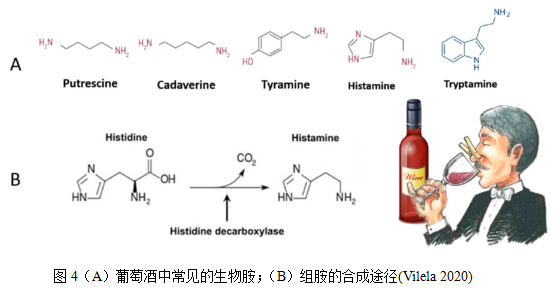
葡萄酒中含有多种生物胺,包括酪胺、组胺、腐胺、色胺、尸胺、2-苯乙胺、甲胺、乙胺、异戊胺等20余种,组胺、酪胺和腐胺是葡萄酒中最主要生物胺(图4)(Ke et al. 2018)。在这些生物胺中,组胺的生理毒性最强。葡萄酒中的生物胺大多是在微生物所产的氨基酸脱羧酶的作用下,脱去氨基酸的羧基生成(Jastrzebska et al. 2018)。葡萄酒中组胺、酪胺和腐胺的含量在酒精发酵结束后较低,苹果酸-乳酸发酵后不同程度升高。甲胺、乙胺、苯乙胺、尸胺和异戊胺等其他生物胺在葡萄汁中就已经存在,并在酿造过程中有所降解(刘沛通 et al. 2016)。
目前,许多国家对葡萄酒中组胺作出了限量规定,对其他生物胺的限量标准还不够完善。澳大利亚、匈牙利和瑞士不得高于10 mg/L,法国不得高于8 mg/L,荷兰不得高于3.5 mg/L。比利时不得高5~6 mg/L,德国不得高于2 mg/L(Lehtonen 1996),我国尚未明确葡萄酒中生物胺的限量要求。
由于葡萄品种、产区和酿造工艺等不同,葡萄酒中生物胺的含量差异很大。希腊产葡萄酒中组胺含量在0.250~2.626 mg/L,酪胺含量在0~1.583 mg/L,腐胺含量在0.528~3.148 mg/L(Loukou and Zotou 2003);西班牙产葡萄酒中组胺含量在0~4.74 mg/L之间,酪胺含量在0~5.91 mg/L,腐胺含量在1.48~19.10 mg/L (Romero et al. 2002);土耳其红葡萄酒中组胺含量在0~1.965 mg/L,酪胺含量在0~0.229 mg/L,腐胺含量也在5.920 mg/L之下(Anli et al. 2004)。而我国产葡萄酒中组胺含量在0~10.51 mg/L,酪胺含量在0~19.13 mg/L,腐胺含量含量在0.22~19.01 mg/L (王光强 et al. 2016)。我国葡萄酒行业还需要做大量工作以降低以组胺为代表的生物胺含量。
2.2 葡萄酒中生物胺的影响因素
在葡萄酒生产在储存过程中,生物胺含量都在不同程度地变化。葡萄酒中生物胺可以微生物的氨基酸脱羧酶将游离氨基酸代谢而成。因此葡萄酒中生物胺的主要影响因素包括:a) 氨基酸脱羧酶,即微生物;b)游离氨基酸,即原料;c)合适的反应条件,即发酵工艺。
苹果酸-乳酸发酵阶段是生物胺产生的主要时期(Sun et al. 2018)。乳酸菌是葡萄酒进行苹果酸-乳酸发酵(MLF)的重要微生物。目前具有氨基酸脱羧能力的葡萄酒相关乳酸菌有酒球菌(Oenococcus)、乳杆菌(Lactobacilluas)、明串珠菌(Leuconostoc)和片球菌(Pediococcus)。研究发现接种本土乳酸菌的葡萄酒中生物胺含量高于商业乳酸菌发酵的葡萄酒(Lopez et al. 2011)。
高浓度的含氮化合物有利于酵母菌的生长代谢,加快酒精发酵。在此基础上苹乳发酵也更易进行,同时也可为发酵过程所混入的杂菌提供能量,从而产生过量的生物胺(Smit et al. 2013)。不同品种的葡萄所含氨基酸的种类和含量存在差异,且葡萄原料中也含有某些生物胺(Del Prete et al. 2009)。葡萄种植过程中施氮肥量、灌溉、葡萄园环境会影响葡萄汁中含氮化合物的浓度,主要包括氨基酸、生物胺(主要是脂肪族多胺)等。酒体中 BA 浓度也受葡萄成熟度的影响,葡萄的成熟度越高所含的游离氨基酸也越丰富(Ortega-Heras et al. 2014)。
葡萄酒酿造过程中,发酵的温度、果皮的浸渍时间以及陈酿方式等也对葡萄酒中生物胺含量有重要影响(Smit et al. 2013, Bordiga et al. 2016)。通常情况,发酵温度的适度升高,果皮的浸渍处理,以及发酵结束后的压榨处理都会使氨基酸的含量也有所提高,进而提高生物胺的含量(Guo et al. 2015, 刘宁 et al. 2019)。葡萄酒的陈酿也会提高葡萄酒中生物胺的,带酒泥陈酿会将酵母残体中的蛋白物质释放出来,最终降解为氨基酸,为生物胺含量的提高提供了底物(刘宁 et al. 2019)。
2.3 生物胺生物合成途径及其分子调控机制
生物胺的形成主要通过四种酶促反应:脱羧作用、转胺作用、胺化作用和前体氨基化合物的降解(Sebastian et al. 2011)。组胺、酪胺和腐胺是葡萄酒中最主要生物胺(Ke et al. 2018)。组胺的前体物质为组氨酸,酪胺的前体物质为酪氨酸,腐胺是由鸟氨酸和精氨酸脱羧作用及脱氨作用的产物形成(刘沛通 et al. 2016)。
在苹果酸-乳酸发酵过程中,某些乳酸菌株具有很强的组氨酸脱羧酶活性,当发酵条件不利于其正常代谢时 这些乳酸菌可通过脱羧和转氨作用将组氨酸转化为组胺(图4)。酪胺在酪氨酸的脱羧反应中一步生成,研究表明短乳杆菌具有很强的酪氨酸脱羧酶活性(Moreno-Arribas et al. 2000)。腐胺主要由两种代谢途径生成,一是由鸟氨酸经脱羧酶作用降解生成;二是由精氨酸代谢生成,该代谢途径受两种酶系统的调控:一是在精氨酸脱亚胺酶和鸟氨酸脱羧酶的连续作用下生成;二是在精氨酸脱羧酶和胍丁胺脱亚胺酶的连续作用下生成。(Nannelli et al. 2008)。
2.4 生物胺的去除
葡萄酒中生物胺的主要影响因素为微生物、原料和发酵工艺,故葡萄酒中生物胺水平的控制可以通过控制产氨基酸脱羧酶的微生物的生长、控制食品中游离氨基酸的含量、改进生成工艺(王光强 et al. 2016)。
降低葡萄酒中生物胺的具体措施有:1)控制产氨基酸脱羧酶的微生物的生长。接种无氨基酸脱羧酶活性的乳酸菌菌株,能够抑制自然菌群的生长或降解自然菌群产生的生物胺(刘沛通 et al. 2016);产氨基酸脱羧酶微生物参与是形成生物胺的前提条件,因此可以通过无氨基酸脱羧酶微生物发酵或者控制产氨基酸脱羧酶微生物的生长而降低食品中生物胺的含量,这也是目前控制生物胺含量最有效的方法之一(王光强 et al. 2016)。避免产生物胺的污染菌。严格控制原料质量及发酵过程,最大限度地控制各种污染源(Costantini et al. 2009);
2)控制食品中游离氨基酸含量。通过控制反应的底物—游离氨基酸可以降低反应产物—生物胺的数量(王光强 et al. 2016)。
3)改进生成工艺。在苹果酸乳酸发酵完成后,及时添加足够的二氧化硫来终止发酵,也可以添加溶酶菌达到溶菌的效果,以减少乳酸菌的进一步代谢,并进行倒罐、下胶、澄清等处理,避免葡萄酒与酒泥接触时间过长增加生物胺的产生。在发酵过程中可通过额外添加其他菌种来实现对氨基酸脱羧酶的抑制或对生物胺的降解(王光强 et al. 2016, 张浩 2019)。
目前葡萄酒生产企业越来越多,葡萄酒品质良莠不齐,有害物质的风险也越来越高,应尽快制定相关国家标准,监管部门严格把关,也希望可以提高葡萄酒消费者的安全意识,督促生产企业对于这些有害物质加强控制管理,促进我国葡萄酒发展更加优质安全。