种苗扩繁与生产技术岗位
胡丽 胡娟 卢浩成 王军
摘 要:2019年对玛纳斯产区5个白葡萄品种‘霞多丽’、‘琼瑶浆’、‘小白玫瑰’、‘绿维特利纳’和‘二号白香’进行小规模发酵实验,利用气相色谱-质谱联用技术检测所酿葡萄酒的香气物质。结果表明,‘小白玫瑰’所酿葡萄酒的香气物质种类最丰富(87种),花香和焦糖香浓郁,植物味和化学味较轻,脂肪味较重,葡萄酒香气轮廓整体表现最佳;‘二号白香’和‘霞多丽’所酿葡萄酒的风格相似,果香浓郁,但化学味较重;‘琼瑶浆’和‘绿维特利纳’所酿葡萄酒的香气物质种类丰富,花香浓郁,植物味、脂肪味和化学味较轻,但香气轮廓整体表现有欠缺。综上所述,‘小白玫瑰’和‘二号白香’适于玛纳斯产区风土下干白葡萄酒的酿造。
关键词:白葡萄品种;小规模发酵;干白葡萄酒;香气物质
葡萄酒的香气成分由几百种甚至上千种物质组成,是构成葡萄酒质量的重要因素[1]。葡萄酒的香气主要取决于葡萄品种的香气[2]。醇、酯、脂肪酸、醛酮、苯、降异戊二烯以及萜烯类物质是组成葡萄酒香气的主要成分,它们的种类、含量、感官阈值及其之间的相互作用因葡萄品种的不同而千差万别,进而决定着葡萄酒的风味和典型性[2]。
优良的品种只有在适宜的环境条件下才能表现出自身优秀的品种特性,酿造出品质优良、独具风格的葡萄酒[3-4]。新疆昌吉州玛纳斯县是天山北麓优质葡萄酒产区之一,该产区光照和热量资源丰富,以天山雪水作为灌溉水源,在葡萄生长季节降雨量低且生长后期气候冷凉,没有持续高温天气,有利于生产优质酿酒葡萄[5-6]。近年来,玛纳斯产区一直致力于引进、示范和推广优质酿酒葡萄品种,先后引进了‘霞多丽’、‘琼瑶浆’、‘小白玫瑰’、‘绿维特利纳’和‘二号白香’等5个白葡萄品种。
‘霞多丽’原产法国,属欧亚种,是优良的干白葡萄酒品种,其香气优雅,果香浓郁,具有苹果、梨、柑橘类水果、甜瓜、菠萝和桃的香气,陈酿后具有黄油、香草、奶油糖果和蜂蜜的香气[7]。‘琼瑶浆’原产中欧(德国南部、奥地利及意大利北部),属欧亚种,为优良的白葡萄酒品种,其葡萄皮为粉红色,所酿酒果香味浓郁、层次多变,具荔枝、芒果、薰衣草、玫瑰、肉桂、橙皮、甚至麝香的气味,酒质表现好,但产量较低[8]。‘小白玫瑰’原产地中海东部沿岸,属欧亚种,为优良的酿造与鲜食兼用品种,皮薄,果肉多汁,有浓郁的玫瑰香味,适于酿制白甜酒,酒质优良,果香和酒香浓郁,酒体醇厚[7, 9]。‘绿维特利纳’原产奥地利,属欧亚种,是奥地利种植最广泛的葡萄品种,其所酿酒通常呈干型,酒体饱满,口感十分爽脆清新,香气变化复杂:年轻时表现出青葡萄、蔬菜沙拉,白胡椒的香气,陈酿后表现出层层蜂蜜、烤面包的气息[10]。‘二号白香’原产法国,属欧亚种,为酿造与鲜食兼用品种,其所酿酒呈浅黄色,酒体清爽,透明度好,果香浓郁,具淡麝香味。
本研究通过对上述5个白葡萄品种的果实进行小规模酿造实验,利用气相色谱-质谱(Gas Chromatography-Mass Spectrometry, GC-MS)联用技术检测原酒中的香气物质,在比较其香气物质差异的基础上,探究其酒质特征,以期为玛纳斯产区的商业化种植提供理论指导。
1 材料与方法
1.1 材料与试剂
供试葡萄品种为‘霞多丽’(Chardonnay)、‘琼瑶浆’(Gewurztraminer)、‘小白玫瑰’(Muscat Blanc)、‘绿维特利纳’(Gruner Veltliner)和‘二号白香’(Early Madeleine)。葡萄园位于新疆昌吉州玛纳斯县中信国安葡萄酒业有限公司自建葡萄园(北纬44°14′,东经86°15′)。植株行向为北偏东52°,株距1 m,行距2.8 m,自根苗。叶幕形为改良的垂直叶幕形[11],短枝修剪,留梢量12~15支/株,留果量1~2果穗/新梢,结果带距地面大约60 cm。
氢氧化钠、酚酞、无水硫酸铜、磷酸、次甲基蓝、亚硫酸(均为分析纯):天津化工厂;香气标准品(均为色谱级):美国Sigma-Aldrich公司;果胶酶(酶活3万U/g):澳大利亚Optivin公司;白佳酿酵母菌(Vintage White):法国Lallemand公司。
1.2 仪器与设备
FA2004电子分析天平:上海舜宇恒平科学仪器有限公司;PAL-1手持糖度计:日本Atago公司;PB-10 pH计:德国Sartorius公司;SG3200HBT超声波清洗机:上海冠特超声仪器有限公司; Agilent 6890GC气相色谱、Agilent 5975 MS质谱、HP-INNOWAX色谱柱(60 m × 0.25 mm × 0.25 μm):美国Agilent公司。
1.3 方法
1.3.1 小规模发酵
2019年秋季手工采收‘霞多丽’、‘琼瑶浆’、‘小白玫瑰’、‘绿维特利纳’和‘二号白香’5个葡萄品种的果实,其中‘小白玫瑰’于8月22日采收,‘霞多丽’于8月27日采收,‘二号白香’于8月29日采收,‘琼瑶浆’和‘绿维特利纳’于9月5日采收。每个品种采样30 kg果穗,经人工除梗破碎压榨后,取其清汁装入3个10 L的小发酵罐(三次重复),每罐加入60 mg/L SO2和20 mg/L果胶酶,12~16°C澄清2~4 h后,添加2 g活化好的白佳酿酵母,发酵罐置于配备控温装置的酿造车间进行发酵,控制酒精发酵温度在14~16°C,发酵10 d左右。发酵期间监测其密度和温度,待密度降至1.000以下且不再发生变化即视为酒精发酵结束,加入60 mg/L SO2后装瓶,置于酒窖中待测。
1.3.2 入罐及发酵过程中基本理化指标的检测
入罐前果汁的可溶性固形物含量用手持糖度计测定,果汁pH使用pH计测定。
葡萄酒的酒精度、残糖、挥发酸、总酸、游离硫、总硫、pH:参照GB/T15038-2006《葡萄酒、果酒通用分析方法》[12]进行测定。
1.3.3 香气物质的检测
利用农业部葡萄酒加工重点实验室已优化的顶空固相微萃取-气相质谱(Head Space-Solid Phase Microextraction,HS-SPME-GC/MS)联用方法分析葡萄酒中的香气物质[13]。载气为高纯氦气(N2),流速为1 mL/min。升温程序如下:50°C保持1min,然后以3°C/min升温至220°C,最后保持5 min。其余条件如下:进样口温度为250°C,采取5∶1分流模式,电离方式为电子电离(electron ionization,EI)源,电子能量为70 ev,离子源温度为230°C,质谱接口温度为280°C,质量扫描范围为30~350 u。
挥发性香气物质的定性根据美国国家标准技术研究所(National Institute of Standards and Technology,NIST)标准谱库中的保留指数和质谱信息进行分析。香气物质的定量根据对应的标准曲线进行。
1.3.4 数据处理及统计分析
采用Excel计算平均值、标准偏差、标准曲线;采用SPSS 22.0进行统计分析,采用Origin 8.5和SIMCA 14.0进行绘图。
2 结果与分析
2.1 果汁及其发酵过程的基本理化指标
果汁理化指标是影响白葡萄酒品质的关键因素,对葡萄原料(葡萄汁)和酒精发酵结束这两个关键点进行取样,并测定其理化指标,结果如表1所示。‘霞多丽’入罐时果汁的可溶性固形物含量最高,其余4个品种果汁的可溶性固形物含量在19~23°Brix之间。入罐时‘小白玫瑰’的可滴定酸含量最高,而经过酒精发酵后总酸降低;与‘小白玫瑰’的变化趋势相似,‘琼瑶浆’和‘二号白香’在酒精发酵结束后总酸降低。相反,‘霞多丽’果汁的可滴定酸含量最低,而在酒精发酵结束后总酸含量升高,‘绿维特利纳’变化趋势与其相似。比较入罐时葡萄汁和酒精发酵结束后的pH,‘霞多丽’、‘小白玫瑰’和‘二号白香’呈上升趋势,而‘琼瑶浆’和‘绿维特利纳’则相反。在酒精发酵结束后,所酿葡萄酒酒精度高低顺序分别为‘霞多丽’、‘二号白香’、‘琼瑶浆’、‘绿维特利纳’和‘小白玫瑰’。5个白葡萄品种所酿酒的挥发酸在0.27~0.67 g/L之间,其中‘霞多丽’的挥发酸最高,‘小白玫瑰’次之,‘琼瑶浆’最低。
2.2 葡萄酒的香气成分分析
5个白葡萄品种所酿葡萄酒中共检测出90种香气物质,其中,‘霞多丽’检测出81种,‘琼瑶浆’87种,‘小白玫瑰’87种,‘绿维特利纳’86种,‘二号白香’83种。与‘琼瑶浆’和‘小白玫瑰’相比,‘霞多丽’酒的香气物质种类最不丰富,但该结果显著高于曹建宏等[14]和陈新军等[15]检测出的46和49种香气物质。
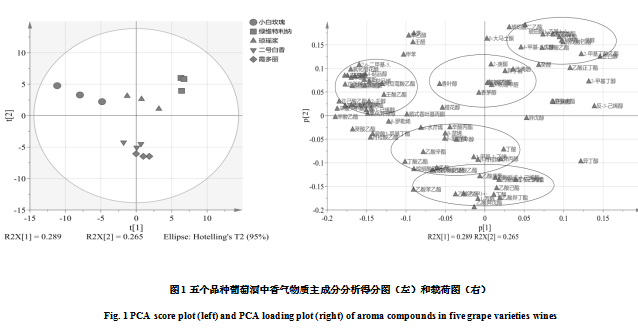
对5个品种所酿酒中香气物质进行主成分分析,如图1所示。提取第1主成分(PC1)和第2主成分(PC2)两个因子进行分析。根据主成分的得分图(图1左),PC1轴能够很好的将‘小白玫瑰’和‘绿维特利纳’区分开来,PC2轴能够很好地将‘琼瑶浆’与‘霞多丽’和‘二号白香’区分开来。结合得分图和载荷图(图1右)可知,氧化橙花醇、4-萜品醇、α-萜品醇、γ-萜品烯、右旋柠檬烯、氧化芳樟醇、脱氢芳樟醇等萜烯类物质位于第二象限,说明‘小白玫瑰’与其他品种之间的差异主要是由这些物质引起的。2-甲基丁酸乙酯、异戊酸乙酯、2-糠酸乙酯、琥珀酸二乙酯等脂肪酸乙酯类物质浓度高是‘绿维特利纳’主要区分于其他品种的原因。而乙酸乙酯、乙酸异丁酯、乙酸异戊酯、乙酸己酯、乙酸庚酯、乙酸辛酯等乙酸酯类物质浓度高是‘霞多丽’和‘二号白香’区别于上述三个品种的原因。
2.3 葡萄酒中呈香物质香气值的比较
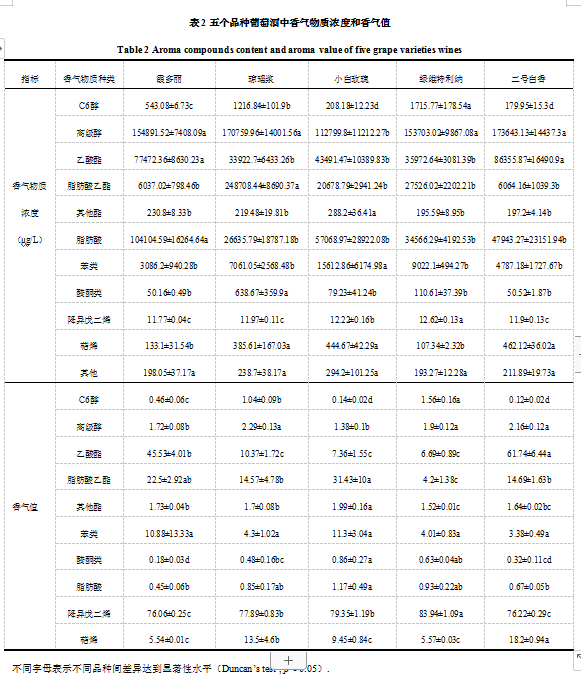
将5个品种检测出的香气物质按照化学结构进行分类,可以分为C6醇类、高级醇类、乙酸酯类、脂肪酸乙酯类、其他酯类、脂肪酸类、苯类、醛酮类、降异戊二烯类、萜烯类以及其他。将每种物质的浓度除以该物质的感官阈值,得到相应的香气值(Odor Acivity Value,OAV)[16],香气值可以较为直观地表示各物质在葡萄酒中的香气强度,结果如表2所示。其中其他类物质的香气值远小于0.1,对感官的贡献可以忽略不计,故未列入香气值表。从每个品种的各类型香气物质浓度来看,‘霞多丽’中脂肪酸浓度最高,‘琼瑶浆’中脂肪酸乙酯和醛酮类物质浓度最高,‘小白玫瑰’中其他酯和苯类物质浓度最高,‘绿维特利纳’中C6醇和降异戊二烯类物质浓度最高,‘二号白香’中高级醇、乙酸酯和萜烯类物质浓度最高。香气值方面,尽管降异戊二烯类物质浓度最低,但因其大多具有较低的阈值[17],可为葡萄酒提供令人愉悦的花香和果香,所以5个品种的呈香物质中降异戊二烯类对酒的香气贡献最大。C6醇类物质是葡萄酒中重要的一类香气物质,它们大多具有生青的气味,为葡萄酒贡献植物味。5个品种中‘绿维特利纳’C6醇的香气值最高,而‘二号白香’最低。高级醇类物质是一种由于酒精发酵所带来的次级产物,它在酒中浓度最高,对葡萄酒的香气影响与其浓度有很大关系,浓度较低时(<300 mg/L)可以改善葡萄酒的香气,但当其浓度过高(>400 mg/L)时又会导致酒体变得粗糙而缺乏细腻度[18]。在本实验中,5个品种中的高级醇类物质浓度均处于低浓度范围,其中‘琼瑶浆’高级醇香气值最高,‘小白玫瑰’最低。酯类物质包括乙酸酯类、脂肪酸乙酯类及其他酯类等3大类,它们大多可以为葡萄酒提供果香。其中,‘二号白香’的酯类香气值最高,其次是‘霞多丽’,‘绿维特利纳’最次。脂肪酸类物质主要是通过脂肪酸代谢产生,通常情况下表现为具有刺激性的腐臭味、脂肪味或者是奶酪味。其中,‘霞多丽’的脂肪酸类香气值最低,而‘小白玫瑰’最高。萜烯类家族拥有大量的化合物,在自然界的各种植物中广泛存在;许多萜醇类物质具有明显的香气,特别是里那醇、香叶醇、橙花醇、香茅醇和α-萜品醇,它们具有玫瑰香气[19],且香气阈值非常低。其中,‘二号白香’的萜烯类香气值最高,‘小白玫瑰’次之,‘霞多丽’最低。
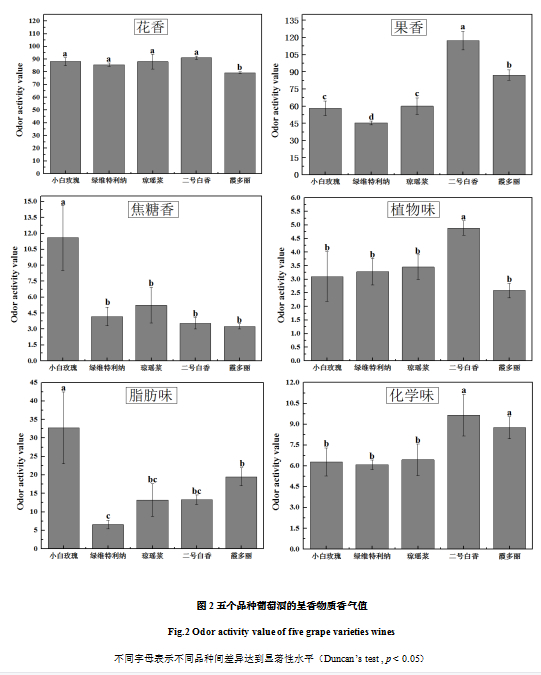
将5个品种的香气值(OAV)按照感官指标进行分类,主要分为六大类:花香、果香、焦糖香、植物味、脂肪味、化学味,这六大类香气的香气值均大于0.1,可以认为对葡萄酒的香气贡献明显,总香气值小于0.1的类别已经被忽略。对品种间不同类别香气的香气值进行比较,结果如图2所示。5个品种均是以花香、果香为主要香气特征。其中花香主要来源于酒中的β-紫罗兰酮、β-大马士酮、β-里那醇、α-萜品醇、香叶醇、苯乙醇、月桂酸乙酯和辛酸乙酯等物质,果香主要来源于酒中的β-大马士酮、β-里那醇、4-萜品醇、香茅醇、右旋柠檬烯、氧化玫瑰以及大部分酯类物质,焦糖香主要来源于酒中的辛酸-3-甲基丁酯、苯乙醇、辛酸、正己酸、丁酸、乳酸乙酯等物质。植物味、脂肪味和化学味一般认为是对葡萄酒的感官起负面作用的三类香气。其中植物味也被称为生青味,来源主要是C6醇等物质,脂肪味的来源则是大部分的挥发酸等物质,化学味的主要来源是高级醇等物质[20]。花香和果香是体现葡萄酒优良香气的重要指标[21-23],分析图2可得,‘小白玫瑰’的花香、焦糖香表现最为突出,但其脂肪味较重。‘二号白香’的花香、果香表现最为突出,但其植物味和化学味同样较重。‘绿维特利纳’和‘琼瑶浆’的香气表现相近,二者的花香、焦糖香、植物味、脂肪味以及化学味无明显差异,但是‘琼瑶浆’的果香显著强于‘绿维特利纳’。‘霞多丽’的花香比其余四个品种都差;果香位于第二,仅次于‘二号白香’;焦糖香较弱;植物味和脂肪味较轻,但其化学味较重。总体来说,‘小白玫瑰’的香气整体表现最好,‘二号白香’和‘霞多丽’次之,‘琼瑶浆’第四,‘绿维特利纳’的香气整体表现最差。
3 讨论
葡萄酿造学和栽培学讲究风土,风土条件主要是指酿酒葡萄栽培环境的生态条件,主要包括气候(积温、光照、降雨量等)、土壤、栽培方式等,这些条件决定了葡萄原料的品质,包括香气特征,同一品种的葡萄在不同的环境下所表现的性状截然不同,进而带来不同品质与风格特征的葡萄酒[24-26]。‘绿维特利纳’是奥地利种植最为广泛也是在当地颇受欢迎的葡萄品种,其酿造出的葡萄酒风格多变,充满浓郁的柑橘类和热带水果香气以及带有新鲜研磨白胡椒气味的余味[10],但在本研究中,‘绿维特利纳’酒中的果香OAV值最低,香气轮廓整体表现最差,并不符合其在奥地利的特点,这可能是因为不同的风土条件造成了‘绿维特利纳’的不同酿酒特性表现。而原产希腊的‘小白玫瑰’,喜高温干燥,对土壤要求不严,适应性强,但抗病性弱,其对气候、土壤条件的要求正与新疆天山北麓产区的条件契合:光照资源丰富、病虫害少。且在本研究中,‘小白玫瑰’香气物质种类最多,整体香气轮廓表现最好。说明在类似风土条件下,同一品种的表现具有相似性[16]。
葡萄酒的香气是影响葡萄酒品质和消费者喜好的重要内在因素之一[27],对葡萄酒香气的质量和特性而言,来自于葡萄自身的香气物质起着最为重要的作用,它们比葡萄酒中的其它香气物质更为重要。这些来自于葡萄本身的香气物质就是所谓的“品种香”[28]。葡萄品种既表明了葡萄的身份也标明了同一品种葡萄所酿酒的特性,是影响葡萄酒品质的自然因素。在发酵过程中,酵母会利用葡萄中的芳香前体物质,经过一系列生物化学反应,酿造出风格迥异的葡萄酒,其差异主要表现在香气物质种类、组成比例以及OAV值的不同,所以葡萄品种的香气是影响葡萄酒最终香气的基础。根据葡萄果实中的香气成分可将葡萄品种分为3种类型:玫瑰香型品种、非玫瑰香的芳香型品种和非芳香型品种。在本研究中,‘小白玫瑰’和‘二号白香’为玫瑰香型品种,它们的萜烯类香气物质浓度最高,分别为444.67 μg/L和462.12 μg/L,主要的呈香物质为右旋柠檬烯、γ-萜品烯、β-罗勒烯、氧化橙花醇、β-里那醇、4-萜品醇、脱氢芳樟醇、α-萜品醇和氧化芳樟醇。‘琼瑶浆’为非玫瑰香芳香型品种,也存在上述大多数的萜类化合物,但其除了香茅醇、香叶醇、橙花醇之外,浓度普遍较低。‘霞多丽’和‘绿维特利纳’为非芳香型品种,其中‘霞多丽’以果香为主,主要的呈香物质是乙酸酯类物质;而‘绿维特利纳’则以花香为主,主要的呈香物质是β-大马士酮。5个不同白葡萄品种所酿葡萄酒的风格各异,最终由于各类香气化合物之间的相互作用,使得‘小白玫瑰’酒的整体香气轮廓最佳;‘二号白香’与‘霞多丽’所酿酒风格相似,香气表现较好;‘琼瑶浆’所酿酒较为均衡,无明显缺陷也无明显特色;而‘绿维特利纳’酒的香气表现要比其余4个品种差,品种特色在该产区并未表现出来。
4 结论
本研究通过对新疆中信国安葡萄酒业有限公司玛纳斯产区的5个白葡萄品种(‘霞多丽’、‘琼瑶浆’、‘小白玫瑰’、‘绿维特利纳’和‘二号白香’)进行小规模发酵实验,并利用GC-MS联用技术对葡萄酒中的香气物质进行检测和分析,明确了该产区5个白葡萄品种所酿葡萄酒之间的差异。研究结果表明,‘小白玫瑰’的香气物质种类最丰富(87种),花香和焦糖香浓郁,果香适中,植物味和化学味较轻,虽脂肪味较重,但葡萄酒香气轮廓的整体表现较好,所以其在该产区具有酿造优质干白葡萄酒的潜力;‘二号白香’和‘霞多丽’在葡萄酒风格上较为相似,二者皆果香浓郁,化学味较重;且‘霞多丽’在该产区种植多年,发展相对成熟,故可推测‘二号白香’也比较适宜在该产区酿造干白葡萄酒;而‘琼瑶浆’和‘绿维特利纳’虽然香气物质种类丰富,花香浓郁,植物味、脂肪味和化学味较轻,但二者香气轮廓整体表现欠佳,其中‘绿维特利纳’最次,所以‘绿维特利纳’是否适宜于该产区干白葡萄酒的酿造还有待继续探究。
参考文献
[1]姜锡瑞, 段钢. 酶制剂实用技术手册[M]. 北京: 中国轻工业出版社, 2002.
[2]王方, 王伟, 王树生, 等. 两种干白葡萄酒香气比较研究[J]. 酿酒科技, 2007, (5): 71-73. DOI: 10.3969/j.issn.1001-9286.2007.05.017.
[3]魏巍, 卢浩成, 贾倩倩, 等. 天山北麓产区4个葡萄品种酿酒品质探究[J]. 中外葡萄与葡萄酒, 2020, 2: 1-8.
[4]李华, 胡博然, 张予林. 贺兰山东麓地区霞多丽干白葡萄酒香气成分的GC/MS分析[J]. 中国食品学报, 2004, 4(3): 72-75. DOI: 10.3969/j.issn.1009-7848.2004.03.016.
[5]唐菊莲, 蒋凌云. 新疆玛纳斯酿酒葡萄产业发展经验[J]. 果树实用技术与信息, 2011, 11: 38-38. DOI: CNKI:SUN:GSJS.0.2011-11-027.
[6]王东. 玛纳斯区域酿酒葡萄‘赤霞珠’的生长结果习性与经济性状研究[D]. 北京: 中国农业大学, 2014. DOI: 10.7666/d.Y2761771.
[7]刘延琳, 惠竹梅, 张振文. 优良白葡萄酒品种简介[J]. 酿酒, 2002, 29(5): 10-12. DOI: 10.3969/j.issn.1002-8110.2002.05.005.
[8]李福东. 沙城产区琼瑶浆葡萄酒中挥发性香气成分分析[J]. 中外葡萄与葡萄酒, 2011, 3: 58-60. DOI: 10.3969/j.issn.1004-7360.2011.03.018.
[9]房林, 张振文, 贾媛媛, 等. 杨凌地区3个葡萄品种光合特性比较[J]. 干旱地区农业研究, 2009, 27(5): 203-208. DOI: CNKI:SUN:GHDQ.0.2009-05-038.
[10]King K. Gruner Veltliner[J]. Gastronomica, 2003, 3(4): 77-78. DOI: 10.1525/gfc.2003.3.4.77.
[11]Guo C, Yan-Nan H, Tai-Xin Y, et al. Effects of Climatic Conditions and Soil Properties on Cabernet Sauvignon Berry Growth and Anthocyanin Profiles[J]. Molecules, 2014, 19(9): 13683-13703. DOI: 10.3390/molecules190913683.
[12]中国国家标准化管理委员会. 葡萄酒、果酒通用分析方法: GB/T15038—2006[S]. 北京:中国标准出版社,2006.
[13]Wu Y W, Pan Y, Qu Q, et al. Comparison of volatile profiles of nine litchi (Litchi chinensis Sonn.) cultivars from Southern China[J]. J Agric Food Chem, 2009, 57(20): 9676-9681. DOI: 10.1021/jf902144c.
[14]曹建宏, 张振文, 张莉, 等. 霞多丽干白葡萄酒香气成分的GC/MS分析[J]. 西北林学院学报, 2006, 21(4): 132-134. DOI: 10.3969/j.issn.1001-7461.2006.04.036.
[15]陈新军, 刘树文, 张予林. 新天霞多丽干白葡萄酒香气成分的GC/MS分析[J]. 中外葡萄与葡萄酒, 2007, 4(3): 11-14. DOI: 10.3969/j.issn.1004-7360.2007.04.003.
[16]卢浩成, 魏巍, 贾倩倩, 等. 玛纳斯产区四个酿酒葡萄品种酒质特征的初步研究[J]. 中国酿造, 2019, 38(12): 25-30. DOI: CNKI:SUN:ZNGZ.0.2019-12-006.
[17]Cai J, Zhu B Q, Wang Y H, et al. Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J]. Food chemistry, 2014, 154(1): 217-229. DOI: 10.1016/j.foodchem.2014.01.003.
[18]蔡建. 发酵前处理工艺对天山北麓‘赤霞珠’葡萄酒香气改良研究[D]. 北京: 中国农业大学, 2014. DOI: CNKI:CDMD:1.1014.225951.
[19]王方, 王树生. 葡萄酒中的香味物质的来源[J]. 中外葡萄与葡萄酒, 2005, 5: 50-51. DOI: 10.3969/j.issn.1004-7360.2005.05.022.
[20]Mateo, Jimenez J J. Monoterpenes in grape juice and wines[J]. Journal of Chromatography A, 2000, 881(1): 557-567. DOI: 10.1016/S0021-9673(99)01342-4.
[21]Palliotti A, Tombesi S, Silvestroni O, et al. Changes in vineyard establishment and canopy management urged by earlier climate related grape ripening: A review[J]. Scientia Horticulturae, 2014, 178: 43 54.
[22]Salamon A. Techniques to achieve moderate alcohol levels in South African wine[D]. Assignment submitted in partial requirement for the Cape Wine Master Diploma , 2006.
[23]Gracad S M, Vitoria S R M, Loureiro-Dias M C, et al. Flow cytometric assessment of membrane integrity of ethanol-stressed Oenococcus oeni Cells[J]. Applied and Environmental Microbiology, 2002, 68(12): 6087-6093. DOI: 10.1007/s00128-009-9864-8.
[24]Anesi A, Stocchero M, Santo S D, et al. Towards a scientific interpretation of the terroir concept: plasticity of the grape berry metabolome[J]. Bmc Plant Biology, 2015, 15(1): 191. DOI: 10.1186/s12870-015-0584-4.
[25]Leeuwen C V, Friant P, Xavier Choné, et al. Influence of climate, soil, and cultivar on terroir[J]. American Journal of Enology & Viticulture, 2004, 55(3): 207-217.
[26]Chloé Roullier-Gall, Lucio M, Noret L, et al. How subtle is the “terroir” effect? Chemistry-related signatures of two “climats de Bourgogne”[J]. PLOS ONE, 2014, 9. DOI: 10.1371/journal.pone.0097615.
[27]Charters S, Pettigrew S. The dimensions of wine quality[J]. Food Quality & Preference, 2007, 18(7): 997-1007. DOI: 10.1016/j.foodqual.2007.04.003.
[28]Ribéreau-Gayon P, Glories Y, Maujean A, et al. The chemistry of wine stabilization and treatments[M]. Handbook of Enology, New York: John Wiley & Sons, 2000, 2: 187-255.