鲜食葡萄品种改良岗位
1 材料与方法
1.1 材料
供试鲜食葡萄品种为‘瑞都红玫’和‘瑞都早红’,于2017年9月采收于北京市林业果树科学院葡萄试验园。试验地点在北京市林业果树科学研究院冷库(2 ± 1 ℃,,90% RH)。
1.2 试验方法
选择颗粒饱满、果粒大小均匀、无病、无机械伤、无落粒的葡萄果穗放入开孔纸板箱,每箱5 kg。预冷至-1 ~ 0 ℃,放入PE葡萄保鲜膜中,封口入库。每个品种设3-5次重复,每隔15天(d)进行调查并取样测试相关指标。
1.3 外观品质指标测定
失重率:穗重失重率(%)=(贮前穗重-贮后穗重)/贮前穗重×100%;烂果率:烂果率(%)=(腐烂果粒的个数/果粒总数)× 100%;落粒率:落粒率(%)=落粒果重/总果重×100%;果柄耐拉力:将葡萄果柄与弹簧秤相连,沿果粒纵轴方向拉至果柄从果实上脱离,记录弹簧秤最终读数,即为果柄耐拉力,每个处理重复10-20次以上,取平均值;果梗褐变指数:褐变指数(%)=/(最高级数×总穗数)×100%,穗轴(果梗)褐变级别:无褐变的为0级,褐变0 - 1/4为1级,褐变1/4 - 1/2为2级,褐变1/2 - 3/4为3级,褐变3/4以上为4级。
1.4 单萜化合物提取
单萜的提取和测定参考Wen等[15]2015年发表的方法,略有改动。首先葡萄果实样品去除种子,以避免对挥发性化合物的提取产生任何可能的影响。其余果实部分(约50 g)在液氮中研磨,研磨过程中加入1 g PVPP和0.5 g D-葡萄糖酸内酯。得到的果粉样品在4 ℃低温浸渍4 h后,立即在4 ℃下以8000×g离心10 min,得到澄清的葡萄汁。澄清葡萄汁直接检测游离单萜化合物。对每个样品进行三次独立提取。
糖苷结合态化合物提取,固相萃取柱(Cleanert PEP-SPE柱,天津博纳艾杰尔公司)依次经10 mL甲醇和10 mL水活化后,加入2 mL上述澄清葡萄汁样品。经2 mL水洗脱去除一些糖、酸等低分子量的极性化合物后,加入5 mL二氯甲烷洗脱进一步去除大部分游离态香气物质的干扰,最后用20 mL甲醇将结合态香气物质洗脱,收集至50 mL的圆底烧瓶内,整个固相萃取过程洗脱剂流速保持2 mL/min。所得甲醇洗脱液在旋转蒸发器下蒸发至干燥,然后重新溶解在10 mL的2 M柠檬酸-磷酸盐缓冲溶液(pH 5.0)中。在40 ℃的培养箱中,用200 μL 糖苷酶AR 2000(100 mg/L,在pH 5.0的2 M柠檬酸盐/磷酸盐缓冲液中)酶解结合型挥发性化合物16小时。每个样品做两个独立的重复。
此后,在以下SPEME条件下提取游离和结合态形式挥发物:将5 mL提取液与10 μL 4-甲基-2-戊醇(内标)和1g NaCl混合在20 mL聚四氟乙烯硅隔膜盖小瓶中。将样品瓶在40 ℃下在500 rpm搅拌下平衡30分钟。之后将活化的SPME针头(Supelco,Bellefonte,PA,USA)插入小瓶顶空,在40 ℃下吸附挥发分30 min。最后,将SPME针头插入GC进样口8 min,释放挥发物。
1.5 单萜化合物检测
气相色谱与质谱联用仪(GC-MS)型号:Agilent 7890B GC和Agilent 5977A MS (Agilent,美国)。毛细管柱为HP-INNOwax 60m×0.25mm×0.25μm (J&W Scientific,美国)。
GC-MS条件参考Wu等[16]发表的方法:载气为高纯氦气(He,>99.999%),流速为1 mL/min;进样口温度为250 ℃,采样不分流模式,解析时间8 min;升温程序为50 ℃保持1 min,然后以3 ℃/min 升温到220 ℃,保持5 min。质谱电离方式为EI,离子源温度为230 ℃,电离能为70 ev,四级杆温度为150 ℃,质谱接口温度为280 ℃,质量扫描范围为30-350 u。
1.6 单萜化合物定性定量分析
数据处理和分析是通过ChemStation软件(安捷伦科技公司)进行。利用NIST 05标准库中参考标准品的保留指数和质谱匹配来鉴别挥发性化合物。当标准品不可用时,处理保留指数与文献中报告的保留指数的比较。为了量化,使用标准物与内标物的峰面积比与参考标准物浓度对有参考标准物的挥发物进行量化,而使用具有相似碳原子或结构的标准物对没有可用标准物的挥发物进行量化。
1.7 数据处理与统计分析
数据统计分析利用分析软件SPSS 13.0,采用Duncan 多重比较进行显著性方差分析,最低显著水平P<0.05;主成分分析和聚类分析采用MetaboAnalyst 4.0;绘图采用Excel 和Sigma Plot 10.0。
2 结果
2.1 两个葡萄品种低温贮藏过程中果实理化和贮藏特性变化
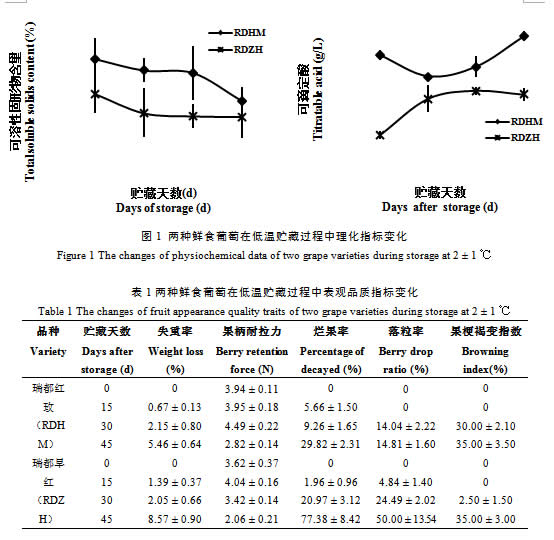
两个品种葡萄果实可溶性固形物含量在低温贮藏过程中均表现为逐渐降低的趋势,‘瑞都红玫’果实的可溶性固形物含量高于‘瑞都早红’(图1)。两个品种果实中可滴定酸含量在低温贮藏过程中变化趋势略有差异,‘瑞都红玫’中可滴定酸含量在贮藏15 d后有所下降,之后略有上升;而‘瑞都早红’可滴定酸含量在贮藏15 d后上升,之后在贮藏45 d略有下降(图1)。‘瑞都红玫’果实中可滴定酸含量高于‘瑞都早红’。
失重率、烂果率、落粒率、果柄耐拉力、果梗褐变指数等是评价果品耐贮性好坏、商品性优劣的直观表现。由表1可见,随着贮藏期的延长,两个品种的失重率均呈上升趋势,‘瑞都早红’在贮藏后期失重幅度增大,贮藏45 d后达到8.57 %,‘瑞都红玫’失重率为5.46%;在低温贮藏过程中,‘瑞都红玫’的烂果率上升幅度较小。而‘瑞都早红’在贮藏早期烂果率较低(贮藏15 d后仅为1.96 %),但贮藏中后期烂果现象比较明显;在整个贮藏过程中,‘瑞都红玫’落粒率均比较低,‘瑞都早红’落粒现象明显,到贮藏45 d达到50 %;两个葡萄品种果柄耐拉力都随贮藏时间推移降低,‘瑞都红玫’的果柄耐拉力高于‘瑞都早红’;两个品种在贮藏早期(15 d)果梗都没有发现褐变现象,之后,都有不同程度的褐变发生,到贮藏45 d时,‘瑞都红玫’果梗褐变程度高于‘瑞都早红’。综合五项指标,‘瑞都红玫’的低温耐贮性优于‘瑞都早红’。
2.2 两个品种葡萄果实中的单萜化合物组分和含量比较
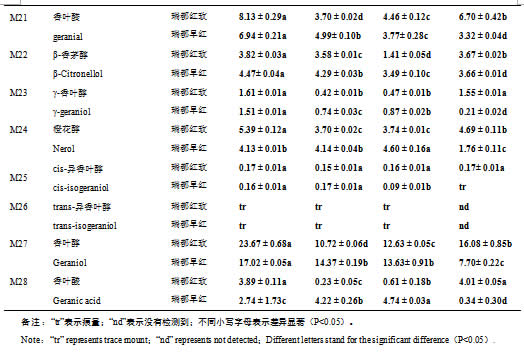
利用SPME-GC-MS技术,本研究对‘瑞都红玫’和‘瑞都早红’葡萄果实中28种单萜游离态和糖苷结合态两种形式的化合物进行了定性定量分析(表2-3)。28种游离态单萜和糖苷结合态单萜在两个品种葡萄果实中均检测到,含量存在差异。在两个品种葡萄果实中,游离态单萜含量最高的六个化合物均是里那醇(‘瑞都红玫’448.10 µg/L;‘瑞都早红’317.18 µg/L)、β-月桂烯(‘瑞都红玫’72.62 µg/L;‘瑞都早红’48.94 µg/L)、β-cis-罗勒烯(‘瑞都红玫’44.57 µg/L;‘瑞都早红’19.69 µg/L)、柠檬烯(‘瑞都红玫’30.66 µg/L;‘瑞都早红’12.36 µg/L)、cis-呋喃型氧化里那醇(‘瑞都红玫’25.02 µg/L;‘瑞都早红’14.47 µg/L)和香叶醇(‘瑞都红玫’23.67 µg/L;‘瑞都早红’17.02 µg/L)。除了个别化合物如β-香茅醇、cis-氧化玫瑰和trans-呋喃型氧化里那醇,其余游离态单萜在‘瑞都红玫’中的含量均高于‘瑞都早红’(表2)。游离态单萜总量在‘瑞都红玫’(776.97 µg/L)中也显著高于‘瑞都早红’(503.18 µg/L)(图2)。
两个品种葡萄果实中糖苷结合态单萜含量较高的六个化合物依次是里那醇(‘瑞都红玫’170.62 µg/L;‘瑞都早红’79.89 µg/L)、β-月桂烯(‘瑞都红玫’104.16 µg/L;‘瑞都早红’71.91 µg/L)、香叶醇(‘瑞都红玫’74.25µg/L;‘瑞都早红’64.09 µg/L)、香叶醛(‘瑞都红玫’57.75 µg/L;‘瑞都早红’51.72 µg/L)、β-cis-罗勒烯(‘瑞都红玫’49.82 µg/L;‘瑞都早红’34.02 µg/L)和橙花醚(‘瑞都红玫’40.48 µg/L;‘瑞都早红’31.93 µg/L)。这些主成分化合物在‘瑞都红玫’果实中含量高于‘瑞都早红’,而如:氧化玫瑰、香茅醇和橙花醇等糖苷结合态单萜的含量在‘瑞都早红’中较高(表3)。但是结合态单萜总量‘瑞都红玫’(752.54 µg/L)仍然高于‘瑞都早红’(566.18 µg/L)(图2)。
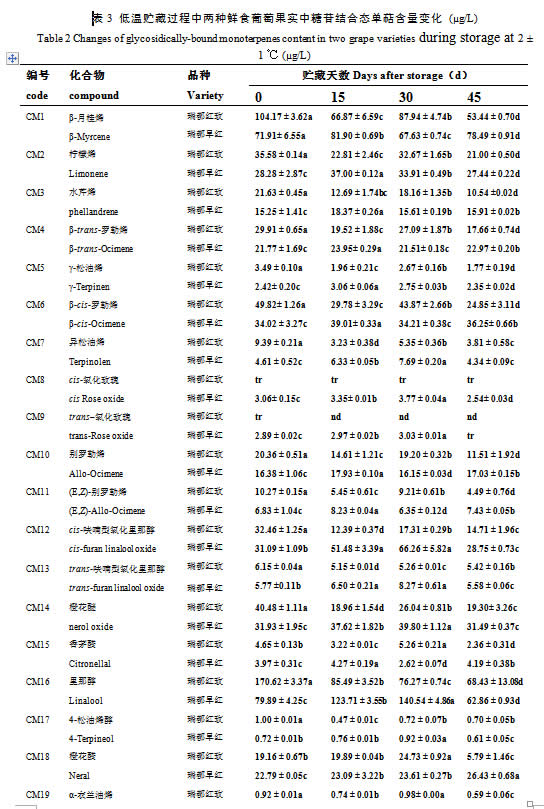
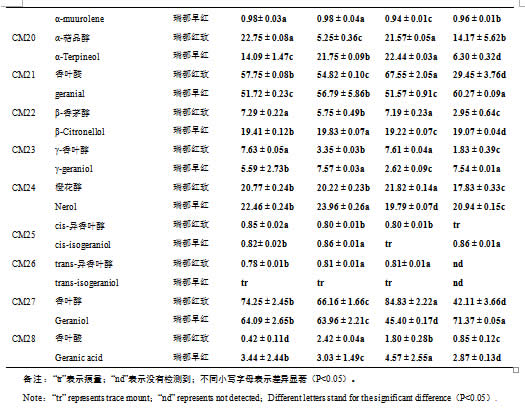
关于不同形式单萜含量高低比较,本研究发现在所检测的28种单萜中,除了里那醇、异松油烯、氧化玫瑰、trans-呋喃型氧化里那醇、4-松油烯醇和香叶酸六种化合物糖苷结合态含量在‘瑞都红玫’果实中低于游离态,其余单萜糖苷结合态含量均高于游离态(表2-3)。但是总糖苷结合态单萜含量略低于游离态(图2);而在‘瑞都早红’果实中,除了里那醇,其余27种单萜糖苷结合态含量均高于游离态(表2-3),总糖苷结合态单萜含量高于游离态(图2)。
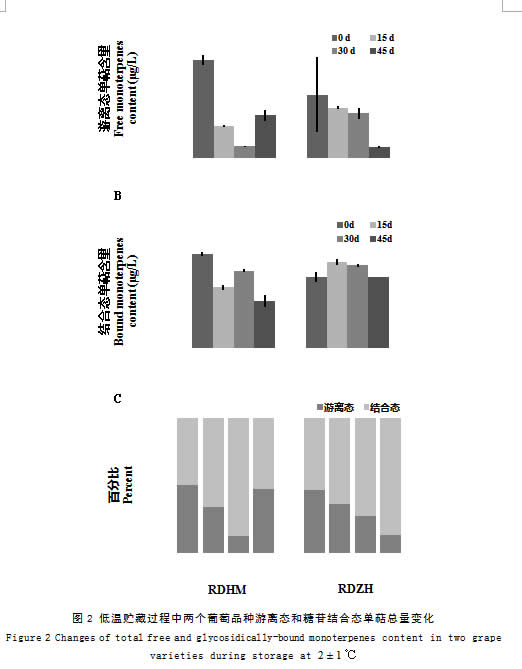
2.3 低温贮藏过程中‘瑞都红玫’果实中单萜化合物变化
在整个低温贮藏过程中,‘瑞都红玫’果实中主要游离态单萜成份略有波动。贮藏初期(15 d)变化不大,主要游离态单萜为里那醇(117.34 µg/L)、β-月桂烯(29.98 µg/L)、β-cis-罗勒烯(14.26 µg/L)、cis-呋喃型氧化里那醇(12.55 µg/L)、柠檬烯(11.71 µg/L)和香叶醇(10.72 µg/L);到贮藏30 d时,‘瑞都红玫’果实中含量最高的6个化合物依次为里那醇(18.43 µg/L)、香叶醇(12.62 µg/L)、β-月桂烯(10.10 µg/L)、柠檬烯(7.40 µg/L)、β-cis-罗勒烯(6.09 µg/L)和α-萜品醇(4.85 µg/L);贮藏后45 d,α-萜品醇含量降低而橙花醚含量升高成为主含量单萜。在整个低温贮藏过程中,里那醇含量均最高。
28种游离态单萜含量在贮藏初期(15 d)均呈现下降趋势;在贮藏30 d后,包含里那醇在内的大部分单萜含量持续下降,而香叶醇、香叶酸、橙花醇、香叶醛、香茅醛和橙花醛等单萜含量略有上升;贮藏后期(45 d),除了橙花醛,其它27种单萜含量表现上升趋势(表2)。聚类分析结果显示,在低温贮藏过程中‘瑞都红玫’果实中游离态单萜含量变化趋势主要聚为四类(图3A)。第一类包含β-月桂烯(M1)、水芹烯(M3)、(E, Z)-别罗勒烯(M11)、cis-呋喃型氧化里那醇(M12)、trans-呋喃型氧化里那醇(M13)、里那醇(M16)和β-香茅醇(M22),这一类单萜在低温贮藏过程中含量持续降低,到贮藏30 d达到最低,贮藏后期略有上升;第二类变化趋势与第一类相近,不同的是这类化合物在低温贮藏15 d后含量就急剧下降,到贮藏中期(30 d)降至最低,贮藏45 d时含量显著升高,这类化合物包含柠檬烯(M2)、β-trans-罗勒烯(M4)、γ-松油烯(M5)、β-cis-罗勒烯(M6)、异松油烯(M7)、别罗勒烯(M10)、4-松油烯醇(M17)和α-萜品醇(M20);第三类有cis-氧化玫瑰(M8)、香茅醛(M15)、橙花醇(M24)、香叶醇(M27)和香叶酸(M28)等单萜,这类单萜在贮藏初期(15 d)含量即降为最低,贮藏中后期含量上升,贮藏45 d后含量升高明显;第四类仅包含橙花醛(M18),尽管M18在贮藏初期含量也略有下降,但是与前三类不同,该单萜在贮藏30 d后含量最高,贮藏45d后含量最低。
在低温贮藏过程中,主要糖苷结合态单萜组分差异不明显,主要包括里那醇、β-月桂烯、香叶醇、香叶醛和β-cis-罗勒烯等单萜。在贮藏30 d时,β-月桂烯(87.94 µg/L)和香叶醇(84.83 µg/L)含量升高,高于结合态里那醇含量(76.27 µg/L)(表3)。大部分结合态单萜变化趋势相似,贮藏初期(15 d)表现先下降,中期(30 d)又有所上升,贮藏后期(45 d)急剧下降趋势(表3)。聚类分析显示结合态单萜在低温贮藏过程中变化趋势也主要聚为四类(图3B):第一类有β-月桂烯(CM1)、柠檬烯(CM2)、水芹烯(CM3)、β-trans-罗勒烯(CM4)、γ-松油烯(CM5)、β-cis-罗勒烯(CM6)、别罗勒烯(CM10)、(E, Z)-别罗勒烯(CM11)、香茅醛(CM15)、α-衣兰油烯(CM19)和γ-香叶醇(CM23),这类糖苷结合态单萜在贮藏15 d时含量显著下降,之后上升,到贮藏45 d又急剧下降到最低含量;第二类结合态单萜包含异松油烯(CM7)、cis-呋喃型氧化里那醇(CM12)、trans-呋喃型氧化里那醇(CM13)、橙花醚(CM14)、里那醇(CM16)、4-松油烯醇(CM17)和α-萜品醇(CM20),这类单萜在低温贮藏过程中含量持续降低,没有明显的升高过程;第三类结合态单萜在贮藏早期含量降低不明显,在贮藏30 d时略有上升,到后期(45 d)急剧降到最低,这类单萜包含橙花醛(CM18)、香叶醛(CM21)、β-香茅醇(CM22)、橙花醇(CM24)、cis-异香叶醇(CM25)和香叶醇(M27);最后一类仅包含香叶酸(CM28),在贮藏15d时含量升高,之后逐渐降低。
在低温贮藏过程中,‘瑞都红玫’果实中游离态单萜总量表现先下降后期略有升高的趋势,游离态单萜占总单萜的比例也表现先下降后期升高的趋势(图2)。而糖苷结合态单萜总量在贮藏初期(15 d)下降,贮藏30 d后又升高,之后又略有下降(图2)。贮藏15d后,糖苷结合态单萜含量高于游离态单萜含量。
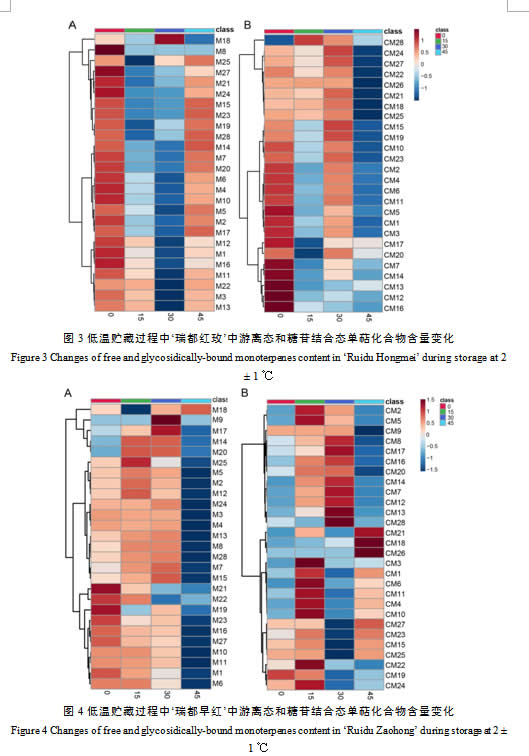
2.4 低温贮藏过程中‘瑞都早红’果实中单萜化合物变化
在低温贮藏过程中,‘瑞都早红’果实中主要游离态单萜化合物组分改变不大。里那醇含量最高,其次是β-月桂烯,其它化合物含量高低略有变化(表2)。
大多数游离态单萜含量在低温贮藏过程中呈现下降的趋势。聚类分析结果显示(图4A),游离态单萜变化趋势主要聚为四类:第一类包含β-月桂烯(M1)、β-cis-罗勒烯(M6)、别罗勒烯(M10)、(E, Z)-别罗勒烯(M11)、里那醇(M16)、α-衣兰油烯(M19)、香叶醛(M21)、β-香茅醇(M22)、γ-香叶醇(M23)和香叶醇(M27),这类单萜含量在低温贮藏过程中逐渐降低,到贮藏45 d降到最低;第二类单萜有柠檬烯(M2)、水芹烯(M3)、β-trans-罗勒烯(M4)、γ-松油烯(M5)、异松油烯(M7)、cis-氧化玫瑰(M8)、cis-呋喃型氧化里那醇(M12)、trans-呋喃型氧化里那醇(M13)、香茅醛(M15)、橙花醇(M24)和香叶酸(M28),这类化合物在贮藏中早期含量上升,贮藏后期急剧下降,降到最低;第三类包含四种单萜trans–氧化玫瑰(M9)、橙花醚(M14)、4-松油烯醇(M17)和α-萜品醇(M20),它们的含量在贮藏15 d或者贮藏30 d显著升高,之后下降;第四类单萜仅包含橙花醛(M18)一种化合物,该化合物在贮藏15 d含量显著下降,之后逐渐升高。
在低温贮藏前中期,‘瑞都早红’果实中主要糖苷结合态单萜组分基本没有变化,含量最高的化合物是里那醇,其次是β-月桂烯和香叶醇等单萜。到贮藏后期(45 d),里那醇含量下降,β-月桂烯和香叶醇含量升高,分别成为第一、二主含量单萜(表3)。低温贮藏过程中糖苷结合态单萜含量变化趋势主要聚为两大类(图4B):第一类包含β-月桂烯(CM1)、水芹烯(CM3)、β-trans-罗勒烯(CM4)、β-cis-罗勒烯(CM6)、别罗勒烯(CM10)、(E, Z)-别罗勒烯(CM11)、香茅醛(CM15)、γ-香叶醇(CM23)、cis-异香叶醇(CM25)、香叶醇(M27);橙花醛(CM18)、香叶醛(CM21)、α-衣兰油烯(CM19)、β-香茅醇(CM22)、橙花醇(CM24)、cis-异香叶醇(CM25)等单萜,这类化合物在贮藏15 d时升高,之后下降,到贮藏45 d含量又有所回升;第二类单萜主要有cis-氧化玫瑰(CM8)、trans-氧化玫瑰(CM9)、里那醇(CM16)、4-松油烯醇(CM17)、α-萜品醇(CM20)、异松油烯(CM7)、cis-呋喃型氧化里那醇(CM12)、trans-呋喃型氧化里那醇(CM13)、橙花醚(CM14)、香叶酸(CM28)、柠檬烯(CM2)、和γ-松油烯(CM5)等。这类糖苷结合态单萜在贮藏前中期含量呈上升趋势,到贮藏45 d显著下降。
在低温贮藏过程中,‘瑞都早红’果实中游离态单萜总量表现逐渐降低的模式,到贮藏45 d降到最低仅为89.26 µg/L;糖苷结合态单萜总量在贮藏初期(15 d)升高,贮藏30 d后逐渐降低(图2)。整个贮藏期间,游离态单萜占总单萜的比例逐渐降低,而糖苷结合态比例上升(图2)。
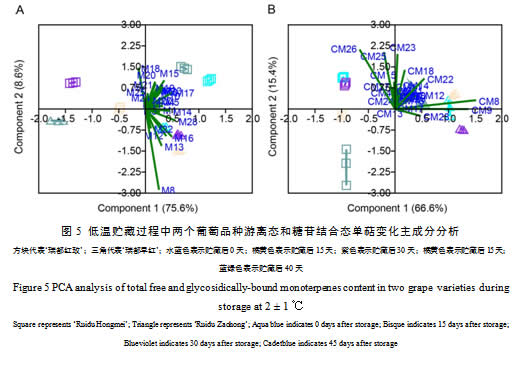
2.5 低温贮藏过程中两个葡萄品种单萜化合物主成分分析
以不同贮藏时期2个葡萄品种游离态单萜定量数据进行PCA分析(图5A),从数据中提取了两个主成分,主成分1(PC1)和主成分2(PC2)分别解释了75.6 %和8.6 %的变量信息,这两个主成分占据了所有数据变化的84.2%的变异,反映了化合物的绝大部分信息。在PC1方向,不同贮藏时间样品可以得到很好地区分,贮藏初期(0 d)和后期(45 d)的‘瑞都红玫’样品位于第一象限,贮藏15 d和30 d样品位于第二象限;而‘瑞都早红’在贮藏后期(45 d)与其它时期明显区分开,位于第三象限。除了橙花醛(M18),其它所有游离态单萜含量与PC1均呈正相关。由图5A可见,对于PC1,香叶酸(M28)、橙花醚(M14)、里那醇(M16)、4-松油烯醇(M17)、cis-呋喃型氧化里那醇(M12)和β-cis-罗勒烯(M6)等单萜载荷值较高,这些化合物在贮藏初期(0 d)和后期(45 d)‘瑞都红玫’样品中含量显著高于贮藏15 d和30 d样品(表2);在贮藏后期(45 d)‘瑞都早红’样品中的含量明显低于其它三个时期样品(表2)。这些单萜可以作为区分贮藏时期样品的主要贡献差异化合物成分。在PC2方向,两个葡萄品种明显区分开,‘瑞都红玫’样品位于第一和二象限,而‘瑞都早红’位于第三四象限。在PC2中,cis–氧化玫瑰(M8)、橙花醛(M18)和trans-呋喃型氧化里那醇(M13)等游离态单萜载荷绝对值最高,其中M8和M13与PC2呈负相关。‘瑞都早红’中这两个单萜含量明显高于‘瑞都红玫’,而M18的含量低于‘瑞都红玫’。这三个游离态单萜可以作为两个品种区分的主要差异化合物。
以2个葡萄品种不同贮藏时间糖苷结合态单萜定量数据进行PCA分析(图5B),从数据中也提取了两个主成分,分别解释了66.6 %(PC1)和15.4 %(PC2)的变量信息。根据PC1可以把两个葡萄品种进行很好的区分,‘瑞都红玫’样品位于第二、三象限,而‘瑞都早红’样品主要位于第一、四象限。在PC1中,cis-氧化玫瑰(CM8)、trans-氧化玫瑰(CM9)、trans-异香叶醇(CM26)和β-香茅醇(CM22)等单萜载荷值较大,可以作为品种区分的主要差异物。根据PC2成分,两个品种不同贮藏时期样品也可以区分,‘瑞都红玫’贮藏0 d和30 d样品位于第二象限,而贮藏15 d和45 d样品位于第三象限;‘瑞都早红’贮藏30 d样品明显远离其它时期样品。在PC2中,trans-异香叶醇(CM26)、γ-香叶醇(CM23)、cis-异香叶醇(CM25)和橙花醛(CM18)可以作为主要差异成分。