种苗扩繁与生产技术岗位
王军
水分的有效性影响叶幕发育、葡萄树体微气候、产量和果实成分,缺水对植株生长和产量形成造成压倒性的抑制(Kramer and Boyer, 1995)。在自然条件下,水分通过降雪、降雨和暂时储存于土壤中的水并通过植物根的汲取供应,但是,不同地区和不同年份间降水量差异很大,在某些地区和某些年份可能严重损害葡萄树体的表现和葡萄栽培的经济价值。水分的有效性不仅取决于一个葡萄园所接收到的降雨量,也取决于何时降雨和蒸发有多快。此外,土壤的持水能力和可被植物体利用的水量随土壤深度、质地(即粘土、粉土和砂粒的相对比例)和有机质的含量而变化。例如,细壤土的有效水分比粗糙的沙土高六倍,尽管大量的水分被壤土紧紧地吸附,但更容易进入根中。与壤土相比,虽然根能更容易从水饱和的沙土中汲取水分,但粗质土干燥的也更快,因而随着土壤水势(Ψ土壤)的降低,从沙土中汲取水分变得更加困难,这是因为土壤中水分移动的流体阻力(r土壤)在水饱和的沙土中比壤土中高约10倍(由于其较大的孔径),但同样机制造成的增加在木质部中就会引起空穴现象:干燥土壤中的孔隙充满了空气,从而导致毛细管作用失效。正如较大的木质部导管更易受到空穴的影响一样,较大的土壤孔隙(即粗糙的土壤)也更容易受到毛细管作用失效的影响。土壤类型越粗糙的,越容易限制植物体对水分的利用,而在质地细的土壤中,木质部对空穴作用的敏感性则更为有限(Sperry et al., 1998)。因此,生长在沙土中的葡萄植株比生长在壤土中的葡萄植株投入更多的资源用于根的生长,以增加根/新梢比,以弥补较低的土壤水分汲取能力。同样,粗质土壤比质地细的土壤更有利于根的向下生长,因为粗质土壤在表层Ψ土壤较低的情况下,可供汲取的水分较少。在同一个葡萄园内和不同葡萄园之间,因持水力和活动根区差异而造成的土壤水分变化,严重影响葡萄的树体表现(Hall et al., 2002; Lamb et al., 2004)。
当土壤水分远高于田间持水量时就会发生水涝,田间持水力也被称为排水上限,它通过直径大于30 μm的土壤孔隙对抗重力保留水分,而在更大孔隙中的水则会被排掉,且土壤的ΨM ≈ -0.01 MPa。葡萄植株能在营养液中生长,表明其在水涝期间未受到水分过多的损害。然而,在土壤水分高的情况下,例如因暴雨或过量灌溉引起的淹水,水分将空气从土壤空隙中排出,从而使适合根功能发挥所需的氧气(O2)不足,这种条件被称作氧不足(即O2亏缺),或者,在极端的情况下叫做缺氧,这是因为气体(包括O2)在水中扩散的速度比在空气中的扩散速度慢四个数量级。因为呼吸作用需要O2的供应,水涝下的根可能变为O2缺乏而不能呼吸,并转向丙酮酸的厌氧发酵来启动NADH到NAD的循环,通过糖酵解来持续产生ATP,这比呼吸作用的效率要低得多,在产生乳酸以及后来的挥发性乙醇的同时将储存的碳水化合物耗尽(Bailey-Serres and Voesenek, 2008; Zabalza et al., 2009)。呼吸作用的抑制伴随着活性氧的增加和根细胞质pH的下降,多余的质子进而堵塞细胞膜上的水孔蛋白,从而使根的透水性变差(Tournaire-Roux et al., 2003)。所以,水涝导致的缺氧会快速增大根的水分阻力并减少对水分的吸收,且与气孔导度和蒸腾速率的下降相关(Flore and Lakso, 1989; Keller and Koblet, 1994),这多少有些矛盾。因此,与水分亏缺相似,水分过多也会导致气孔的部分关闭,随着时间的延长,光合作用降低并可能损害光合器官(Else et al., 2009; Stevens and Prior, 1994)。此外,需要消耗大量能量的生理过程,如细胞分裂,也会停下来。
葡萄属的不同种对水涝的敏感性不同(Mancuso and Marras, 2006),例如河岸葡萄(Vitis riparia)可以耐受几天的根部浸水,这是通过迅速暂停根的代谢,特别是养分的吸收和同化,以保存能量(即减少对ATP的需求)。另一方面,敏感的种,如沙地葡萄(V. rupestris),不能调整其根的代谢,并将能量逐渐耗尽。此外,敏感的种没有能力抑制养分的吸收,可能导致离子(特别是K+)中毒、膜渗漏和死亡。与土壤紧实的影响类似,土壤水分过多似乎也增加根产生乙烯,并阻止这种气体从根部扩散出去(Feldman, 1984; Sharp and LeNoble, 2002)。根由甲硫氨酸代谢产生的少量乙烯通常促进根的生长,可能是通过增强组织对生长素和赤霉素的相应能力实现的(Kende and Zeevaart, 1997; Potters et al., 2009)。只要乙烯这种气体能够从根中扩散出去,乙烯与生长素一起也能诱导侧根和根毛的形成。然而,如果扩散受到抑制,乙烯会干扰根分生组织中的细胞分化,因而使根的生长减慢(Dugardeyn and Van Der Straeten, 2008; Feldman, 1984)。如果仅有部分根系受到水涝,则葡萄树体可能通过增加未受影响部分根的生长来进行补偿(Stevens et al., 1999)。缺氧也使木质部液流的pH升高,与葡萄树体经受水分缺乏的响应类似,导致新梢生长减弱、末端叶片灼烧、叶片变黄,在严重的情况下甚至导致葡萄树体死亡。随着土壤O2浓度的降低,花序分化、花粉萌发和花粉管的生长减弱。因此水涝对芽的结实力和坐果可能不利,如果土壤O2浓度降至5%以下,坐果可能降为零(Kobayashi et al., 1964; Stevens et al., 1999)。
冬季休眠期的水涝表面上对葡萄植株的影响较小(Williams et al., 1994)。此外,在河边和靠近河岸逐步形成的许多野生葡萄,当上游山上融化的雪水使河川径流达到年度高峰时,在萌芽期间或萌芽后不久经常遭受水涝(Mastin, 2008)。除了周期性的春季水涝,生长季过量供水也是一个问题,这主要涉及到沿海地区和山脉的迎风面区域,以及经常有夏季降雨的亚热带和热带地区,例如,中国大部分葡萄种植区所面临的实际情况:雨季与生长季重叠。因为降雨需要云层,这些地区也常常受到光照强度低的影响,从而减弱光合作用。此外,盆栽葡萄经常面临O2不足的风险。灌溉水从容器中排出后,土壤含水量(近表面的Ψp ≈ -0.001至-0.003 MPa)通常远高于葡萄园中的田间持水量水平,同时也取决于容器的高度,这就是(经常浇水)的盆栽植物更有可能遭受水涝而不是干旱的原因(Passioura, 2006)。
但是,世界上绝大部分葡萄是种植在或多或少有着地中海式气候的地区,那里冬季冷凉且潮湿;夏季温暖而干旱,且大气蒸发量高。因而,用于生长和果实生产的天然水供应和碳供应常常呈负相关(Bloom et al., 1985)。在地中海地区和山脉的背风(雨影)面区域,冬季为雨季,但并不总是下雨(Davenport et al., 2008b),从而使土壤湿润至田间持水量。土壤水分贮存的再充满可以通过减少径流和改善渗透性的覆盖作物而得到提高,虽然覆盖作物后来可能与葡萄植株竞争水分(Battany and Grismer, 2000; Celette et al., 2008; Klik et al., 1998)。随着温度的升高和水分的蒸发,土壤逐渐干燥,生长季通常以土壤湿度低和蒸汽压亏缺高(即温暖、热而干燥的空气)为特点。因连续较小的土壤孔隙所引起的土壤中空气所占空间和保水力的增加,使表面张力增加,进而引起渐增的负压(Ψp)的发展。与田间持水量水平的土壤中Ψp ≈ -0.001至-0.003 MPa相比,干燥土壤中的Ψp可能下降到-3 MPa。在小于0.2 mm孔隙中的水不能被根吸收(从这些孔隙中吸水需要~1.5 MPa的吸力来克服这些孔隙中土壤的ΨM),因此是植物可利用水分的下限(被称作永久性萎蔫点)(Watt et al., 2006)。地中海式气候区的生长季通常以土壤湿度低和因温暖而干燥空气所造成的蒸汽压亏缺高为特点。葡萄树体和其细胞的水分平衡是由蒸发到大气中散失的水分量(蒸腾作用)和从土壤中所吸收的水分量决定。葡萄树体可能受到水分胁迫是土壤水势(Ψ土壤)下降和蒸腾速率(E)波动共同作用的结果,前者通常随时间的延长逐渐增强,而后者随大气蒸汽压亏缺的日间和季节性变化(因辐射和湿度)而发生(Williams et al., 1994)。植物(叶片)水势(Ψ叶片)和这些变量之间的关系可以表示为下面的公式:
Ψ叶片 = Ψ土壤 - rh
其中rh为葡萄树体内水分流动受到的总的阻力。
当蒸腾作用超过葡萄树体根系所吸收的水分,细胞膨压(P)、相对水含量(RWC,组织水分相对于同一组织完全膨胀时含水量的百分比)和细胞体积下降,而细胞内溶质的浓度增加,降低了细胞的渗透势(Ψπ)和Ψ。因此,细胞对水分亏缺的响应包含对渗透胁迫的响应。轻度的植物水分胁迫被定义为Ψ叶片下降几个巴(bar),或相对含水量比在适度蒸发需求条件下灌溉良好植物体相应值低8%~10%(Hsiao, 1973);中度水分胁迫相当于Ψ叶片下降超过几个巴,但小于1.2~1.5 MPa或相对含水量下降10%~20%;重度水分胁迫相当于Ψ叶片下降超过1.5 MPa或相对含水量下降超过20%。最初,细胞膨压和相对含水量的下降削弱新梢生长和气孔对水蒸气的导度(Hsiao, 1973)。随着Ψ的降低,葡萄新梢的延长和叶片的扩大看起来直线下降,并且在Ψ为-1.0至-1.2 MPa时完全停止,虽然叶片的扩大相对不依赖细胞膨压(Schultz and Matthews, 1988b; Shackel et al., 1987)。
气孔的主要功能是避免能导致木质部空穴的损害性水分缺乏(Brodribb and Holbrook, 2003; Jones, 1998)。葡萄植株似乎非常容易受到空穴作用的损害,通常被认为是近等水型(near-isohydric)种,其敏感的气孔会迅速增加rs并降低蒸腾作用来响应低的Ψ土壤,这就使得葡萄无论Ψ土壤怎样都能在日间保持几乎恒定的Ψ叶片(Düring, 1987; Galmés et al., 2007),这能超过高光强对气孔开放的影响,因此葡萄园中的土壤水分缺乏通常导致正午rs的增加(Correia et al., 1990, 1995; Loveys and Düring, 1984)。尽管如此,也有Ψ叶片日变化显著的报道:在干燥的土壤中,黎明前和正午的Ψ叶片之间的差异有时可能超过1 MPa(Williams and Matthews, 1990)。由于葡萄种和品种对空穴作用易损性方面的表现不同,它们在其气孔对干旱的敏感性方面也不相同(Currle et al., 1983; Escalona et al., 1999; Liu et al., 1978; Schultz, 2003; Soar et al., 2006b; Winkel and Rambal, 1993)。所谓的等水型(isohydric)种或品种具有比非等水型(anisohydric)种或品种更敏感的气孔,后者保持较低的rs和较高的蒸腾速率,并且在白天显著降低Ψ叶片以响应土壤水分缺乏或大气湿度胁迫(高的水汽压亏缺)。品种间的这些差异也反映在径向液压阻力(rh)和根中水孔蛋白的活动上,通过控制它们两者来调节蒸腾速率的水分流量(Vandeleur et al., 2009)。但需要注意的是,这种差别主要体现在程度上,远非专业术语所说的那样界限分明。因为Ψ叶片从不会保持绝对恒定,因此将葡萄“划分”为近等水型或假等水型和近非等水型(near-anisohydric)或假非等水型种和品种可能更恰当。前者包括冬葡萄(V. berlandieri)、沙地葡萄和欧亚种葡萄(V. vinifera)品种 ‘赤霞珠’、‘歌海娜’、‘丹魄’和‘佳丽酿’,而后者包括‘西拉’、‘桑娇维赛’、‘霞多丽’、‘赛美容’、‘无核白’和‘康可’。目前仅研究了很少的几个种和品种,随着可用信息的不断增多,划分的界限可能会变得更加模糊。
等水型种可能是在潮湿的栖息地进化而来,对木质部空穴更为敏感,可被认为是以“悲观主义者”的方式调整其行为来节约资源。尽管这一保守策略是通过叶片的蒸发水平远低于木质部供应能力将遇到的挑战水平之下来保证水分需求(Sperry, 2004),但这是以降低光合作用为代价达到的,因而在CO2吸收方面可能有损失。另一方面,非等水型植物多起源于更加干旱的地区,对木质部空穴敏感性弱,可以被认为是以“乐观主义者”的方式在期待获取更多资源的同时使用现有可利用的资源。由于液压故障的安全界限狭窄,当木质部空穴变得不可逆转时,非等水型的方法更加冒险,当干旱过于严重时,这些葡萄植株可能要付出落叶的代价。然而,这可能使植株能更有效地根据需要匹配水分供给,从而通过使木质部达到其承载能力来使CO2的吸收最大化,至少,只要能保持其叶面积(Sack and Holbrook, 2006; Sperry, 2004)。确实,在水分亏缺条件下,‘西拉’能保持其旺盛的新梢生长,而这会完全抑制‘赤霞珠’的新梢生长。此外,如果任其自由生长,而不是利用架式和架线进行约束,‘西拉’新梢下垂生长的习性也不同于‘赤霞珠’或‘歌海娜’,它们的新梢更多的是直立生长。非等水型植物比等水型植物往往具有较大的根/新梢比,这可能是一种避免干旱的策略。除了欧亚种葡萄品种,来源于美洲种葡萄的砧木在其对干旱的敏感性和响应方面也存在不同,通过木质部中ABA的产生和输出,可能改变接穗品种叶片的Ψ叶片,rs和光合作用(Bauerle et al., 2008b; Soar et al., 2006a)。
除了对Ψ造成的显著后果,植物细胞脱水也会促进薄壁细胞中由类胡萝卜素类的玉米黄素合成ABA,特别是在根、新梢和叶片的维管系统的形成层附近(Endo et al., 2008; Nambara and Marion-Poll, 2005)。ABA的主要功能是调节植物体的水风平衡和对渗透胁迫的耐受性。ABA在水分平衡中的作用主要通过调节气孔导度,而在渗透胁迫耐受性中的作用则是通过在大部分细胞中产生耐脱水蛋白。ABA的另一个功能是作为生长素的拮抗剂,后者诱导细胞壁的松弛,而细胞壁松弛是生长过程中细胞膨大所必需的,ABA可能阻止生长素发挥其对细胞壁松弛的影响。ABA也直接干扰细胞周期机制,从而抑制细胞分裂。除了变干中的叶片产生的ABA,木质部液中来源于根的ABA量随着土壤水分有效性的降低能够大幅度增加(Loveys, 1984)。与ABA相反,为响应土壤干燥,根中细胞分裂素的产生和其在木质部液中的运输减少(Davies et al., 2002; Yang et al., 2002)。ABA和细胞分裂素都可以作为胁迫信号,将根区的条件通过木质部向新梢、叶片和果穗传递。为响应水分胁迫,根中ABA的产生受到快速刺激,而细胞分裂素的产生逐步下降。然而,当突然发生水分胁迫时,根部ABA信号的产生和传送可能太慢,不能使气孔适时关闭,以避免叶片脱水。在这种情况下,ABA直接在新梢和叶片中合成,以响应来自根的水压信号(Christmann et al., 2007; Soar et al., 2004)。根中木质部压力的改变几乎即刻就被传送到新梢,在此改变叶片细胞的膨压。膨压的下降可能足以引发ABA在叶片中的合成。因此,细胞膨压是水分胁迫的关键信号。
虽然ABA可能参与抑制受到水分胁迫植株的新梢生长,但其在根中似乎具有相反的功能。此外,为了响应土壤干旱,木质部和其它质外体(细胞外的)汁液的pH通常上升(Hartung and Slovik, 1991; Wilkinson and Davies, 2002)。良好灌溉植株木质部液的pH大约为6.0,而水分胁迫植株木质部液的pH大约为7.0。木质部液pH的这个上升单独就能构成一个通向叶片的源于根的信号,诱导气孔的关闭和降低细胞膨大(生长)速率。根中合成的ABA能够被浸出到土壤溶液中,特别是在碱性土壤中(Wilkinson and Davies, 2002)。因此,高的土壤pH能够减弱源于根的ABA信号。
根必须吸收多于蒸腾作用散失的水分,以使植株能够生长,这是因为生长主要归因于因水分输入而引起的细胞膨大。细胞吸收水分是由细胞内部溶质(例如蔗糖)的积累驱动,因而依赖细胞内外之间渗透性所产生的ΔΨ。因为水分胁迫降低Ψ木质部,水分亏缺下生长抑制的主要原因可能只是ΔΨ较小,从而降低细胞的水分吸收,并因此阻碍必需的膨压的产生(Hsiao and Xu, 2000)。此外,细胞膨大涉及到细胞壁的松弛,细胞壁的松弛需要酸化作用,而酸化是通过从细胞内部向细胞壁泵送质子(H+)实现的,同时交换K+以保持细胞的电荷平衡(Stiles and Van Volkenburgh, 2004)。因水分亏缺引起的质外体pH升高也可能直接干扰细胞的膨大(Bacon et al., 1998)。因此,生长速率随Ψ木质部和pH木质部的波动而快速变化,且新梢生长和叶片显现的减少是水分亏缺首先可见的标志;新梢生长比光合作用对水分胁迫更敏感(Hsiao and Xu, 2000; Stevens et al., 1995; Williams et al., 1994)。此外,卷须也是葡萄树体水分状况的敏感指示器:在无胁迫旺盛生长的新梢上,最前端的卷须伸展到超过梢尖。随着水分胁迫的来临,生长开始变慢,新的卷须保持较小,因而梢尖超过了卷须。在更严重的胁迫下,生长停止且最幼嫩叶片的扩展超过梢尖。在木质化之前,卷须对水分胁迫高度敏感,并且开始萎蔫比叶片要早。
有目地的应用水分胁迫是优质酿酒葡萄生产的一项重要管理策略。坐果到转色期之间这段时间,通过水分亏缺能够最有效地控制新梢生长和浆果大小。其本质就是调亏灌溉(RDI)的使用,也就是在坐果后尽早进行短时间的水分亏缺(Dry et al., 2001; Keller, 2005; Kriedemann and Goodwin, 2003)。总之,调亏灌溉就是使用的水量少于蒸发蒸腾的需要。在调亏灌溉期间,使土壤剖面逐渐干燥,直至新梢生长得到控制。显然,这只有在季节性降雨足够低或蒸发需求高的地区,和储水能力有限的土壤上才有可能。除了限制浆果大小,调亏灌溉也有改善果实曝光的倾向。一旦新梢生长停止,特别是在转色期后,胁迫后的植株仅仅是阻止新的新梢生长。在生长季结束时,根区再进行灌溉直至田间最持水量,以避免冬季根的冻害。
根区条件通常是不均匀的,土壤湿度在这方面也不例外。当根同时经历湿润和干燥的土壤时,新梢生长的反应取决于土壤湿度的差异是否能被相同或不同的根感觉到。当表层土壤干燥而下层土壤仍然湿润时,只要根可以利用下层土壤水分,新梢的生长就不减弱(Phillips and Riha, 1994)。然而,当同一株葡萄分开的根分别经受土壤干燥和土壤湿润时,新梢的生长被抑制(Dry and Loveys, 1999; Dry et al., 2001; Lovisolo et al., 2002a)。这就能以另一种灌溉策略加以利用,也就是所谓的部分根区干燥(PRD),在这项策略中,轮流仅向树体的一侧供水,而使另一侧干旱(Dry and Loveys, 1998)。这个策略试图将对水分胁迫的生理响应(例如,ABA的产生和rs的增加)从水分胁迫的物理效应(例如,较低的Ψ叶片)中分离出来(Davies et al., 2002; Dry et al., 2001; Kriedemann and Goodwin, 2003)。由正在变干的根产生的ABA诱导部分气孔关闭并减少新梢的生长,而充分吸水的根保持有利的植株水分状况(也就是Ψ叶片没有降低)。在PRD过程中,通过湿润的根输送到新梢的水分可能增加(Kang et al., 2003),而湿润的根也通过向干燥的根供应水分来维持干燥根的生存(Stoll et al., 2000)。然而最终,从干燥的根流出的水流变得越来越慢,以至于从这些根运出ABA终止,气孔重新打开(Dodd et al., 2008; Dry et al., 2000a)。为了阻止树体产生这样的适应,每周或每两周在根系两侧之间轮流灌溉。除了ABA产生的增加,干燥中的根也产生少量的细胞分裂素,从而抑制副梢的生长(Stoll et al., 2000)。经受PRD的葡萄植株,其叶幕大小的大部分减小可能是由于副梢生长的抑制(dos Santos et al., 2003; Dry et al., 2001)。如果在PRD下Ψ叶片保持稳定,则浆果大小和产量也保持稳定,而较低的叶幕密度通常使果实成分得到改善。RDI和PRD之间的根本区别在于RDI是在时间上施加土壤水分亏缺,而PRD则是在空间上施加水分亏缺(Keller, 2005)。如果生长季的降雨足够低,RDI总是造成植株水分亏缺,而如果管理适当的话,PRD通常不会造成植株水分亏缺(de Souza et al., 2003; Dry et al., 2001; Kriedemann and Goodwin, 2003)。如果切换间隔过长,PRD可能失去作用,这是因为湿润的土壤体积对给定大小的植株来说太小,在植株可以利用相对高的地下水位的地方或者在结构性较差的粘土中,两部分分离的根系不能形成(例如,沟灌或喷灌的葡萄园改为PRD后)。对PRD的附加响应看来是葡萄将根的生长转向更深的土层中(Dry et al., 2000b, 2001),而在标准滴灌下,根经常聚集在表层土壤中。尽管这种适应行为使葡萄植株更抗旱,但在根区较深和根容易利用地下水的土壤上,它与PRD的使用原则冲突。
水分胁迫下,葡萄根的生长下降,但小于新梢生长的下降,因为与新梢相比,根可以在较低的Ψ下生长,一定程度上是因为是较高活性的膨胀素蛋白可能增加根尖细胞壁的可延展性(Erlenwein, 1965a; Sharp et al., 2004; Wu and Cosgrove, 2000)。此外,水分胁迫对根直径的影响比对其长度的影响更显著:受胁迫的根变得更细(Mapfumo et al., 1994a)。这些适应增加了根/新梢之比,并保持向新梢供应水分和养分(Hsiao and Xu, 2000)。通过诱导中柱中离子通道的堵塞,ABA降低了K+(可能也有其它养分离子,例如H2PO4–)从根的皮层向木质部导管的释放(De Boer and Volkov, 2003; Roberts and Snowman, 2000)。这就阻碍了K+从土壤中的吸收(ABA不影响K+的吸收)和从新梢韧皮部中的释放出来,并导致根中K+的积累。K+的渗透活性使Ψ根降低,可能增加韧皮部的水分输入。这有助于葡萄植株保持根的生长,同时避免了K+向叶片的运输,K+在叶片中通过降低Ψ叶片,将进一步加重水分亏缺。然而,在较高的浓度下(也就是更严重的胁迫),ABA抑制根的生长。此外,根特别是正在生长的根尖,通过积累糖分和氨基酸也在进行渗透调节,目的是降低Ψ根来促进水分吸收、不断生长,并可能降低木质部空穴的风险(Düring and Dry, 1995; Schultz and Matthews, 1988a)。然而,在更加严重的水分胁迫下,导管栓塞在受影响的木质部导管中完全阻断水分流动。实际上,栓塞可能在葡萄上很常见,在中度水分亏缺时对抑制新梢的生长可能非常重要(Lovisolo and Schubert, 1998; Lovisolo et al., 2008; Schultz and Matthews, 1988a)。当然,土壤干旱也降低养分向根的运输速率,所以总体的养分有效性降低,特别是当水分亏缺显著减缓根的生长时(Hsiao, 1973)。因此,土壤湿度的下降使养分吸收越来越困难,叶幕发育,特别是果实成熟所需要的很大一部分养分需要由树体木质部分中的储备来供给。土壤湿度的下降也与根呼吸作用的降低有关,土壤水分体积分数低于约5%,导致膜完整性的伴随丧失,结果根在严重干旱的条件下开始枯死(Huang et al., 2005b)。
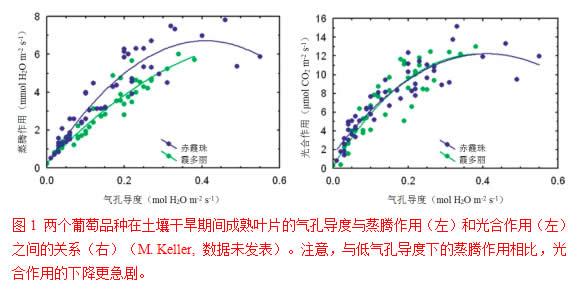
之前所讨论的气孔关闭(高rs)通过蒸腾作用来减少水分损失,但也抑制光合作用(图1),这是因为CO2扩散进入葡萄叶片比水蒸气从叶片中扩散出来更加依赖打开的气孔(Boyer et al., 1997; Escalona et al., 1999; Flexas et al., 1998, 2002),这就是所谓的光合作用的气孔调节或气孔限制,且伴随着ATP和NADPH消耗的减少,这是因为CO2固定所需的能量较少。不必惊讶,短期的高蒸汽压亏缺对光合作用和同化物输出的影响类似于较长时间的土壤水分亏缺的影响(Shirke and Pathre, 2004)。然而,即使是轻微的、不足以降低光合作用的胁迫,也能降低新梢的生长(即细胞膨大),因而减缓叶幕发育,因为生长的减缓通常发生在气孔开始关闭之前(Hsiao, 1973)。总叶面积较小和光合作用下降二者相结合,将导致葡萄叶幕每日同化物生产的减少(Perez Peña and Tarara, 2004)。因为叶幕的净同化速率决定从叶幕中输出的速率,而叶幕光合作用的降低将减少可用于输出的光合产物的量。尽管如此,只要水分亏缺轻微,足够抑制新梢生长而不是光合作用,可能就有相对多的糖分用于其它库(Lawlor and Cornic, 2002),可能有益于果实的成熟。
虽然叶片糖浓度能在一段时间内保持高水平,淀粉逐渐耗尽,但同化物的输出随着水分胁迫严重程度的增加而逐渐下降(Düring, 1984; Quick et al., 1992)。此外,当面对水分胁迫时,正在展开的叶片和正在生长的根尖通常会积累溶质,特别是无机离子,如K+和Ca2+,但也积累糖分,如葡萄糖和果糖,以及在较小程度上积累氨基酸,如脯氨酸,和有机酸,如苹果酸(Cramer et al., 2007; Patakas et al., 2002; Sharp et al., 2004)。这个渗透调节或渗透调控保持了膨压和持续生长,即使生长较慢(Düring, 1984; Morgan, 1984)。当膨大完成(例如,在完全长成的叶片中),组织逐渐失去这个渗透调节能力(Patakas et al., 1997),但在生长季后期发育的叶片比早期形成的叶片可能具有更强的渗透调节能力。
在严重胁迫下,也就是当Ψ叶片降至大约-1.5 MPa以下(取决于品种),RWC(相对含水量)下降至约75%,气孔导度(gs)下降至充分灌溉树体气孔导度的20%(~50 mmol H2O m-2s-1)以下(Flexas et al., 2002),生长显著减慢或停止。此外,光合代谢逐渐受到损害,最初是因为电子传递和ATP合成的减少,从而抑制卡尔文循环;而当相对含水量非常低时,则是因为光捕获和光合系统(特别是光系统II(PSII))功能的减弱(Escalona et al., 1999; Hsiao, 1973; Tezara et al., 1999)。虽然在严重干旱胁迫下叶片中的核酮糖-1,5-二磷酸羧化酶蛋白的量也下降(Bota et al., 2004),但这可能是光合作用下降的一个结果,而不是光合作用下降的原因。光合作用的这个抑制被称作代谢调节或代谢限制,与气孔限制不同,它是不可逆的(Escalona et al., 1999; Lawlor and Cornic, 2002)。光合作用的下降伴随着呼吸作用的轻微降低,也许,光呼吸所占的比例相对于光合作用的增加,可能是通过“消费”过剩的电子来对抗能量过载(Cramer et al., 2007; Düring, 1988; Lawlor and Cornic, 2002; Lawlor and Tezara, 2009)。因此,随着水分胁迫的加剧,从叶片中失去的固定CO2所占比例也增加。水分胁迫越严重,从储存的碳水化合物中输出的固定CO2就越多(Lawlor and Cornic, 2002)。随着储存的碳水化合物被消耗,氨基酸开始积累,特别是脯氨酸和谷氨酸,这是因为其产生(供给)超过了消耗(需要)。这反过来导致硝酸盐在叶片中的积累,可能是由于硝酸还原酶的反馈抑制(Patakas et al., 2002)。用于合成氨基酸的碳骨架在水分胁迫的叶片中是通过糖酵解和来自于三羧酸循环的有机酸提供的,而不是直接来自于叶绿体的同化物(与非胁迫条件下相同),因此有机酸减少(Lawlor and Cornic, 2002)。
当叶片因严重水分胁迫失去膨压,将会萎蔫,叶片表面积降低,叶片下垂并变得与太阳光线平行(Lawlor and Cornic, 2002; Smart, 1974)。因为水分胁迫降低光合作用,所以需要的电子更少,萎蔫是减少光吸收(即叶片捕获的光子数量)的一个有效机制,能实质减少潜在的“能量过载”,而后者将损害光合系统(Flexas et al., 1999b; Lawlor and Cornic, 2002)。然而,在高光强并伴有大量光子流(与叶绿体中的相对能量过剩有关)的条件下,水分胁迫可能特别具有破坏性(Lawlor and Tezara, 2009)。此外,因为角质层允许少量的水蒸汽通过扩散作用通过,所以不管气孔关闭得有多紧,叶片都不能完全避免水分的散失(Boyer et al., 1997)。角质层的蒸腾作用随温度的升高呈指数方式增加,这是因为为水分散失提供驱动力的透水性和蒸汽压亏缺都随温度的升高而增加(Riederer and Schreiber, 2001)。当干燥的风降低rb并促进蒸腾失水时,这个问题特别严重。虽然幼叶可能曝光更多,因此比老叶经历更高的蒸发需求,但老叶比幼叶在更高的Ψ叶片下萎蔫,这是因为后者能更好的进行渗透调节(Patakas et al., 1997)。正在萎蔫的老叶产生大量的ABA,ABA被运输至幼叶以减少水分散失。
ABA通过活性氧产生的增加,也能导致氧化胁迫,当活性氧产生过多时,会因为氧化失控而造成损伤并最终杀死植物细胞。这就刺激树体的抗氧化防御系统来防止氧化损伤(Cramer et al., 2007),使叶片的抗氧化剂浓度的升高,例如类胡萝卜素(特别是叶黄素)、谷胱甘肽、抗坏血酸盐(维生素C)和α-生育酚(维生素E)。如果水分胁迫没有被降雨或灌溉缓解,ABA含量的增加和细胞分裂素含量的降低加速叶片老化并导致老叶的衰老(Yang et al., 2002)。当叶片细胞分裂素降至阈值以下时,衰老被启动,衰老包括叶绿体及其光合装置的分解,并伴随着叶绿素含量的下降和这些叶片中的碳、蛋白质(例如,核酮糖-1,5-二磷酸羧化酶的分解)和养分的再活化。衰老以叶片的脱落而告终,叶片脱落也能被过多的木质部空穴所诱发,而芽中的分生组织仍保持有活力。干旱诱发的落叶表现也促进芽休眠的提早开始,使葡萄植株通过大幅度降低蒸腾作用和保存资源度过极度干旱而能够存活。衰老一旦开始,其速度随温度的升高而加快,所以干旱胁迫后的热浪能导致葡萄严重落叶。在水分胁迫或衰老过程中,韧皮部中的细胞质谷氨酰胺合成酶(GS1)可能参与到用于氮输出的谷氨酰胺的合成,和用于存储的脯氨酸的合成。一些糖分、氨基酸和通过韧皮部运输的矿质养分,能被循环利用到果实中,可能在一定程度上供养果实的成熟。然而,因为养分是通过糖驱动的韧皮部中集流被“扫”入果实,这样的养分循环利用可能导致果实中K+含量的不力增加,随后可能提高果汁和葡萄酒的pH。如果严重的水分胁迫发生在果穗的库强处于其最高水平期间(也就是转色期和转色刚刚结束),这个影响可能最显著。甚至在导致叶片全部脱落的干旱条件下,也很少见到葡萄植株多年生部分的顶部枯死。给落叶的植株恢复供水,通常引起芽的萌发和再生长,这可能是在根压再生的辅助下。然而,开始于新梢和根最幼嫩(和最小)部分的部分或全部顶部枯死,会因为木质部长时间的完全空穴(也就是液压故障)而可能发生。
通常认为,因水分胁迫造成的营养生长减弱比果实生长的减弱更严重(Williams, 1996; Williams et al., 1994)。与养分亏缺类似,水分亏缺通常使产量的降低,特别是亏缺发生在生长季的早期(Williams and Matthews, 1990)。生殖生长以及果实生产和产量形成(对水分胁迫)的敏感性取决于葡萄植株的发育阶段。萌芽后不久,发育中的花序开始与正在生长的新梢竞争有限的水分和同化物,并占上风(Hale and Weaver, 1962)。一旦花序通过其自身的气体交换产生同化物(Leyhe and Blanke, 1989),花序就可能存活,甚至在足以抑制新梢生长的相对严重的干旱条件下也能存活。然而,接近开花或者在开花过程中,花的代谢需求远远超过其自身的合成,因为毕竟绝大部分气孔位于花帽中,而花帽在开花期脱落(Blanke, 1990b; Blanke and Leyhe, 1988, 1989a; Vivin et al., 2003),但直至座果前,花序仍然是较弱的库。虽然通常认为雌性的花器官对水分胁迫相对不敏感(尽管在同一个果穗中较小的子房比较大的子房更易受到胁迫的影响),但在花药中,减数分裂期间(发生在开花前1~12周)的水分亏缺可能引起花粉不育(Dorion et al., 1996; Saini, 1997)。在雄性器官的减数分裂过程中,甚至是短暂的中度水分胁迫都能阻碍花粉的发育,这是因为水分胁迫可能抑制糖分向花粉的运输以及淀粉在花粉中的积累(Dorion et al., 1996; Saini, 1997),然而,这在葡萄上还未进行研究。花粉的发育和萌发以及花粉管的生长都需要淀粉作为呼吸作用的燃料,所以,如果花粉最终能够萌发,但其较低的“燃料”水平限制了花粉管及时到达子房进行受精。授粉和受精的减少导致座果较少,或者在更严重的情况下导致花序脱落(Callis, 1995; Smart and Coombe, 1983)。换句话说,从减数分裂到坐果,生殖发育对水分胁迫最敏感。除了经由韧皮部的光合产物的供给,水分亏缺的影响可能是通过低的Ψ花序和木质部液的pH、ABA和细胞分裂素的变化结合在一起介导的。例如,为了保持膨压以维持光合活动和同化物的输出,虽然ABA刺激叶片中的液泡的转化酶,但抑制花和幼果中的转化酶,使其随后败育(Roitsch and González, 2004)。ABA和细胞分裂素的参与和PRD下的观测一致,也就是保持较高的Ψ叶片,可能与与座果较少有关(Rogiers et al., 2004b)。此外,当栓塞有可能在花序的木质部中发展时,其修复可能并不像在叶片中那样容易。需要注意的是,还不清楚花前有目的的水分胁迫是否能用于育种程序中雌性育种亲本的败育。
除了降低浆果数量,花期的水分胁迫对植株在下一个生长季的产量潜力可能也有影响。水分亏缺通常减少花序的发生,而花序发生的减少能使芽的结实力降低,从而导致每个新梢的果穗数量较少(Alleweldt and Hofäcker, 1975; Buttrose, 1974b)。相比之下,如果水分亏缺轻微,仅够降低叶幕密度,实际上可能促进花序的发生,这是因为改善了叶幕微气候(Smart and Coombe, 1983; Williams and Matthews, 1990; Williams et al., 1994)。
一旦完成坐果,树体就将很大的投入用于种子发育,受到水分胁迫的植株通常是以牺牲新梢和根的生长以及根中储藏贮备物的补充为代价,保持果实的发育(Eibach and Alleweldt, 1985; Mullins et al., 1992; Williams et al., 1994)。当然,这可能具有长期的影响,因为葡萄树体严重依赖储藏的贮备物用于第二年春天的萌芽。此外,当有效水分不足时,弱的根系可能使树体更易遭受干旱胁迫。小的根系给大的叶幕供应水分将导致非常大的水势梯度(ΔΨ = Ψ土壤 - Ψ叶片),从而使葡萄植株很容易受到木质部空穴的危害,结果就是叶幕干枯(Sperry et al., 2002)。为了平衡蒸腾作用的失水和根系吸收的水分供应,这些植株或者降低Ψ叶片(例如,通过渗透调节),或者关闭其气孔,特别是正午前后蒸发需求处于最高水平时。
在干旱条件下,通过施肥进行的适度氮(N)供给可能在短期内保持土壤水分。然而,由于增施肥料(特别是N)引起的根/新梢比的下降可能进一步增强树体对干旱的敏感性,特别是在灌溉葡萄园中,应该的灌溉被取消(Erlenwein, 1965a; Sperry et al., 2002)。伴随着充足N供给引起的木质部汁液中硝酸盐浓度的升高,可能与木质部汁液pH的下降有关,而pH的降低反而降低气孔对ABA的敏感性(Jia and Davies, 2007; Wilkinson and Davies, 2002)。这就说明,与N水平相对较低的土壤相比,当N水平高的土壤干旱时,气孔关闭的较迟且更慢。然而,在未灌溉的植物体中,施肥被认为能改善渗透势调节能力和对木质部空穴的抗性,有抵消根/新梢之比较低的倾向(Bucci et al., 2006; Sperry et al., 2002),尽管过多的N供给能减少水分吸收,因为N也是土壤水中溶质的组成之一,这与7.3中讨论的盐分的影响相似(Keller and Koblet, 1994)。
与新梢生长相比,尽管果实的生长对水分胁迫可能相对较不敏感,但在浆果细胞分裂和细胞膨大过程中,有限的水分供应也会限制浆果膨大,从而限制浆果大小(Roby and Matthews, 2004; Williams and Matthews, 1990)。与影响新梢的生长一致,Ψ木质部和pH木质部的降低可能也是水分胁迫下植株浆果大小较小的部分原因,特别是发生在转色期之前的水分胁迫。因水分胁迫造成的产量降低,可能在这一阶段仍然非常大,而在转色期之后,浆果对水分亏缺似乎变得越来越不敏感。因此,同等程度的水分亏缺,如果发生在花后浆果生长的细胞分裂阶段,则浆果大小的减小程度要大于这个阶段之后的水分亏缺(Currle et al., 1983; Hardie and Considine, 1976; Hofäcker et al., 1976; Matthews and Anderson, 1989; McCarthy, 1997; Williams and Matthews, 1990)。在生长季后增加灌水,并不能补偿因生长季早期水分亏缺造成的浆果大小降低,可能是因为转色后韧皮部液流的增加和进入浆果的木质部液流的大幅减少或停止,显著降低了浆果水分状况对土壤和植株水分状况的敏感性(Creasy and Lombard, 1993; Düring et al., 1987; Findlay et al., 1987; Greenspan et al., 1994, 1996; Ollat et al., 2002; Rogiers et al., 2001)。然而,因为转色期木质部液流的逆转,转色期之后的水分亏缺,特别是长时间的亏缺,能导致果粒因脱水而皱缩,此时木质部的流出加上浆果的蒸腾作用超过韧皮部的流入(Keller et al., 2006)。因此,采收前的缩水程度与树体的水分状况呈负相关。
浆果生长对水分亏缺的响应也取决于负载量。负载量大的植株(也就是每株树结果很多)比负载量小的植株,浆果大小的减少可能更多,这是因为每粒浆果输入的糖分较少也抑制这些浆果对水分的吸收(Fishman and Génard, 1998; Santesteban and Royo, 2006)。如果胁迫发生的早,足以减少坐果,则保留下来的浆果的大小可能增加,并部分补偿产量潜力的损失,这将抵消较小的浆果对葡萄酒质量的预期增益。然而,对生长季开始时负载量就较小的植株而言,水分胁迫可能阻碍补偿性的浆果生长;而对负载量很大的植株而言,水分胁迫似乎没有附加影响,因为这种植株上的浆果大小已经受到抑制(Keller et al., 2008)。当超过50%的植物有效水从土壤中被吸收后,尽管植物体的水分胁迫症状变得明显,但在有效水分的80%被葡萄植株蒸发之前,葡萄浆果(转色前和转色后)不会皱缩(Keller et al., 2006)。
译自《The Science of Grapevines》