微生物岗
刘延琳
高级醇(Higher alcohols)又称杂醇油,一般指具有两个以上碳原子的一元醇(Waterhouse et al.2016),在葡萄酒中主要包含7碳以下的正丙醇、异丁醇、异戊醇、正丁醇、正戊醇、正庚醇、正辛醇等以及8碳的异辛醇和苯乙醇,是酵母碳代谢和氨基酸代谢途径中衍生出的重要副产物(Piresetal. 2014),广泛存在于各种发酵类酒精饮品中(例如啤酒、白酒、黄酒、葡萄酒等)。适量的高级醇不仅能丰满酒体使口感醇厚(罗杰等 2015),还对酒香气的复杂性有积极的贡献(Rapp and Versini 1995),与酯类、挥发性硫化物共同成为3类影响葡萄酒风格品质的关键香气化合物。但高级醇含量过高一方面会打破风味平衡,给人以辛辣、苦涩等不愉悦的体验,另一方面则会引发头痛、恶心等“上头”现象(格绒泽仁等 2019; Grzegorz K et al.2015),且毒性和麻醉作用似乎随着碳链长度的增加而增加(Lachenmeier et al.2008)。因此,在酿造过程中对高级醇的生成进行适当控制已引起普遍关注。
目前,人们对于高级醇的形成路径及工艺条件对感官品质的影响已有广泛研究,过去三年中,国内大部分研究偏重于实践生产,其中对于温度调控(靳国杰等 2017;肖东光等 2019)、氮源偏好(黄桂东等 2018;刘沛通等 2018)等影响因素作用机制较为关注;国外则主要集中在酵母菌种特性探索(Justyna et al.2019;Giorello F et al.2018;Mendes I et al.2017)及基因组学方面的调控研究(Cordente A et al.2018;Eder Met al.2018;Johannes W et al.2019),而在酵母发酵过程中针对碳代谢这一重要通路的研究则主要集中在碳源利用和转运(Nisbet M et al. 2014;Xie Kelin et al. 2016;缪晡等 2019)及高糖胁迫耐受机制上(Zhuang S et al.2019;桂芹等 2019;毕新煜等 2017),关于高糖条件下如何调控酵母产高级醇等相关报道则较少。此外,伴随全球气候变暖所导致的酿酒葡萄原料中含糖量过高(Aurand et al.2014)等问题也引起行业内的普遍关注,尤其是在我国新疆产区原料高糖酸低的情况尤为突出(马文瑞等 2017),高糖不仅会抑制酵母菌的生长增加发酵停滞的风险,也会使酒中高级醇的含量上升(Mateo J et al.1998;张烨等 2017)。因此,了解酿酒酵母在高糖条件下高级醇的调控机制具有重要意义。
1.1 葡萄酒中的高级醇
1.1.1 高级醇对葡萄酒风味的影响
酒精发酵伴随着脂肪族高级醇(如丙醇、异丁醇、异戊醇等)和芳香醇(苯乙醇等)的形成(Nykänen et al.1977),除了具有“玫瑰”“蜂蜜”特征的苯乙醇能够给酒贡献宜人的气味外,其他单一醇类往往仅有轻微的气味(表1-1)。人们普遍认为,过量的高级醇会给酒的品质造成消极影响。
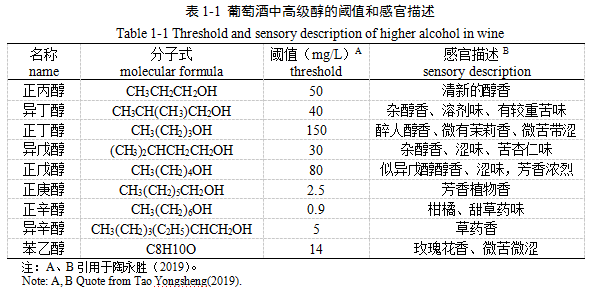
作为呈味物质方面,已有大量研究表明支持这一结论,Lambrechts 等人(2000)认为尽管高浓度杂醇赋予异味,但是低浓度的这些化合物和它们的酯对酒的风味和香味起着关键作用,低于300 mg/L的高级醇对于增加葡萄酒香气的复杂性有益,而更高浓度(400 mg/L)可能会掩盖酯类等水果香气,并具有强烈的刺激性气味,给酒带来粗糙、苦涩的口感(Rapp and Versini .1995;Swiegers et al. 2005)。
作为呈香物质方面,已有的研究尚未定论,Aznar等人(2003)采用通过PLS模型在陈年红酒中发现,异戊醇和异丁醇的浓度与植物/胡椒味呈正相关,与烘烤和木质味呈负相关。San-Juan等人(2011)采用相同策略观察到,高级醇似乎仅与较年轻和便宜的葡萄酒呈负相关,降低酒中鲜美的水果味(Cameleyre et al.2015),而对优质葡萄酒却没有影响。近年来,有研究则认为越是在较好的芳香环境中,高级醇对香气的抑制作用效果更明显,在较差的芳香环境中,葡萄酒香气基础通常具有缓冲作用,醇的影响可以忽略不计。De-La-Fuente-Blanco等人(2016)证实高级醇的感官效果强烈依赖于香气环境,且异丁醇、异戊醇对感官影响十分重要,会明显抑制草莓/红色浆果等水果味,椰子/木材/香草等木质香,但不会抑制皮革/动物/油墨的气味,因此高级醇对葡萄酒的香气质量具有负面作用。
1.1.2影响高级醇产生的因素
高级醇的产生与发酵基质中可同化氮的含量(Liu P et al.2017;王亚钦等,2017;姜越等,2018)和种类(Gobert A et al.2017;Hernandez-orte et al.2010)、糖含量和补加方式(GonzálezB et al.2018)、发酵温度(靳国杰等,2017)、初始pH值(Pablo et al. 2000)、溶氧量(Vidal E et al.2015)和贮存时间(齐晓茹等,2018)等多种发酵环境和工艺条件有关(Ruiz J et al.2019;祝霞等,2019;孙时光等,2019)。此外,不同酵母菌种的高级醇产量差异也较大(宋刚 2006)。Katarína FurdíKová等人(2017)研究了斯洛伐克本土酿酒酵母对琼瑶浆葡萄(初始糖为250g/L)所产生的香气化合物的影响,其中2株酵母菌与异戊醇和苯乙醇、正己醇的产生密切相关,1株酵母则与正庚醇更相关。也有研究认为选择适宜的酿酒酵母就可以明显降低高级醇的生成量(Staver M et al.2005)。近年来在发酵体系中引入非酿酒酵母进行混酿也逐渐成为热点研究,据报道,相比酿酒酵母,大多数非酿酒酵母会降低高级醇的浓度,而Heard(1999)观察到混菌发酵会增加高级醇的浓度,其中美极梅奇酵母会显著高产苯乙醇(Clemente-Jimenez et al. 2004)。因此,通过选育优良的酿酒酵母可以有效控制葡萄酒中高级醇的含量。
1.1.3 高级醇的形成机制
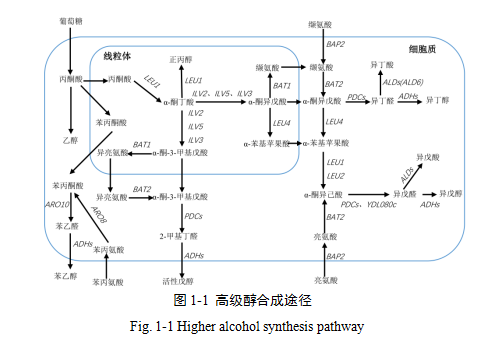
α-酮酸是指含有酮基和羧基的有机化合物,是合成高级醇重要的前体物质(Marwa E et al.2019)。根据α-酮酸的来源不同,可将高级醇的形成途径分为两条,一是氨基酸分解代谢途径(Ehrlich途径)(Ehrlich 1904;Hazelwood et al. 2008;Styger et al.2011),二是由葡萄糖经丙酮酸合成的糖合成代谢途径( Harris途径)(Chen 1978; Dickinson等1997;Eden等2001)。
1907年德国化学家Ehrlich首次提出氨基酸可衍生出高级醇,其后50年内不断得到完善,并通过13C特异性标记在酿酒酵母中获得最终验证,根据此路径,缬氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸、色氨酸分别对应降解形成异丁醇、异戊醇、活性戊醇、酪醇、苯乙醇和色醇。1953年,α-酮酸中间体在糖酵解生成丙酮酸,并经乙酰羟酸合成酶的作用进入氨基酸生物合成途径的最后阶段被Harris发现,由此糖代谢合成高级醇的途径逐渐被发现和完善,正丙醇、异丁醇、异戊醇、活性戊醇等分别可通过α-酮丁酸、α-酮异戊酸、α-酮异己酸、α-酮-3-甲基戊酸等在脱羧作用下形成醛最后还原生成。杂醇醛除了可以被醇脱氢酶还原为高级醇外,还可以被醛脱氢酶氧化产生脂肪酸,二者生成的比例通常取决于细胞的氧化还原状态和厌氧发酵条件,在葡萄酒酿造环境中往往是利于高级醇形成的(Vuralhan et al. 2003),仅有1%左右的小部分碳骨架被转移形成脂肪酸(Waterhouse A L et al. 2016),从而有助于维持细胞的氧化还原平衡(Vidal et al. 2015;Cordente A G et al. 2019)。
在高级醇下游反应中,其本身又可以充当前体在乙酰转移酶的作用下与羧酸进行酯化反应形成酯(Cordente et al.2012),对于增强水果香气非常重要,尤其是在年轻的葡萄酒中(Moreno-Arribasand Polo. 2009),在储存过程中也可以通过酸催化机制在非酶促条件下发生,但所形成的酯的浓度通常远低于阈值且不具有明显的感官特性。此外,高级醇还可以充当氧化基质转化为醛,给酒带来“氧化味”等缺陷。
目前,尽管高级醇代谢途径研究比较透彻,但是关于酿酒酵母高级醇的转录调控机制仍不清楚。有研究发现酵母在正常发酵时,75%的高级醇代谢来自Harris途径,只有25%的高级醇来自Ehrlich途径,且后者对前者具有补充和抑制双重效果(Guymon et al.1961; BAI W et al. 2019),但受到发酵液营养组成、菌株类型、发酵条件等复杂因子的影响,在胁迫等条件下高级醇代谢调控机制以及碳源转化率更不得而知。
1.2 碳源对高级醇产量的调节
1.2.1 葡萄中碳源的种类及含量
葡萄成熟浆果中糖类物质一般占15%~25%(Belajova E and Suhaj M. 2012),含量受品种、产地、气候、加工等影响(Coelho et al. 2017)一般在160~250 g/L间,而酿酒葡萄中糖分相对更高。葡萄糖和果糖是葡萄和葡萄汁中的主要糖,成熟期两者含量相当,除此之外还有蔗糖、麦芽糖以及不可被直接利用的木糖、阿拉伯糖、鼠李糖以及多糖等(Apolinar-Valiente et al.2015)。酵母菌株对葡萄糖的亲和力显著高于果糖,在含有相酮浓度的葡萄糖、果糖培养基中进行发酵时,酵母对葡萄糖的利用率约为果糖速率的2倍,其次蔗糖和麦芽糖才被利用,这往往是由葡萄糖效应所决定的。
伴随全球气候变暖,葡萄的糖含量在逐年升高(Aurand et al. 2014),一方面会改善冷凉产区葡萄酒酸高等缺陷,另一方面会使原本炎热优质产区的葡萄酒品质有所下降(刘敏 2017)。过去一百年中,中国平均气温上升了0.79℃,作为我国优质酿酒葡萄产地的新疆产区年平均气温则升高了1.0-1.3℃,又因其本身具有光照充足、日温差大、降雨量少等气候特点,使得酿酒葡萄原料普遍存在含糖量过高等问题(王昌魁等,2008),这也会影响葡萄中可同化氮含量以及酒精发酵过程中酵母对氮素的需求(Ramon et al. 2010;Martínez-Moreno et al. 2012)。
1.2.2 碳源对高级醇代谢的影响
有研究报道在模拟葡萄汁中,酵母将大约95%的糖转化为乙醇和二氧化碳,1%转变为细胞原料,剩下4%转变为高级醇、酯类等(潘婷,2015)。Mark A等人(2014)通过使用高精度[U13]C-葡萄糖示踪剂研究葡萄己糖对挥发性物质的贡献,发现高级醇的主要促成因素是合成代谢途径,其中碳骨架是己糖从头合成的,进一步证实Harris合成途径在高级醇的代谢中占主导地位。
碳源种类利用方面,谢克林等人(2016)通过外源添加发酵糖发现,在葡萄糖和果糖条件下酒中的醇类和酯类生成量达到最大值,且对植物香、果香和风味强度改善最大。虽然有报道指出单独使用果糖所产生的高级醇含量和种类要稍高于葡萄糖,然而在葡萄汁中随着发酵进行果糖往往在酵母生长后期才被利用,并不在高级醇产生的主要时期。针对工业上为改善原料糖低而添加的蔗糖而言,有研究分别将相同含量的葡萄糖、蔗糖对果汁进行添加,发现葡萄糖组中异丁醇、异戊醇的含量较蔗糖组分别增加了20%、24.3%(曾朝珍等,2018),可见蔗糖对高级醇的产生要低于葡萄糖的影响。此外,Da(2011)研究表明酿酒酵母启动子的强度与碳源的种类显著相关,PPGK1、PTPI1、PENO2等糖酵解相关和PTEF1、PTEF2转录延长相关等67个启动子的强度在不同的碳源条件下强度不同,进而可能会通过碳代谢流作用于产物(缪晡等,2019)。
在碳源含量影响方面,随着糖初始量的增加,高级醇的含量也相应提高,有报道认为,葡萄汁的初始糖含量与异戊醇、异丁醇以及苯乙醇分别呈极显著正相关和显著相关。在蛇龙珠干红酿造中,酒中的异戊醇、异丁醇以及活性戊醇都随着糖的初始量增加而升高(冯韶辉,2012)。低浓度的糖则可能使高级醇的前体物质α-酮酸的产生较少,以及形成高级醇的脱氨基作用不强烈,而使高级醇的生成量比高糖浓度的要少一些(Ough et al. 2006)。González等人(2018)也报道了低葡萄糖可能会抑制高级醇的形成,这或许可用较低的酵母细胞密度来解释。
碳源的补加方式也会对高级醇产生影响,然而增减尚有分歧。贾斌(2014)通过在啤酒酿造中补加葡萄糖导致了异丁醇、正丙醇、异戊醇含量的急剧增加,甚至后两者达到阈值浓度的两倍以上。而秦伟帅(2010)在发酵第三天时进行二次补糖却得到相反结论,认为二次加糖降低了α-酮酸的产生。此外,有研究报道培养基中添加氟化钠会导致高级醇的降低,其对丙酮酸激酶可产生明显的抑制作用,可降低丙酮酸的合成,进而降低高级醇的含量(李晨阳等,2017)。
1.3 高级醇代谢调控基因及组学研究进展
1.3.1 相关调控基因
己糖代谢是酵母对糖吸收利用的第一步,被转运至胞内的葡萄糖和果糖分子可通过己糖激酶进行磷酸化,随后进入糖酵解途径。已鉴定出约20个基因编码相关的转运蛋白和感受体(HXT1~HXT17、GAL2、SFN3和RGT2)参与己糖的转运,其中HXT基因家族中HXT1是负责葡萄糖转运的重要基因,对发酵条件下的葡萄糖和果糖的利用非常重要(赵文英和贾万利,2014)。
在Ehrlich途径中,通常涉及氨基酸渗透酶、转氨酶的参与。其中氨基酸通透酶由基因GAP1、BAP2、BAP3、MMP1、MUP3等编码(Rouillon et al.1999),其表达能促进酵母缬氨酸、异亮氨酸和亮氨酸的同化率;BAT1、BAT2和ARO8、ARO9则分别负责编码支链氨基酸和芳香族氨基酸转氨酶(Hazelwood et al.2008;Ugliano and Henschke.2009)。刘芳志等(2016)通过敲除BAT2来减少α-酮酸合成,过表达BAT1来增加α-酮酸消耗,从而降低酿酒酵母高级醇。ARO8、ARO9在汉逊酵母中过量表达可导致酒中苯乙醇含量增加(Cordente A et al.2019)。在Harris途径中,LEU1编码异丙基苹果酸合成酶,是形成α-酮丁酸和由α-酮异戊酸到α-酮异己酸的转化过程中的重要基因。LEU2编码丙基苹果酸脱氢酶,该酶可催化β-丙基苹果酸合成α-酮异己酸(石钰等,2015;佐一含等,2011);ILV基因家族主要负责编码与氨基酸合成相关的酶,其中异戊醇和异丁醇合成共由ILV2/6/5/3编码,负责将丙酮酸转化为2-酮异戊酸。其中,由ILV2/6编码的乙酰乳酸合酶是Harris途径的关键调控酶,受缬氨酸反馈抑制(Pang S and Duggleby R.2001;CHEN X et al.2011)。在脱羧成醛并还原成醇的过程中,主要由酮脱羧酶和醇脱氢酶调控,且一般具有广泛的底物特异性。目前,已知有五种酶参与α-酮脱羧,主要由 PDC1、PDC5、PDC6编码的丙酮酸脱羧酶、ARO10编码的苯丙酮酸脱羧酶和THI3编码的类丙酮酸羧化酶,其中PDC1/5/6在缬氨酸降解中可将α-酮异戊酸脱羧,亮氨酸的降解则主要由THI3p催化(Dickinson et al. 2000;Dickinson et al.2003;Vuralhan et al. 2003)。ADH1~ADH7编码醇脱氢酶(Hazelwood et al.2008),AAD10、AAD14编码将芳香醛转化为醇的芳香醇脱氢酶(Delneri et a.1999)。Styger 等人(2011、2013)基于构建双重和三重缺失突变体筛选,认为AAD6、BAT2、HOM2、PAD1、PRO2和THI3是影响高级醇产生的最重要基因。
此外,ATF基因编码醇乙酰基转移酶,过表达可以生成更多的乙酸酯,从而减少高级醇的积累。有研究表明,通过对黄酒酿酒酵母ATFl基因过表达和LAH1基因缺失后,菌株异戊醇含量较对照降低了近50%(Zhang et al. 2012)。
1.3.2 组学技术在酵母高级醇代谢研究中的应用
转录组学是高通量组学的常用分析技术之一,涉及细胞中所有mRNA转录物的测量。转录组学研究通常在鉴定宿主基因调控网络方面很有价值,这可以帮助激发重新调控细胞调控的新策略,已被广泛用于研究和工程化酿酒酵母对各种化合物的耐受性(Lian et al.2018)。
为了更好地了解发酵过程中香气产生的分子和代谢基础,将来自甘蔗酒、清酒、葡萄酒及实验室的酵母在两个发酵时间点(二氧化碳释放速率分别为5g/L,50g/L)进行转录组和代谢组比较分析,发现在发酵T1阶段(二氧化碳5g/L释放),清酒酵母显示出参与Ehrlich途径中高级醇形成相关的ADH7、AAD6基因的上调。在发酵T2阶段(二氧化碳50g/L释放),不仅清酒酵母,葡萄酒酵母VL1菌株也显示出参与高级醇合成的基因表达增加,即ADH7、ADH6和AAD6,这与观察到甲硫醇、异丁醇、异戊醇和苯乙醇的高浓度相对应(Mendes I et al.2017)。酿酒酵母中与异丁醇合成存在竞争的几种途径会导致线粒体中L-缬氨酸、L-异亮氨酸和细胞质中异丁酸、亮氨酸、乙醇的大量生成。敲除与缬氨酸(BAT1)、异亮氨酸(ILV1)、异丁酸(ALD6)、亮氨酸(LEU1)形成相关的基因,构建了一株异丁醇浓度和产量分别增加了8.9和8.6倍的菌株(Lee KM et al.2018)。通过代谢物分析和转录组测序表明,TIR1和GAP1是发酵中高级醇代谢的关键调控基因(Sun et al. 2019)。P. LIU等人(2017)则通过向非限氮的葡萄模拟汁中添加比对照多三倍的支链氨基酸(BCAAs),导致异戊醇浓度显著提高了43%,随后在发酵的第24、40、76小时取样进行转录组学分析, AAD3/4/14、ADH2和PDC5基因分别上调了1.94、1.52、1.76、1.88和1.52 倍可能直接促进高级醇的产生,进一步解释了加入BCAAs后葡萄酒中高级醇的增加的原因。因此,可以通过转录组测序进一步分析碳源对酵母高级醇代谢水平的网络调控机制。