砧木评价与改良岗位
李敏敏 赵胜建 郭紫娟
摘 要:为了进一步了解葡萄干旱胁迫的响应机理,本试验对1103P(耐旱性强)和101-14M(耐旱性弱)在干旱胁迫后气孔的调节行为和H2O2清除酶的活性进行了分析,结果表明,干旱胁迫诱导了1103P和101-14M叶片的ABA含量升高,气孔开张度降低和叶片表皮蜡含量增加;然而相比101-14M,1103P具有较高的叶片ABA含量,较小的气孔开张度,和较高的叶片表皮蜡;并且干旱胁迫下,1103P的POD、CAT和APX酶活性较高。因此,本研究认为,干旱胁迫后1103P具有较强的气孔调节能力和H2O2清除酶活性,是1103P具有较强耐旱性的重要原因。
关键字:葡萄,砧木,干旱,气孔开张度,ABA,H2O2清除酶
干旱胁迫下,植物体从内到外发生一系列生理生态、生化及形态上的变化来抵御干旱的威胁,比如生长量降低、叶片面积变小、气孔关闭等。植物体水分的散失主要是通过气孔的蒸腾作用,气孔的状态对水分蒸腾有着重要的影响。非气孔的水分散失是植物体水分散失的另一种方式,主要是通过细胞的间隙散失水分,而叶片表皮蜡含量多少在一定程度上决定了水分非气孔散失的大小。干旱胁迫下植物会产生大量的活性氧(ROS),可以破坏细胞的膜系统,对植株器官造成伤害,而植物体内清除ROS的酶系统可以较少逆境下产生ROS造成的伤害。本研究主要从干旱胁迫下叶片的气孔行为、叶片表皮蜡含量和ROS清除酶活性方面来阐述葡萄耐旱性的生理机制。
1 材料与方法
1.1 试验材料与设计
试验时间和地点:试验于2018年5-8月在河北省农林科学院昌黎果树研究所创新基地避雨棚内进行。
试验材料:通过2016-2017年砧木耐旱性试验,筛选出2 个具有代表性的抗旱品种, 即抗旱性极强的葡萄砧木品种1103 P(V.berlandieri ×V.rupestris )和抗旱性较差的砧木品种101-14M(V.riparia ×V.rupestris )作为试验材料。
试验设计: 将1 年生砧木苗定植在装有基质( 田园土: 沙子:锯末=2:1:2)大营养钵(下底直径15cm,上底直径18cm,高25cm),置于避雨棚内,常规管理。待葡萄苗长出7-8片叶时选取生长正常、一致的植株进行干旱处理。试验设计干旱(DT,土壤最大含水量的40%-45%)和对照(CK,土壤最大含水量的70%-75%)两个处理,采取每天称重补水的方法维持土壤含水量在该范围。当干旱处理的土壤含水量下降至试验设计要求时,定义为第0天。
1.2 测定指标与方法
1.2.1 叶片相对含水量
称取新鲜叶片的鲜重(FW),然后放在去离子水中过夜,称取叶片的饱和含水重(RW),70 °C 烘干48小时后称取叶片干重(DW),叶片相对含水量(RWC)=(FW–DW) ⁄(RW–DW)。
1.2.1 光合特性
选取苗木上数第6 - 8 片功能叶,采用LI-6400XT便携式光合仪(美国LI-COR公司生产)于0、7、14、21、28天上午9:00-11:00测定光合参数,包括叶片净光合速率(Pn) 、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。测定控制光强为1600μmol•m-2•s-1。
1.2.2 叶片ABA含量
叶片ABA含量利用Agilent 1290HPLC高效液相色谱仪器进行测定,色谱条件为:流动相为甲醇:0.6%醋酸=45:55,流速0.8ml/min,检测器波长254nm。
1.2.3 气孔大小、密度及气孔开张度
叶片样品取下后立即浸泡在PBS缓冲液(pH 6.8)中以避免气孔开张度变化。利用JSM-6360LV扫描电镜(SEM)观察气孔的大小、密度和开张度。
1.2.4 叶片表皮蜡含量
5 片新鲜叶片放置在3 0 m lCHCl3 溶液中,1分钟后迅速取出,过滤得到的提取液,在室温下自然挥发至恒重,称取蜡重量W1。过滤后的叶片在70℃烘干24小时,称取叶片干重(DW)。叶片表皮蜡含量(CWC)=W1/DW。
1.2.5 H2O2清除酶活性
过氧化氢酶(CAT)、过氧物酶(POD)、抗坏血酸过氧化物酶(APX)的活性测定参考Chance(1955)。
2 结果与分析
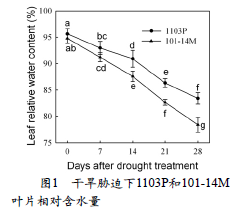
2.1 干旱胁迫下1103P和101-14M叶片相对含量(RWC)的变化干旱胁迫下,1103P和101-14M叶片的RWC均逐渐降低,然而,1103P的RWC高于101-14M。(图1)
2.2 干旱胁迫下1103P和101-14M叶片光合参数差异
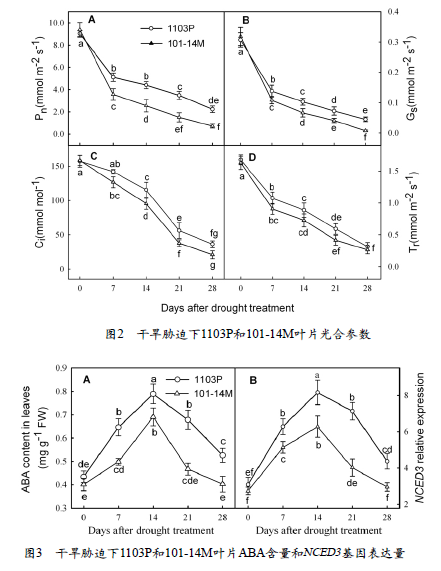
由图2可以看出,随着干旱胁迫的持续,两种砧木的净光合速率(Pn)、气孔导度(Gs)、胞间二氧化碳浓度(Ci)和蒸腾速率(Tr)均逐渐降低。然而除了第0天以外,1103P的Pn、Gs、Ci和Tr均高于101-14M。
2.3 干旱胁迫下1103P和101-14M叶片ABA含量和NCED3 基因表达差异
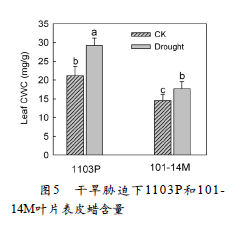
干旱胁迫后,1103P和101-14M叶片ABA含量和NCED3 基因表达量先升高后降低,在干旱处理14天时出现最大值。1103P叶片的ABA含量和NCED3 基因表达量在整个干旱时期均高于101-14M。(图3)
2.4 干旱胁迫下1103P和101-14M叶片气孔行为的差异
干旱胁迫14天时叶片气孔密度和气孔状态见图4。干旱胁迫尽管对气孔密度没有造成明显的影响,然而使气孔长度、宽度和开张度显著降低。不管是正常浇水(CK)条件下,还是干旱胁迫下,101-14M叶片的气孔密度、气孔宽度、气孔开张度显著大于1103P。
2.5 干旱胁迫下1103P和101-14M叶片表皮蜡含量差异
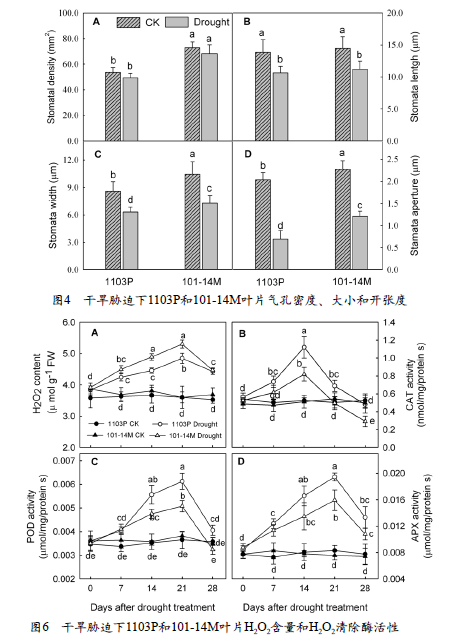
干旱胁迫14天时叶片表皮蜡含量见图5。干旱使1103P和101-14M叶片表皮蜡含量升高,与对照相对,1103P和101-14M分别升高了38.4 %和21.2 %;无论是正常浇水还是干旱胁迫下,1103P的叶片表皮蜡含量均显著高于101-14M。
2.6 干旱胁迫下1103P和101-14M叶片H2O2含量及其清除酶活性差异
干旱使1103P和101-14M叶片H2O2含量升高,并且101-14M的含量高于1103P。(图6)干旱胁迫也促使了1103P和101-14M叶片CAT、POD和APX酶活性先升高后降低,并且1103P叶片酶的活性高于101-14M。
3 讨论
为了抵御干旱的胁迫,植物体能发生一系列的生理生化的变化,然而关于不同抗性的葡萄在抵御干旱胁迫后的生理生化响应研究较少。本研究通过比较1103P(耐旱性强)和101-14M(耐旱性弱)在叶片减少水分散失和H2O2清除酶活性两方面的差异,来揭示葡萄的耐旱机理。
植物叶片水分的散失主要是通过气孔的蒸腾散失和非气孔的散失,气孔的蒸腾散失的水分与叶片气孔的数量、大小及开张度紧密相关,而非气孔的水分散失与叶片的表皮蜡含量负相关。正常浇水条件下,1103P叶片的气孔密度和气孔大小均小于101-14M,而叶片表皮蜡含量高于101-14M;并且在干旱胁迫下,1103P叶片的ABA含量较高,气孔开张度小于101-14M,叶片表皮蜡含量也显著高于101-14M。因此,1103P具有较强的控制水分散失的能力,这也是干旱胁迫下1103P保持较高的叶片相对含水量的原因。
干旱胁迫能诱导植物体产生大量的活性氧,从而对细胞的膜系统造成损伤,H2O2是一种重要的活性氧,其含量的高低在一定程度上影响着细胞膜系统的稳定性。干旱胁迫导致了1103P和101-14M叶片的H2O2含量升高,并且1103P叶片H2O2的含量明显低于101-14M。而且,干旱胁迫后,1103P叶片的H2O2清除酶的活性高于101-14M。因此,1103P一方面具有较强的叶片气孔调节能力和叶片表皮蜡来防止水分的过度散失,另一方面,1103P具有较强的H2O2清除酶活性来减少H2O2对细胞膜系统的伤害,这两方面可能是1103P具有较强耐旱性的原因。