石家庄综合试验站
‘巨峰’,四倍体品种,属欧美杂种,为日本育成,1959年引入中国试种。而后因其适应性强、抗病、抗寒、果粒大、色泽好、风味佳而深受果农和消费者欢迎,逐渐在全国各地大面积推广。目前,巨峰葡萄已成为广大地区主要的葡萄品种之一。
葡萄果皮颜色是果实外观品质的重要指标之一,花色苷在果皮中积累的数量和其构造的差异决定了果皮的颜色,大致可以分为黑、红、白色。花色苷是一类广泛存在于植物中的水溶性天然色素,属黄酮类化合物,具有极强的抗氧化能力和清除自由基的作用,并能预防心血管疾病,因此,花色苷目前被广泛用于食品、医药、化妆品等各个行业。葡萄浆果中花色苷的组成比例及含量不仅决定着葡萄果实的颜色,同时对葡萄酒的质量也有非常重要的影响。
当前,随着花色苷代谢途径研究的逐渐深入,生物合成途径已有明晰的轮廓。在对葡萄浆果发育过程中与花色苷合成相关的基因进行表达分析后,发现只有尿苷二磷酸葡萄糖-类黄酮葡萄糖基转移酶(UDP-glucose 3-O-flflavonoidglucosyltransferase,UFGT)基因在葡萄浆果转色后表达,而且在白葡萄中表达水平比在有色葡萄中低很多,由此确定了UFGT是决定葡萄浆果颜色的关键基因。随着研究的深入,越来越多的参与花色苷生物合成的基因被鉴定,人们发现花色苷的生物合成需要两类基因的参与,一类是结构基因,编码直接参与花色苷合成与积累的酶;另一类是调节基因,调控结构基因的时空表达。Kobayashi等利用Northern blotting技术对葡萄UFGT基因的转录调控做了一系列深入研究,克隆出了8个MYB(v-mybavian myeloblastosis viral oncogenehomolog)相关基因,并证实其中MYBA基因与UFGT的表达密切相关;后续研究表明,在很多欧亚种(Vitis vinifera L.)葡萄中都发现了能够调节UFGT的表达从而参与欧亚种葡萄花色苷生物合成的VvmybA1基因,而且VvmybA1在白色欧亚种葡萄品种的果皮中不表达,在所有有色葡萄品种的果皮中表达。
鉴于巨峰葡萄的遗传背景复杂,揭示其花色苷代谢与调控规律更困难。本园区巨峰自交后果皮颜色出现了典型的性状分离,出现了众多的中间表型。现以巨峰葡萄与其自交后代为试材,对其果皮色素遗传进行进一步研究, 旨在为揭示巨峰葡萄果实色泽遗传提供理论基础。
1 材料和方法
1.1 材料

2010年5月以‘巨峰’( V.vinifera ×V. labrusca )自交,秋季采收种子,10月份至2011年2月进行层积处理,3月份对自交种子催芽以及播种,6月份进行移栽和定植,现所有实验材料均栽植于石家庄果树研究所葡萄试验园,均长势良好,挂果成熟稳定。其中,自交后代出现果皮颜色的性状分离,出现了不同的色泽。本试验选取‘巨峰’(kyoho)、黄色(white)、粉色(pink)、黑色(black)后代为试材,分析颜色变异的遗传机理。在进入果实成熟期开始,对样本植株的果实成熟度进行跟踪观察,发现果实成熟后随即进行取样。取样方式为每个植株采集3穗果实,均匀从每穗的上中下剪取果粒,收集一部分样品用于单果质量、可溶性固形物以及糖酸含量测定,另一部分存放于自封袋内,做好标记,液氮速冻,-80℃保存备用。
1.2 方法
1.2.1 果实单果重、糖、酸的测定
随机选取20粒果实,利用电子天平称重并求得单果重量。随机选取10粒果实,利用粉碎机打成匀浆,并用纱布过滤,用手持糖度计测定滤液的可溶性糖(TSS)。可滴定酸的测定参照GBT15038-2006的办法。
1.2.2 果皮花色苷的测定
花色苷的测定参考杨夫臣等的方法,并略有改动:准确称取液氮研磨的果皮粉末1g,以预冷的1%盐酸-无水甲醇溶液(pH=2)作为浸提液,4℃遮光浸提1h,4800rpm离心10min,吸取上清液,冲洗沉淀2次,定容到50ml待测。以1%盐酸-无水甲醇溶液作空白参比调零,选取巨峰定容后的溶液,测定450~600nm的吸收光谱,确定巨峰葡萄色素的最大吸收峰,并测定各溶液的吸光度值,重复3次。葡萄果皮中花色素含量的计算参照张昭其等的方法:花色素含量 (mg/g)=A×V×1000×455.2/ 29600×d×m。式中:A:最大吸收波长处吸光度值;V:定容体积(L);1000:g换算成mg扩大的倍数;455.2:矢车菊素-3-葡萄糖苷的分子质量(g/mol);29600:矢车菊素-3-葡萄糖苷的浓度比吸收系数(L/mol•cm);d:比色杯光径(cm);m:鲜质量(g)。
1.2.3 果皮总RNA的提取与cDNA合成
使用植物总RNA提取纯化试剂盒(上海生工生物工程股份有限公司)提取葡萄果皮的总RNA。用1.0%凝胶电泳检测RNA质量。使用Revert Aid First Strand cDNASynthes is Kit试剂盒(Thermoscientific公司)将提取的RNA反转录成cDNA。
1.2.4 花色苷合成相关基因荧光定量表达分析
根据本课题组转录组测序得到的转录组数据,参考NCBI(https://blast.ncbi.nlm.nih.gov)基因序列,采用在线设计工具Primer-BLAST设计引物,由上海生工生物工程股份有限公司合成(表)。以‘巨峰’及其3个不同颜色的的后代果皮cDNA为模板,使用SYBR PremixEx Taq Ⅱ试剂(TaKaRa公司)进行PCR扩增。qPCR 体系为:cDNA模板3.5μL,上下游引物各0.4μL,Mix10μL,ddH2O 5.7μL。qPCR程序为:95℃预变性2min;95℃变性15s,60℃延伸1min,共循环40次,在65℃-95℃进行溶解曲线分析。以actin 的表达水平为内参,基因的相对表达量按BIO-RAD CFX荧光定量仪使用说明进行分析。以‘巨峰’白色后代(White)作为对照,即表达量为1,数据使用Origin 9.0软件进行处理。
2 结果与分析
2.1 果实的理化性质与花色苷的测定
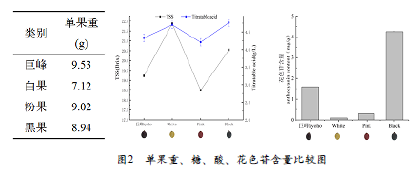
由图2可知,成熟期各试材单果重除白果最小外,其余果重差异不大。然而,可溶性固形物差异明显,白果最大(21.87%),粉果最小(18.5%),亲本巨峰居中分布。可滴定酸含量差异不大,变化范围为4.21-4.76mg/g,白果最高,粉果最低,亲本巨峰居中分布。综上所述,各试材均处于成熟期,其中白果的糖酸特点属于高糖高酸型,而粉果为低糖低酸型。本研究中巨峰自交组合后代出现较大的性状分离,分别出现了白、粉红、紫、黑等多个果皮色泽表型。选取了具有代表性的白、粉红、黑三个后代进行花色苷测定。由图2可知,亲本巨峰的总花色苷含量为1.59mg/g,浸提液呈浓紫色;白果的花色苷最小,仅为0.097mg/g,浸提液呈淡黄绿色;黑果的花色苷最大,为4.25mg/g,浸提液为黑紫色;粉果花色苷含量居中分布。
综上所述,巨峰自交组合在糖、酸、花色苷性状遗传上存在较大的性状分离,同时存在超亲现象。
2.2 花色苷相关基因的表达分析
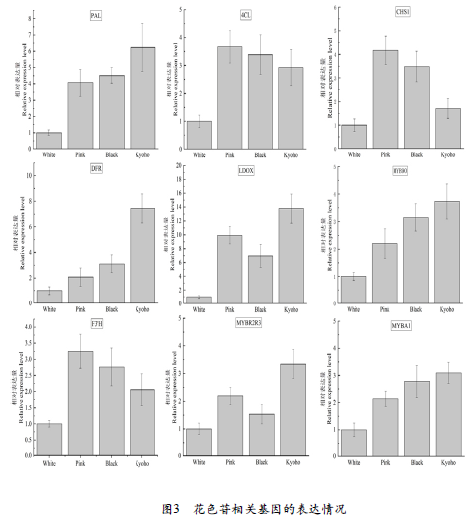
如图3所示,白果色素相关基因的表达量均低于各有色果实,其中UFGT、F3’5’H、FAMOT基因的表达极低。由此可见,巨峰后代果实出现白果可能是UFGT功能缺失,以致后期FAMOT也不表达,导致色素合成中断,阻碍色素积累。
粉色果中PAL、MYB90、DFR、F3’5’H、MYBA1基因的表达量低于亲本巨峰、黑果,但CHS1、4CL、F3’H的表达量最高。黑果中多数基因的表达量并不高于巨峰,只有4CL、CHS1、F3’5’H高于巨峰,其中F3’5’H的表达量约为巨峰的4倍,粉果的8.7倍。由此可推测,巨峰有色后代中色泽差异主要是F3’H/F3’5’H基因表达比例不同导致的,比例越低,着色越黑,其中F3’5’H基因为颜色差异的主导。
3 讨 论
花色苷生物合成相关的基因分为结构基因和调节基因两类。其中,结构基因直接编码花青素/苷生物合成过程中生物合成酶类(如CHS、CHI、F3H、DFR、ANS、ANR、UFGT 等);调节基因则通过调控花青素/苷生物合成结构基因的表达强度和模式,调控花青素/苷的时空积累(如MYB、MYC、WKRY、WD40 等)。有色果实在果皮内积累花色苷,而白色果皮的葡萄品种不能在果皮内合成花色苷,其实质是由于有关基因发生了突变,导致了合成色素有关基因的丢失。本研究中,白果的UFGT、FAMOT的表达量极低,推测是UFGT的基因功能缺失导致花色苷合成受阻。但有研究显示,某些白色葡萄和有色葡萄中的UFGT基因序列分析后却没有发现明显的区别,因此本研究推测还需要后期验证。
由于VvmybA1的DNA序列中插入了一个逆转座子Gret1导致了VvmybA1的失活,使白色欧亚种葡萄品种的花色苷生物合成基因UFGT的转录受到抑制,无法合成花色苷,从而呈现白色。本研究中,白果与有色果实的mybA1的表达量差异并不是很显著。这可能与巨峰遗传背景的复杂性,MYBA1适用种群的局限性等有关。
Azuma等研究显示,F3’H和F3’5’H的表达水平决定花青素/花翠素和花色苷的比率,从而影响了葡萄果皮的颜色,而UFGT、OMT、GST基因的表达量也对花色苷的含量具有明显的促进作用。
本研究中,巨峰后代中色泽差异主要是F3’H/F3’5’H基因表达比例不同导致的,比例越低,着色越黑,其中F3’5’H基因为颜色差异的主导,这与前人的研究相一致。