贺兰山东麓综合试验站
姜彩鸽 宋双 李茜 王国珍 张怡
宁夏贺兰山东麓地区是全国最大的葡萄酒地理标志保护产区,随着葡萄种植面积不断扩大,单一的生态环境的持续,有害生物的生态适应性也不断提高,葡萄灰霉病已成为贺兰山东麓葡萄产业重大病害之一,主要造成成熟期果实腐烂,据调查,不同年份造成不同品种的产量损失约20%~50%。对于该病害的防治,生产上仍以化学防治为主,且化学用药水平也在逐年提高。我国灰霉病化学防治中常用杀菌剂品种为苯并咪唑类的多菌灵、二甲酰亚胺类的腐霉利和异菌脲、苯胺基嘧啶类的嘧霉胺以及 N-苯氨基甲酸酯类的乙霉威等。2013年啶酰菌胺和啶菌 唑在我国登记用于灰霉病的防治。而引致葡萄灰霉病的灰葡萄孢菌(Botrytis cinerea )具有寄主范围广、产孢量大、再侵染频繁、遗传变异大和适合度高的特性,特别是在对该病的防治中单一化学杀菌剂的长期反复使用,极易产生抗性,国内外已有大量报道表明灰霉病菌对这些药剂产生了不同程度的抗性,因此,定期对灰霉病菌进行抗性检测以及引入与现有杀菌剂没有交互抗性的新型杀菌剂是灰霉病综合治理中的必要措施。
本研究通过对贺兰山东麓不同地区、不同葡萄品种上的灰霉病菌对目前生产上常用和新引入使用的8大类杀菌剂的抗药性进行比较分析。旨在依其不同的抗药性水平而采取不同的用药策略,延缓病菌的抗性发展,提高葡萄灰霉病的防治效果、降低农药残留,推动我区有机葡萄的可持续发展。
1 材料与方法
1.1 材料
1.1.1 菌株采集地区和品种
采集地区:贺兰山东麓葡萄主栽区—宁夏农垦(黄羊滩、玉泉营农场)、青铜峡市(先锋村、树新林场、御马)、贺兰山沿山(园林场)。
采集品种:选主栽葡萄品种。酿酒葡萄—赤霞珠、霞多丽;鲜食葡萄—红地球、乍娜、大青。
菌株采自常规施药的葡萄园中的病果上分离获得,单孢纯化后转入斜面,菌株以采样地市或县的小写拼音字头“字母+序号”命名,保存于4℃冰箱中待用。
1.1.2 药剂及试剂
八大类药剂各选一种田间常用的药剂以供研究: 苯并咪唑类-97.09%多菌灵(carbendazim)、二甲酰亚胺类- 9 8 . 1 % 腐霉利(procymidone)、N-苯基氨基甲酸酯类-95.4%乙霉威(diethofencarb)、苯胺基嘧啶类- 9 8 . 2 % 嘧霉胺(pyrimethanil)、吡咯类-97.8%咯菌腈(fludioxonil)、酰胺类-84.39%啶酰菌胺(boscalid)、吡啶胺类-98.2%氟啶胺(fluazinam)和甾醇生物合成抑制剂-95%啶菌噁唑(SYP-Z048)原药,均由农业部农药检定所提供。除多菌灵用0.1mol/L HCL溶液溶解外,其余均用丙酮溶解,配制成1.0×104 μg/mL的母液,均加入0.2%乳化剂Tween-80,母液在4℃冰箱中贮藏备用。用时以无菌水稀释至适当的浓度,以药剂与培养基1:9的比例制成含最终所需浓度药量的水琼脂平板(培养基冷却至 45℃左右时再加入药剂),用以进行抗药性水平测定。
1.1.3 培养基
水琼脂平板培养基: 每1000mL水中含有20g琼脂。
1.1.4 主要仪器
超净工作台(苏州安泰空气技术有限公司)、空气浴摇床(太仓市实验设备厂)、智能光照培养箱(宁波江南仪器厂)。
1.2 检测方法
采用孢子萌发测定法,参照潘金菊等“黄瓜炭疽病菌对杀菌剂敏感性的优化测定方法研究”的方法进行。分生孢子萌发抑制率/% =〔(对照分生孢子萌发率-药剂处理分生孢子萌发率)/对照分生孢子萌发率〕×100
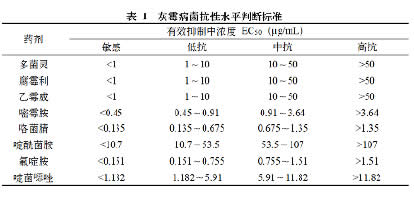
1.3 灰霉病菌抗性水平判断标准
以灰霉菌株对各药剂的抑制中浓度(EC50)来确定菌株的抗性水平。本研究葡萄灰霉病菌的抗性水平判定采用如下标准(见表1)。
2 结果与分析
2.1 明确了八大类药剂在不同地区不同品种条件下的毒力水平差异从所有的检测结果进行整体比较(表2),供试8种药剂在不同地区不同品种条件下的毒力水平表现不一。
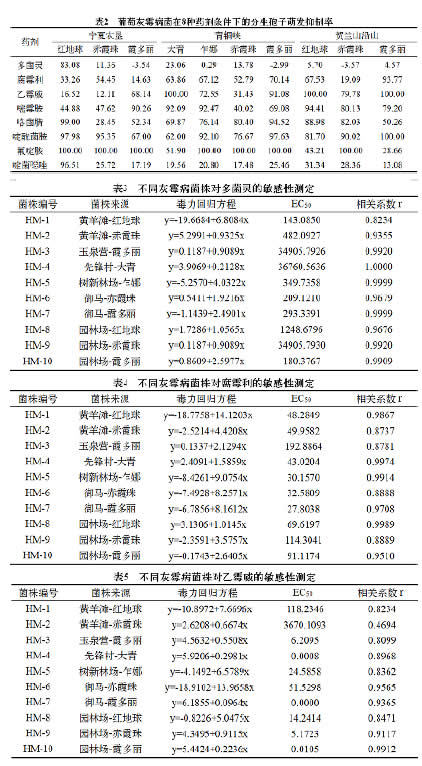
(1)从药剂水平看,氟啶胺、咯菌腈和啶酰菌胺对葡萄灰霉病菌分生孢子萌发的抑制率整体较高,其毒力相对较好,尤其是氟啶胺;而多菌灵和啶菌 唑对葡萄灰霉病菌分生孢子萌发的抑制率整体较低,其毒力相对较差,尤其是多菌灵,灰霉病菌已明显对其产生抗性。
(2)从不同地区看,青铜峡地区的灰霉病菌孢子萌发抑制率平均61.29%,对药剂敏感性稍好;其次是贺兰山沿山,平均60.76%;宁夏农垦平均56.35%。不过3个地区差异不显著。
(3)从不同品种看,鲜食葡萄品种整体较好,尤其是红地球上的灰霉病菌孢子萌发抑制率平均71.40%,对药剂敏感性稍好;而酿酒葡萄品种稍差,尤其是赤霞珠上的灰霉病菌孢子萌发抑制率较低,平均46.88%,抗药性较强。
2.2 明确了不同地区主栽品种上的灰霉病菌株对八大类药剂的敏感性
2.2.1 不同灰霉病菌株对多菌灵的敏感性
从表3可以看出:供试10个菌株对多菌灵的EC50值均远高于50μg/mL, 全部为高抗菌株。近些年来,多菌灵在各葡萄主产区普遍使用,已明显产生很高的抗性,个别地区品种上EC50值高达35000μg/mL左右。
2.2.2 不同灰霉病菌株对腐霉利的敏感性
从表4可以看出:供试10个菌株中,玉泉营和园林场园区葡萄灰霉病菌株对腐霉利的EC50值均高于50μg/mL,为高抗菌株;黄羊滩和青铜峡园区的10μg/mL≤EC50值<50μg/mL,均为中抗菌株。腐霉利起初进入产业使用时,防效非常突出。但据田间调查,近几年,随着该药在各葡萄产区频繁使用或妄自高浓度施用,抗性问题已显现。
2.2.3 不同灰霉病菌株对乙霉威的敏感性
从表5可以看出:供试10个菌株中,先锋村大青、御马霞多丽和园林场霞多丽上葡萄灰霉病菌株对乙霉威的EC50值均低于1μg/mL,为敏感菌株;玉泉营霞多丽和园林场赤霞珠的1μg/mL≤EC50值<10μg/mL,为低抗菌株;树新林场乍娜、御马赤霞珠和园林场红地球均为中抗菌株;而黄羊滩红地球和黄羊滩赤霞珠为高抗菌株。由此可见,黄羊滩园区的灰霉病菌株对乙霉威的抗性已很高,需引起重视。
2.2.4 不同灰霉病菌株对嘧霉胺的敏感性
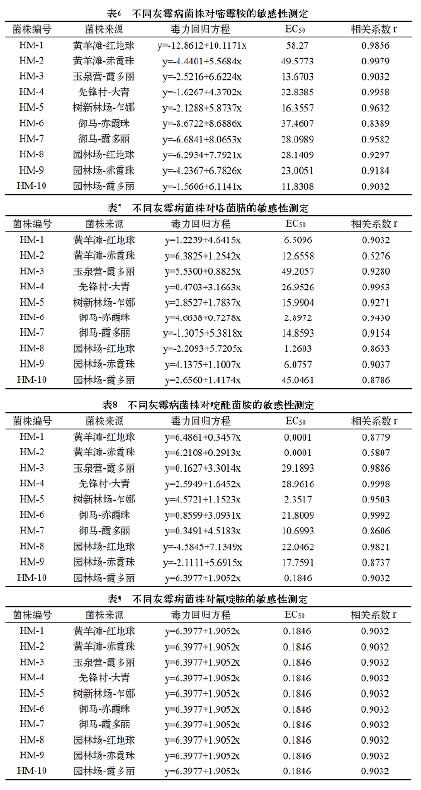
从表6 可以看出: 供试10个菌株对嘧霉胺的EC50值均远高于3.64μg/mL,全部为高抗菌株。嘧霉胺为近些年常用药剂,在各葡萄主产区使用年限和水平无明显差异,今后应酌情施用。
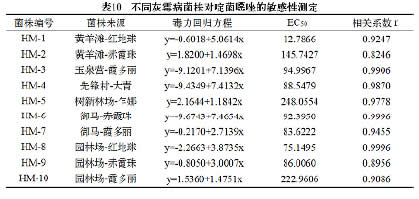
2.2.5 不同灰霉病菌株对咯菌腈的敏感性
从表7可以看出:除园林场红地球上的灰霉病菌对咯菌腈为中抗,其余菌株均为高抗,可能与霞多丽为灰霉病易感品种,且近两年施用该药较多有关。但整体而言,供试10个菌株对咯菌腈的EC50值均较低,田间使用该药效果也较好,今后需注意施用浓度和频率,防止抗性问题的严重发展。
2.2.6 不同灰霉病菌株对啶酰菌胺的敏感性
从表8可以看出:黄羊滩红地球和赤霞珠、树新林场乍娜、御马霞多丽、园林场霞多丽上灰霉病菌株对啶酰菌胺的EC50值<10.7μg/mL,均为敏感菌株;其余菌株均为低抗菌株。该药在我区各葡萄园使用较少,目前抗性不明显,今后可与抗性明显的药剂交替施用,以减缓抗药性的产生。
2.2.7 不同的灰霉病菌株对氟啶胺的敏感性
从表9可以看出:供试10个菌株对氟啶胺均为低抗菌株。该药在我区各葡萄园使用较少,今后可与抗性明显的药剂交替施用,以减缓抗药性的产生。
2.2.8 不同灰霉病菌株对啶菌噁唑的敏感性
从表10可以看出:供试10个菌株对啶菌噁唑的EC50值>11.82μg/mL,均为高抗菌株。该药在我区各葡萄园施用频繁,抗性表现明显,今后应减少施用。
3 讨论与结论
在孢子萌发测定法中发现:乙霉威对青铜峡产区的乍娜、赤霞珠、霞多丽上的灰霉病菌孢子形态产生影响。多菌灵也使该地区赤霞珠上的灰霉病菌孢子形态发生改变。此外,多菌灵作用下的多数菌株的灰霉病菌孢子芽管几乎等同于对照,有的甚至已发育成菌丝体,抗性明显很高;但与乙霉威不会同时出现在同一抗性水平上。这与报道的乙霉威作用特点一致,是一种与多菌灵有负交互抗性的杀菌剂。药剂进入菌体细胞后与菌体细胞内的微管蛋白结合,从而影响细胞的分裂。这种作用方式与多菌灵很相似,但二者不在同一作用点。如灰霉菌一旦对多菌灵产生抗药性,而对乙霉威很敏感。相反,对多菌灵敏感的灰霉菌,乙霉威则表现为无抑菌活性。
实验结果显示,贺兰山东麓三大葡萄种植区各主栽品种上用药种类和水平不一,所产生的抗性程度也有所不同。但总体比较来看,灰霉病菌株对氟啶胺的敏感性最强,其次为啶酰菌胺、咯菌腈和乙霉威,对多菌灵和啶菌噁唑产生的抗性最强。在今后化学防治时,田间可依据病害发生情况、气象条件及环境因素交替使用不同抗性杀菌剂,预防时可使用抗性较强药剂或低浓度的敏感药剂,病害发生较重时使用较高浓度的敏感药剂,尽量降低农药的过度使用、浪费和污染,达到药剂的高效利用和延缓病菌产生抗药性的目的。
本研究在实施过程中也引发了一些思考,若能将供试八大类药剂的交互抗性关系研究明白,将有助于我们制定出更详尽更科学的葡萄灰霉病化学防治细则,对指导我区葡萄产业生产使用更有实效与意义。