石家庄综合试验站
摘 要:本试验以2个不同颜色(红、黑)的葡萄品种(‘粉红亚都蜜’、‘摩尔多瓦’)为试材,选择着色期三个阶段(绿熟期,半红期,红熟期)的果实,测定果皮中的花色苷含量,荧光定量PCR技术分析不同时期花色苷合成基因表达量,同时克隆并对比分析两个葡萄品种的F3’5’H基因。结果表明:(1)果皮中花色苷含量随着果实的转色逐渐提高;(2)在果实转色发育过程中,花色苷合成相关基因均逐渐上调表达。基因F3’5’H与PAL在‘摩尔多瓦’的表达水平明显高于‘粉红亚都蜜’,红熟期表达量分别差24.65倍、13.10倍,其余相关基因(LDOX、UFGT、CHS、PAL、DFR、F3’H、MYBA1)表达水平差异并不明显;(3)‘粉红亚都蜜’与‘摩尔多瓦’的 F3’5’H基因的开放阅读框长度均为1527bp,编码508个氨基酸。F3’5’H蛋白均存在跨膜结构域,包含一个跨膜螺旋,均不含有信号肽序列;(4)对比‘粉红亚都蜜’与‘摩尔多瓦’的 ORF序列,发现了23个SNP位点,其中同义突变11个,非同义突变12个(其中2个突变改变1个氨基酸),致使有11个氨基酸发生差异,这可能是导致蛋白质结构和功能发生改变的原因之一。
关键词:葡萄;花色苷;F3’5’H;克隆
花色苷是花色素与糖苷键结合而成的一类类黄酮化合物,是植物的次级代谢产物,广泛存在于植物的茎、叶、花、果实的细胞液中,赋予了从青到红不同的颜色。葡萄成为深受人们喜爱的水果之一,与其丰富多样的果皮颜色具有很大关系。
目前花青苷物质合成途径已经较为成熟。花色苷的生物合成途径主要为苯基丙烷类代谢途径。花色苷的合成需要各种酶的参与,比如查尔酮异构酶(CHI),二氢黄酮—4—还原酶(DFR),花青素合成酶(ANS),类黄酮3’5’-羟化酶(F3’ 5 ’H) , 类黄酮3’-羟化酶(F3’H)等。其中,类黄酮3’5’-羟化酶(flavonoid3’5’—hydroxylase F3’5’H)和类黄酮3’-羟化酶(flavonoid3’—hydroxylase F3’ H)决定二氢莰非醇(Dihydrokaempferol,DHK) B 环的羟化模式, 并最终决定产生花色苷的结构。
F3’5’H催化DHK生成二氢杨梅酮(Dihydromyricetin,DHM),倾向于合成花翠素,使花色偏蓝;F3’H倾向于合成花青素,使花色偏红。类黄酮3’5’-羟化酶是葡萄花色苷生物合成中的关键酶之一。F3’5’H基因的克隆及分析研究将对揭示F3’5’H蛋白在花色苷合成中的作用具有重要理论意义。本试验以2个不同颜色(红、黑)的葡萄品种为试材,提取果皮RNA,用荧光定量PCR技术分析不同时期花色苷合成基因表达量,同时克隆并对比分析F3’5’H基因,以期为揭示果皮花色素合成差异提供参考。
1 材料和方法
1.1 材料
本试验选取葡萄品种‘粉红亚都蜜’与‘摩尔多瓦’为试材,栽植于石家庄果树研究所葡萄基地。在长势良好的植株上于3个时期采集葡萄果实,分别为绿熟期(Ⅰ),半红期(Ⅱ),红熟期(Ⅲ)。随机采样50-70个果粒放入自封袋,做好标记,液氮速冻,超低温冰箱(-80℃)保存。
1.2 花色苷物质的测定
(1)花色苷物质的提取 称取0.5g果皮组织,加入少量预冷的,冰浴条件下研磨匀浆后,转入20ml刻度试管中。用1%HCL-甲醇溶液冲洗研钵,一并转入试管中,定容至刻度,混匀,于4℃避光提取20min,期间摇动数次,然后过滤,收集滤液待用。
(2)花色苷物质的测定 以1%HCL-甲醇溶液做空白参比调零,取滤液分别于波长280nm,325nm,600nm和530nm处测定溶液的吸光度值,做三次重复。
1.3 总RNA的提取与cDNA合成
使用植物总RNA提取纯化试剂盒(上海生工生物工程股份有限公司)提取葡萄果皮的总RNA。
用1.0%凝胶电泳检测RNA质量。使用Revert Aid First Strand cDNASynthes is Kit试剂盒(Thermoscientific公司)将提取的RNA反转录成cDNA。
1.4 花色苷合成相关基因荧光定量表达分析
根据本课题组转录组测序得到的转录组数据,参考NCBI(https://blast.ncbi.nlm.nih.gov)基因序列,采用在线设计工具Primer-BLAST设计引物,由上海生工生物工程股份有限公司合成。以‘粉红亚都蜜’与‘摩尔多瓦’2个品种3个不同时期的果皮cDNA为模板,使用GoTaq® qPCR Master Mix(promega公司)进行PCR扩增。
qPCR 体系为:cDNA模板4μL,上下游引物各0.4μL,Mix10μL,ddH2O 5.2μL。qPCR程序为:95℃预变性2min;95℃变性15s,60℃延伸1min,共循环40次,在65℃-95℃进行溶解曲线分析。以actin 的表达水平为内参,基因的相对表达量按BIO-RAD CFX荧光定量仪使用说明进行分析。以‘粉红亚都蜜’绿熟期作为对照,即表达量为1,数据使用 Excel软件进行处理。
1.5 葡萄F3’5’H的克隆
根据本课题组转录组测序得到的转录组数据,参考NCBI(https://blast.ncbi.nlm.nih.gov) 基因序列,在线设计工具Primer-BLAST设计引物,由上海生工生物工程股份有限公司合成。引物序列为 Foward:ATGGCCATAGATACAAGCCTC;R i g h t :TGAAACGACCATCTTTGAGCTAAT。以2个葡萄品种红熟期果皮的cDNA为模板,用于以上引物的PCR扩增。扩增体系:2×Taq PlusMaster Mix 25μL、ddH2O 13μL、模板10μL 和引物各1μL。反应条件:98℃预变性5min;98℃ 10s,55℃ 5s,72℃ 15s,共35个循环;72℃延伸10min。之后进行PCR产物的分离和回收。委托上海生工生物工程股份有限公司测序。
1.6 生物信息学分析
使用ORF finder在线工具进行基因开放阅读框的预测;蛋白质基本性质用Protparam(http://au.expasy.org/tools/protparam.html)预测;利用NCBI网站进行蛋白保守域预测;CFSSP(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白的二级结构;TMHMM2.0(http://www.cbs.dtu.dk/services/TMHMM/) 预测跨膜结构域;SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;LocTree3(https://rostlab.org/services/loctree3/)在线软件进行亚细胞定位分析;使用DNAMAN进行多物种间氨基酸序列的相似性比较;使用MEGA 5.0软件构建系统进化树,bootstrap检测设置重复为1000次。
2 结果与分析
2.1 花色苷物质的测定
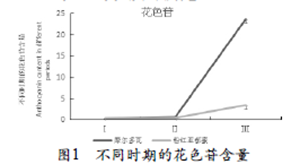
由图1可知,在果实转色发育过程中,绿熟期至半红期花色苷含量上升平缓,从半红期到红熟期花色苷含量则迅速上升。在红熟期,比‘摩尔多瓦’的含量明显高于‘粉红亚都蜜’。
2.2 花色苷合成相关基因荧光定量表达分析
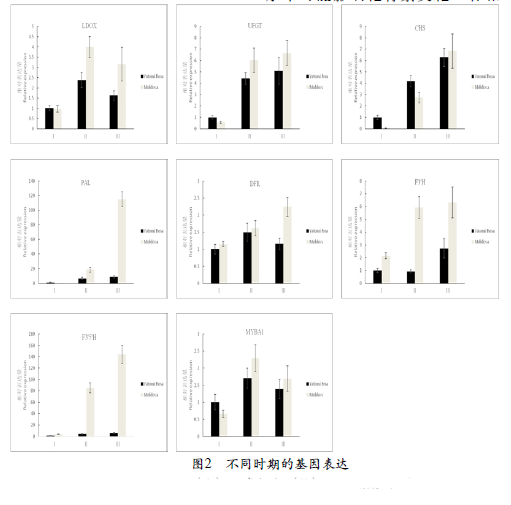
由图2可知,在果实转色发育过程中,花色苷合成相关基因均逐渐上调表达。其中,‘摩尔多瓦’各个基因红熟期的表达水平均高于‘粉红亚都蜜’。基因F3’5’H与PAL在‘摩尔多瓦’的表达水平明显高于‘粉红亚都蜜’,红熟期表达量分别差24.65倍、13.10倍,其余相关基因(LDOX、UFGT、CHS、PAL 、DFR、F 3 ’H、MYBA1)表达水平差异并不明显。F3’ H和F3’5’H的表达水平可能影响花青素类花色苷和花翠素类花色苷的含量和比率,
因此比对了两个基因红熟期的表达水平,发现‘粉红亚都蜜’的F3’H和F3’5’H的表达量比例约为1:2.14,而‘摩尔多瓦’比例仅仅为1:22.75,可见,‘摩尔多瓦’F3’5’H基因表现出更强的底物竞争优势。
2.3 葡萄F3’5’H的cDNA克隆及蛋白基本性质分析
以总RNA反转录的cDNA为模板,对‘粉红亚都蜜’与‘摩尔多瓦’的F3’5’H基因进行CDS全长克隆。F3’5’H基因cDNA扩增出一条1600bp的条带。经产物回收测序,‘粉红亚都蜜’获得了1663bp的序列, ‘ 摩尔多瓦’ 获得了1657bp的序列。经ORF分析表明,‘粉红亚都蜜’与‘摩尔多瓦’的 F3’5’H开放阅读框长度均为1527bp,编码508个氨基酸。
‘粉红亚都蜜’ F3’ 5 ’H蛋白的理论等电点( p I ) 为9.04,分子量为56.86,分子式为C2547H4061N699O718S28;‘摩尔多瓦’F3’5’H蛋白的理论等电点(pI)为9.07,分子量为57.00,分子式为C2562H4070N698O714S29。‘粉红亚都蜜’与‘摩尔多瓦’ F3’5’H蛋白的不稳定系数分别为37.22和37.44,表明其稳定性较好。脂肪指数则代表了蛋白质的热稳定性,‘粉红亚都蜜’与‘摩尔多瓦’ F3’5’H蛋白的脂肪指数分别为93.92和93.35。总平均亲水性(GRAVY)为负值时,说明该蛋白具有亲水性;GRAVY为正值时,说明该蛋白具有疏水性。

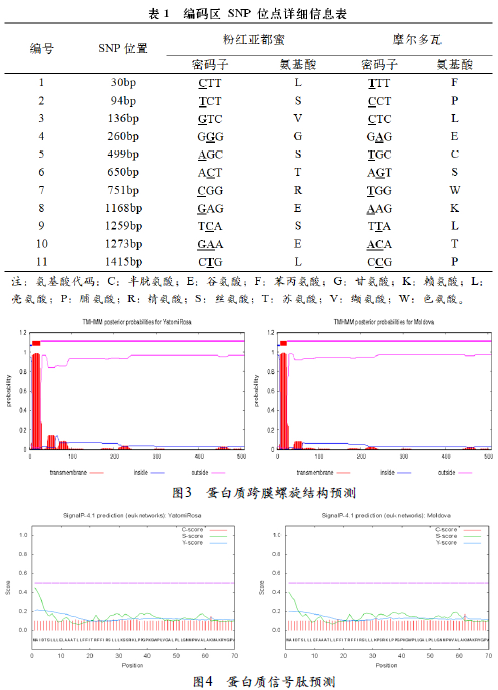


‘粉红亚都蜜’与‘摩尔多瓦’的F3’5’H蛋白的GRAVY分别为-0.066和-0.060,因此均为亲水蛋该基因匹配的蛋白保守区为细胞色素P450超基因家族,‘粉红亚都蜜’共匹配到491个氨基酸长度,为18-508个氨基酸;‘摩尔多瓦’共匹配到504个氨基酸长度,为5-508个氨基酸。用DNAMAN软件对ORF序列、氨基酸序列综合比对分析,在ORF序列上发现了23个SNP位点,其中同义突变11个,非同义突变12个(其中2个突变改变1个氨基酸),致使有11个氨基酸发生差异,这可能是导致蛋白质结构和功能发生改变的原因之一。
使用TMHMM 2.0在线软件预测‘粉红亚都蜜’和‘摩尔多瓦’F3’5’H蛋白的跨膜螺旋。结果如图所示,F3’5’H蛋白存在跨膜结构域,包含一个跨膜螺旋,其中,1-6个氨基酸在膜内,7-25个氨基酸为螺旋部分,而剩余的26-508个氨基酸在膜外(outside)。利用SignalP在线软件对‘粉红亚都蜜’与‘摩尔多瓦’ F3’5’H基因的信号肽进行分析预测,发现均不含有信号肽序列,推测该蛋白不是分泌蛋白。进一步利用LocTree3在线软件进行亚细胞定位分析,结果显示该蛋白很可能定位于内质网膜,预期精度为84%。CFSSP预测蛋白的二级结构表明,两个品种均以α-螺旋(41.92%)与不规则卷曲(53.08%)为主要结构原件,还有少量延伸链(5%)结构。
2.4 蛋白序列比对及其进化分析
用MEGA 5.0软件对氨基酸序列与其他植物的氨基酸序列进行多序列比对,绘制分子进化图。结果表明,葡萄属之间,‘粉红亚都蜜’与欧亚种葡萄亲缘性近,与刺葡萄、山葡萄较远。‘摩尔多瓦’并未与欧亚种葡萄、山葡萄、刺葡萄聚为一类,而是单独聚为一类,表明其遗传背景较为复杂。葡萄属外,‘粉红亚都蜜’与‘摩尔多瓦’与仙客来、茶树在进化关系上较近,与麻风树、天鹅绒豆亲缘关系较远。
3 讨论
葡萄花色苷的含量受多种因素的影响,但不同品种的花色苷组成和相对含量主要由遗传因素决定。本研究结果表明在果实转色发育过程中,花色苷合成相关基因均逐渐上调表达。然而,基因F3’5’H与PAL在‘摩尔多瓦’的表达水平明显高于‘粉红亚都蜜’,其余相关基因(LDOX、UFGT、CHS、PAL、DFR、F3’H、MYBA1)表达水平差异并不明显。可见F3’5’H与PAL可能是影响葡萄品种果皮颜色差异的主要因素。类黄酮3’5’-羟化酶是葡萄花色苷生物合成中的关键酶之一。F3’ H和F3’5’H的表达水平可能影响花青素类花色苷和花翠素类花色苷的含量和比率。本研究中比对了不同品种两个基因红熟期的表达水平,发现‘粉红亚都蜜’的F3’H和F3’5’H的表达量比例约为1:2.14,而‘摩尔多瓦’比例仅仅为1:22.75,可见,‘摩尔多瓦’F3’5’H基因表现出更强的底物竞争优势,与前人研究结果一致。
同时,本研究比对分析了两个品种的’F3’5’H基因的开放阅读框。在ORF序列上发现了23个SNP位点,其中同义突变11个,非同义突变12个(其中2个突变改变1个氨基酸),致使有11个氨基酸发生差异,这可能是导致蛋白质结构和功能发生改变的原因之一。