病毒病防控岗位
任芳 董雅凤 张尊平 范旭东 胡国君 张梦妍
葡萄病毒A (Grapevine virusA,GVA)是葡萄皱木复合病重要病原之一,已在全世界多个国家和地区普遍发生。目前国内还没有GVA市售抗血清,对其检测主要应用RT-PCR方法,但其在灵敏度和检测范围上还存在一定不足,在检测病毒含量低的植株或某些季节和部位葡萄样品时,存在无法检出的情况。实时荧光定量RT-PCR(RTqPCR)检测技术具有特异性强、灵敏度高、检测范围广、重复性好以及可定量等优点,目前在果树病毒检测中得到广泛研究和应用,其灵敏度普遍达常规RT-PCR的100倍以上,具有很好的应用前景。本实验室建立了GVA的染料法实时荧光定量RT-PCR检测技术,经检测验证,其特异性强、灵敏度高、检测适用范围广。现将主要操作步骤总结如下,以期为GVA的高效、准确检测提供一种可靠的技术手段,还为检测取样时间及部位提供选择依据。
1 提取总RNA
采用吸附柱法进行总RNA提取:(1)取葡萄样品约50 mg(取样时选择成熟叶柄、叶片或枝条韧皮部等部位检测效果最佳),放入塑料袋中,加入1 mL提取液研磨;匀浆转入事先加入NLS的离心管中,70℃保温10分钟,冰上放置5分钟,13000 rpm,离心15分钟;(2)取上清液600uL,加入300uL无水乙醇,颠倒混匀45秒,混合液加入吸附柱中,12000rpm离心1分钟,弃掉废液;(3)加入700uL去蛋白液,室温放置2分钟,12000rpm离心1分钟,弃掉废液;(4)加入700uL清洗液,12000rpm离心1分钟,弃掉废液;再加入500uL清洗液,12000rpm离心1分钟,弃掉废液;将吸附柱放回空收集管中,12000rpm离心2分钟,弃掉废液;(5)取出吸附柱,放入新的离心管中,加50 Μl DEPC水,室温放置1分钟,12000rpm离心1分钟,所得RNA溶液–70℃超低温保存备用。
2 反转录合成cDNA
反转录体系25.0μL:将5.0μL总RNA与1.0μL 0.1μg/μL随机引物和9.0μL水混合,95℃变性5min后立即置于冰中冷却2min;加入5.0μL 5×MLV-RT buffer、1.25μL10mM dNTPs、0.5μL 200U/μLM-MLV和3.25μL DEPC水,经37℃10min、42℃ 50min、70℃5min合成cDNA,–20℃保存备用。
3 实时荧光定量RT-PCR检测GVA
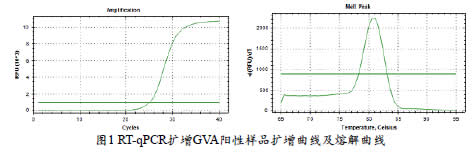
采用GVA特异性引物QA2F/QA2R(QA2F:5’-CGACCGAACTATGTACCTGAATACTC-3’;QA2R:5’-GACCTACTATATCTACCTC-3’)进行检测,反应体系25μL,包含:2×SYBR GreenⅠqPCR Mix12.5μL、10μmol•L-1 正、反向引物各0.5μL、DNase/RNase FreedH2O 10.5μL 和cDNA 1μL。将反应体系置于荧光定量PCR仪,设置反应条件:95℃预变性3min,95℃15s,60℃15s,72℃ 20s,40个循环,在延伸步骤记录荧光信号。熔解曲线分析温度范围从60- 95℃,其中每5s 增加温度0.5℃,以鉴别引物二聚体和非特异性扩增。扩增程序结束,观察扩增曲线Cq值(扩增产物荧光信号达到设定的阈值所经过的扩增循环次数)和熔解曲线,以扩增曲线Cq值<30且熔解曲线为单一峰判定为阳性,如图1所示。
4 实时荧光定量RT-PCR验证及应用
采用感染不同病毒的田间葡萄样品以及不同季节和不同部位的样品对该RT-qPCR方法进行检测验证,结果表明该方法特异性强,仅对感染GVA的葡萄样品检测为阳性,感染其余病毒的葡萄样品为阴性,检测灵敏度高,可检测1×10-4稀释倍数的样品cDNA,是普通RT-PCR的100倍。检测适用范围广,可在各个季节实现对GVA的快速准确检测,春、夏、秋季的老叶柄和冬季枝条样品检出率均可达到100%,其次为老叶,检出率可达87%,各季节和部位样品检出率比常规RT-PCR提高了10~38%。根据不同季节不同部位样品的检测结果,除冬季葡萄休眠枝条外,老叶柄检测效果最佳,其次为老叶,不同季节间比较以秋冬季检测效果更佳,秋季除嫩叶外其余部位检测效果均较好。