酿酒微生物岗位
刘延琳
1 果酒及其有机酸
如今,果酒被越来越多的人饮用,
包括葡萄酒、苹果酒、樱桃酒、猕猴桃酒(Budak, 2016;Wang and Peng, 2017)以及一些浆果类果酒,如蓝莓酒、草莓酒(Hornedoortega
et al., 2017)及热带水果、亚热带水果果酒,如菠萝、芒果、甜瓜和香蕉等(Dias et al.,2017)。
不同果酒果实原料不同、酿造方式不同以及储藏方式的不同都会不同程度地影响果酒的质量,评价一款果酒质量的好坏,尚未有一个确切的标准,但很多研究学者习惯用一些理化指标及有关化学成分含量分析进行评定(Dias et al., 2017)。例如,果酒香气状况通常通过测定其酯类物质、醇类物质及萜烯类物质(Liu et al., 2015)等的含量来进行评价;果酒平衡度通常通过测定其酒度、糖酸比等理化指标进行评价,其中,有机酸是影响果酒质量一个非常重要的因素。在各种果酒中,适量的酸度可以很好地平衡甜味和苦味,但过量的酸则会出现酒味酸涩、酒体粗糙等现象(文连奎等, 2010)。
果酒中的酸主要来源于两部分,一部分来源于水果本身的有机酸,如苹果酸、柠檬酸、酒石酸等(张方艳等, 2014)。一部分来源果汁发酵过程中产生的酸,如乳酸、琥珀酸、乙酸等。其中,水果本身所含的酸对果汁的发酵过程及果果酒中的有机酸及酵母降酸研究进展酒的质量、口感有着非常重要的影响。不同水果有机酸含量不同(表1)。其中,猕猴桃、西番莲、酸石榴以及柑橘类水果是柠檬酸含量较多的种类,樱桃、山葡萄是苹果酸含量较多的水果。
(1)猕猴桃有机酸
猕猴桃是我国主要的鲜食水果,广泛种植于我国四川、陕西、河南、河北等地。由于其较高的营养价值 (Calıskan et al., 2015),被冠以“水果之王”称号(Huang et
al.,2013)。研究者发现,猕猴桃果实中含有丰富的维生素C和抗氧化物质,如叶黄素、类胡萝卜素、花青素、酚类物质和黄酮类物质(Kayaet al., 2010; Ma et al., 2017)。维生素C又名抗坏血酸,具有多种功效(Kaya
et al., 2010),可增强人体免疫力,促进人体胶原蛋白合成和胆固醇排泄,具有防止牙龈萎缩,动脉硬化等功能,是人体不可缺少的营养成分。猕猴桃由于其丰富的营养价值,广泛受到人们的喜爱。
猕猴桃果酒是人们食用猕猴桃的主要方式(López et al., 2012; Towanet al., 2011)。不同种类猕猴桃酿造猕猴桃果酒质量不同,其中,果实本身有机酸含量是影响猕猴桃果酒品质好坏一个很重要的因素(Chenget al., 2004)。不同种类的猕猴桃有机酸含量不同,总体来讲,猕猴桃中总酸含量占0.9% ~ 2.5 %,其中,柠檬酸含量占40% ~ 50 %,主要位于猕猴桃内果皮,奎宁酸含量占40% ~ 50 %,主要位于猕猴桃外果皮,剩余10 %左右的为苹果酸(Marsh et al., 2004)。在猕猴桃中,柠檬酸含量明显高于苹果酸(Jin etal., 2012),因此,柠檬酸是影响猕猴桃果酒酸味的主要有机酸。除此之外,柠檬酸含量在一定程度上也会影响猕猴桃果酒的香气,有报道显示,猕猴桃果酒清爽的香气特征主要来源于柠檬酸(Cheng et al.,2004)。由此可见,柠檬酸含量是影响猕猴桃果酒品质重要因素。
(2)山葡萄有机酸
山葡萄生长于我国东北地区,
是我国主要的野生葡萄品种,可耐-40℃低温(Pedastsaar etal., 2014),富含花青素等多种抗氧化物质(Li et
al., 2016; Ma et al.,2017)。山葡萄酿造的葡萄酒,酒体澄清透明呈宝石红色,香气浓郁,深受消费者的喜爱(Zhao et al.,2016)。但山葡萄酸含量较高,容易造成酒体不平衡等缺点,因此,降酸技术研究是保证山葡萄酒品质的重要方法之一。研究显示,苹果酸和酒石酸是山葡萄主要的有机酸,不同品种山葡萄,其有机酸含量不同。
2 果酒降酸技术研究
化学降酸法、物理降酸法(Veraet al. 2003)和微生物降酸法是果酒降酸的主要方法,其中,微生物降酸法是果酒降酸处理中应用较多的降酸技术。
(1)降酸酵母菌研究进展
早期研究显示,粟酒裂殖酵母(Schizosaccharomyces pombe)具有一定的降酸效果,Benito et
al ( 2015)比较分析S. pombe与苹果酸—乳酸发酵(MLF)对发酵葡萄酒中苹果酸的降解效果,结果显示,S. pombe单独发酵与酿酒酵母酒精发酵结束后再进行MLF相比,二者的降酸效果相差不大,即S. p omb e也表现出很好的降酸效果。为了增强S. pombe的降酸能力,研究者利用细胞质体融合技术将初始菌株,即S. pombe,进行紫外线诱变处理,从中筛选降解苹果酸能力较强的菌株进行细胞质体融合,通过溴甲酚绿测定融合菌株的降酸效果,选取降酸效果较强的菌株继续融合。最终筛选出一株降酸效果相比原始菌株提高了225.2%的菌株(Ding et al., 2015)。
除S. p omb e外,其他非酿酒酵母也具有降酸能力。美极梅奇酵母(Metschnikowia pulcherr ima)、戴尔有孢圆酵母(Torulaspora
delbruec)、毕赤克鲁维酵母(Pichia kluyveri)、耐热克鲁维酵母(K l u y v e r o m yc e st h e r m o t o l e r a n s )对苹果酸均有不同程度的降解效果。其中, K.thermotolerans用于发酵榴莲汁,可将5.68 g/L的苹果酸降低到2.06 g/L,降酸效果达63.73 %,其他三种酵母降酸效果差别不大,都处于30% ~ 40 %之间。且发酵完成时,K . t he r m ot o l er a n s产生的醋酸含量最低(Lu et al.,
2015)。此外, K.thermotolerans产生更多的2-苯基乙醇、丙酸苯乙酯、水杨酸乙酯和水杨酸甲酯等,其中,丙酸苯乙酯能够产生玫瑰香气(Beckner et al.,2015)。
将C a n d i d a d i v e r s a 、季也蒙有孢汉逊酵母(H a n s e
n i a s p o r ag u i l l i e rm o ndii)、葡萄汁有孢汉逊酵母(H a n s e
n i a s p or a u var u m)、仙人掌有孢汉逊酵母(H a n s e n i a s p o r aopuntiae)、克鲁维毕赤酵母(Pichiakudriavzevii)、陆生伊萨酵母(Pichiate
r r i c o l a)、Sta r me re l l a ba cilla ris、拜耳结合酵母(Z y g o s a c
c h ar o m y c e sbailii)、Zygosaccharomyces bisporus和Zygoascus hellenicus
10个菌种单独发酵葡萄汁。结果显示,酒精发酵结束后,P. terricola和Z. bailii发酵葡萄酒中苹果酸含量最低,与对照菌株酿酒酵母(Saccharomyces cerevisiae)2.1 g/L相比,分别降低了0.53
g/L和0.4 g/L。分析测定其他成分,两者相比S.cerevisiae,挥发酸含量都有不同程度的降低,其中S.cerevisiae为0.78 g/L,P. terricola为0.42 g/L,Z. bailii为0.68 g/L。进行感官评价分析,P.terricola口感上呈现出更多的甜味,但柔和感不强,而Z. bailii口感上平衡感较好(Teixeira et al., 2015)。
(2)酵母有机酸代谢
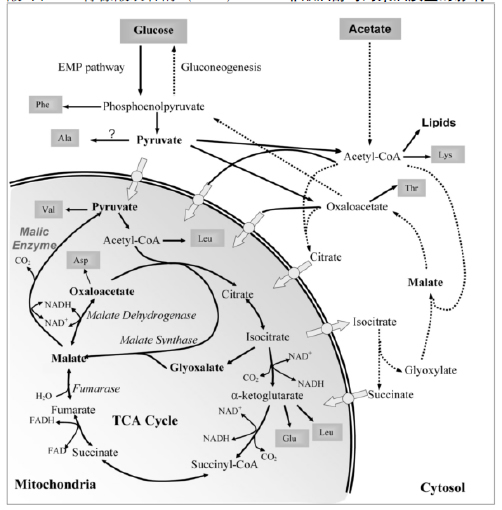
三羧酸(TCA)循环是酵母有机酸代谢的主要途径(Huynen et al.,1999)。TCA循环起始于丙酮酸,丙酮酸在丙酮酸脱氢酶系的作用下脱羧形成乙酰辅酶A(Ac-CoA),与线粒体中的草酰乙酸(OAA)在柠檬酸合酶(CS)的作用下缩合为柠檬酸(Xiao et al., 2014)(图1)。柠檬酸合成后在顺乌头酸酶(Aco)的催化作用下生成中间产物顺乌头酸,继而转变为异柠檬酸,此过程为双向进行。顺乌头酸酶可催化中间产物顺乌头酸形成柠檬酸和异柠檬酸。随后,异柠檬酸经过异柠檬酸脱氢酶的作用生成α-酮戊二酸,接着在α-酮戊二酸脱氢酶催化下形成琥珀酰-CoA和CO2。琥珀酰-CoA在琥珀酰-CoA合成酶作用下形成琥珀酸。琥珀酸随后在琥珀酰脱氢酶、延胡索酸酶(FUM)和苹果酸脱氢酶的作用下生成OAA。
除此之外,
乙醛酸支路(Glyoxylate shunt)是酵母有机酸代谢的另一途径。柠檬酸在顺乌头酸酶作用下转化为异柠檬酸,异柠檬酸在异柠檬酸裂解酶(ICL)的作用下生成琥珀酸和乙醛酸(图1)。其中,琥珀酸可转移到线粒体进入TCA循环,乙醛酸和乙酰辅酶A在苹果酸合酶作用下生成苹果酸。苹果酸在苹果酸脱氢酶作用下生成草酰乙酸。在葡萄糖存在时,酿酒酵母的乙醛酸通路中位于细胞质中的酶不表达,受到葡萄糖的抑制,且位于线粒体中的苹果酸脱氢酶也受到抑制(Maaheimo et al.,2001)。此外,在细胞质中,柠檬酸可在ATP柠檬酸裂合酶(ACL)的催化作用下,将柠檬酸裂解为Ac-CoA和OAA。研究显示,若敲除解脂椰氏酵母(Yarrowia lipolytica) A C L 1基因,会导致柠檬酸含量升高,复制ICL基因,会降低异柠檬酸含量(Liu et al., 2013)。
研究发现(Rezaei et al., 2015)敲除ACO1基因会影响酵母菌体的生长及发酵性能,抑制柠檬酸转化为异柠檬酸,降低琥珀酸的含量。敲除IDH1(依赖于NAD+的异柠檬酸脱氢酶)和IDP 1(依赖于NADP+的异柠檬酸脱氢酶)会延长菌株生长对数期,降低琥珀酸的含量,增加甘油的产量。KGD1(α-酮戊二酸脱氢酶)的缺失会降低琥珀酸的含量,但不影响柠檬酸、苹果酸和延胡索酸。
3 非酿酒酵母对果酒质量的影响
自然发酵并不是单一菌种的发酵,其发酵菌种不仅包括酿酒酵母,也包括非酿酒酵母,非酿酒酵母群体在自然发酵前期占据的比例远远超过酿酒酵母(Li et al., 2011;Wang and Liu, 2013)。非酿酒酵母最初是从腐坏葡萄酒中分离出来的,因此也被认为是葡萄酒中的败坏菌种(Jolly et al., 2014)。但近年来,随着研究者们对非酿酒酵母的深入探讨及酿酒工作者对葡萄酒酿酒工艺的实践研究,非酿酒酵母的应用价值得到越来越多的认可(Comitini et al., 2011; Dashko et al.,2015)。
非酿酒酵母大致可分为两种类型,即有性型和无性型。此外,有一些菌种介于有性型和无性型之间,这类菌种在一定条件下可以产生子囊孢子,但后期随着时间的推移,其产子囊孢子能力逐渐消失,因此被称为兼性型(Jolly et al., 2014)
(1)
有孢汉逊酵母属
有孢汉逊酵母属(H a n s e n i a s p o r a ) 主要包括H .u v a r um、葡萄酒有孢汉逊酵母(H
.v i n e a e)、季也蒙有孢汉逊酵母(H. gui lliermond ii)和H. oc ci dent a lis 等。有孢汉逊酵母主要通过两端出芽方式进行营养生殖(López et al.,2014),是酿酒环境中的主要菌属(Grangeteau et al., 2015, 2016)。
H. uvarum 是有孢汉逊酵母属中主要菌种,含8.08 ~
9.08 Mb基因组,位于8 ~ 9条染色体上(Masneufet al., 2016),通常具有较低的发酵能力。Sun et al. (2014)研究发现, H. uvarum是果皮的主要菌种,主要集中在果酒发酵起始阶段,占总菌数的50 % ~ 70 %。在Maturano et al.(2015)研究中显示,在14 ± 1℃冷浸渍酿造工艺中,H. uvarum仍是主要的非酿酒酵母。通常情况下,非酿酒酵母被认为是酒精耐受性较低的菌种(Grangeteau et al., 2015)。在酒精发酵过程中,随着酒精含量的积累,有孢汉逊酵母的生长受到抑制,菌群数量逐渐降低。但有研究者发现,酒精含量的积累并不是有孢汉逊酵母数量减少的关键原因。
将H. uvarum单独接种到酒精含量不同的培养基中,结果显示,随着酒精含量的增加,H. uvarum的数量逐渐较少,但减少幅度不大,远远低于与s. cerevisiae混合发酵。因此,他们H. uvarum数量的减少主要是酵母菌种间相互作用的结果(Wang et al.,2015)。此外,有研究学者认为,H.uvarum在酒精发酵过程中数量的减少主要是由SO2引起的,Grangeteauet al. (2016)在葡萄汁中加入30 mg/L SO2,结果显示,加入SO2后,H.u var um数量急剧降低,在发酵24
h后,H. u va r um只占总菌数的1 %。
相反,在Hong(2013) 研究中,H .u v ar u m可耐500 mg/L的焦亚硫酸钾,远远高于果酒酿造过程中添加的SO2的浓度,且发酵结束后,酒精度达到11.8 %(v/v)。同一菌种的不同菌株之间存在较大的差异,不同菌株耐受性不同,对环境的适应力不同,H. uvarum数量的减少并不是单一因素作用的结果。此外, H. uvarum具有低产H2S、乙酸,高产甘油等特性(De et al., 2011),对葡萄酒质量有着重要的影响。
葡萄酒有孢汉逊酵母(H .vineae)是汉逊酵母中研究相对较多的菌种,含11.4 Mb基因组,分布在5条染色体上(Masneuf et al., 2016)。在发酵过程中,随着发酵的进行,S. cerevisiae数量的增多,H. vineae 活菌数目逐渐减少。通常H. vineae发酵能力较弱,产酒精速度较慢,且菌生长速率较慢。但有研究发现,氨基酸可促进H. vineae转运蛋白的合成,提高H. vineae发酵能力(Gonzálezet al., 2015)。
有孢汉逊酵母是果酒中数量最多的非酿酒酵母,其产生的挥发性物质对果酒香气有着重要的影响。H. uvarum是混合发酵中应用较多的菌种,在对数生长期能够产生胞外酶β-葡萄糖苷酶和β-木糖苷酶,增加葡萄酒中萜烯类物质的含量,增加2-苯基乙醇、松油醇含量,赋予果酒更多的香气特征 (Lópezet al., 2014, 2015, 2016)。在实际果酒酿造过程中,H. uvarum酿造的果酒评分较高。Hong
et al. (2013)用H. uvarum发酵美洲葡萄康贝尔早生(Campbell Early)获得的葡萄酒感官评价高于酿酒酵母。在多瑞加葡萄汁中,H. uvarum使葡萄酒产生浓郁的干果类香气(Teixeira etal., 2015),提升了葡萄酒的品质。此外,将H. uvarum与S. cerevisiae混合发酵可降低葡萄酒中挥发酸含量(Tristezza et al., 2016)。但有研究发现,H. uvarum在氧气含量充足条件下,能产生更多的挥发酸,降低葡萄酒的质量(Albertin et al., 2014)。
综合分析H . u v a r u m对葡萄酒质量的影响得出,在适当的条件下,H. uvarum更多的会提升葡萄酒的品质,可作为葡萄酒质量提升的潜在菌株,但有关H. uvarum的生产应用还需做进一步的研究。
H. vineae是马卡贝奥(Macabeo)葡萄汁中的主要菌种,是目前与S . ce r e visi a e混合发酵较多的菌种。在酿造过程中,H . vin eae可以产生更多的乙酸苯乙酯、苯甲醇和乙酸苄酯,赋予葡萄酒更加复杂的香气特征(Lleixà et al., 2016; Martin etal., 2016)。Martin et al. (2016)研究发现,H. v in
e a e通过扁桃酸盐途径产生苯环型化合物,增加苄基和对苄基醇的含量,赋予葡萄酒的更加浓郁的酵母香气。除此之外,将H.vineae与S. cerevis iae混合发酵可增加葡萄酒中乙酸乙酯、乙酸异戊酯和2-苯基乙酸乙酯的含量,使葡萄酒产生香蕉、蜂蜜、玫瑰等愉悦风味(González et al., 2015)。
(2)毕赤酵母属
毕赤酵母属(Pichia)是包含菌种较多的非酿酒酵母,多数菌种以有性生殖方式进行繁殖,包括克鲁维毕赤酵母(P. kluyveri)、发酵毕赤酵母(P. fermentans)、膜噗毕赤酵母(P. membranifaciens)和季也蒙毕赤酵母(P. guilliermondii)等。不同毕赤菌种具有不同的生长特性。
P. membranifaciens基因组大小为11.58
Mb。分布于2 ~ 8个染色体上,在有性生殖过程中,只产生四孢子形态。P. anomala基因组大小为26.55 Mb,分布于6条染色体上,可产生一到四个子囊孢子(Masneufet al., 2016)。Santos et al. (2009)研究发现,P. membranifaciens能够生成毒素物质PMKT 2抑制B. bruxellensis 等其他败坏酵母菌株的生长。相反,P. anomala在高酸、低pH、高渗透压和厌氧条件下,具有较强的生长能力,常常被认为是败坏菌株(Passoth et al., 2006)。P. guilliermondii 通常被认为具有较强的发酵能力,其糖消耗速率仅次于S. cerevisiae,对发酵进程有显著的影响(Ciolfi et al.,2015)。
毕赤酵母属中,大多数酵母菌种能产生糖苷酶,提升葡萄酒的品质。P. guilliermondii能产生α-L-鼠李糖苷酶,水解鼠李糖与其他物质之间的糖苷键,增加果酒中萜醇和高级醇含量(Rodriguez et al., 2010)。P. anomala能够产生β-葡萄糖苷酶,加快糖苷键的水解,提高葡萄酒中挥发性物质含量(Swangkeaw et al.,2011),且发酵过程中,随着葡萄糖含量下降,酒精浓度的上升, P. anomala中β-葡萄糖苷酶活性得到增强,为葡萄酒品质的提升提供了更多的可能。有研究发现有些毕赤酵母会影响葡萄酒中挥发性物质成分,降低葡萄酒的质量。在Ciolfi etal. (2015)研究结果中显示大量的P.guilliermondii会抑制S. cerevisiae生长,导致发酵迟缓,严重时可致使发酵停止,且发酵过程中会生产一些副产物,影响发酵进程。
(3)伊萨酵母属
伊萨酵母属(I s satch enki a sp .)也有学者将其归为毕赤酵母,主要包括东方伊萨酵母(I s s a t c h e n k i aorientalis,I. orientalis)和陆生伊萨酵母(Issatchenkia
terricola,I. terricola)。有研究显示I. orientalis具有较强的降酸能力,在以苹果酸为唯一碳源的培养基(0.17 %YNB,2 %苹果酸,0.5 %硫酸铵)上,其降酸效果达到95.5 %(Seo et al., 2007),将I. oriental is与酿酒酵母按1:1、1:4和4:1进行混合发酵葡萄酒,结果显示,当I. orientalis 与S. cerevisiae接种量之比为1:1时,发酵速率较快,发酵结束后,苹果酸含量较低,酒评分最高(Kim et al., 2008)。在酵母分类学上,I. orientalis也被成为Pichiakudriavzevii,属于Pichia sp.。Gallardoet al. (2011)对I. orientalis的生长特性进行研究,发现I. orientalis具有耐高温特性,其最适酒精发酵温度为42℃,且其产生酒精速率较快。
伊萨酵母属(I s sa tche n k ia s p .)除I. orientalis外,I.
terricola也具有一定的降酸特性,王立芳等(2010)研究结果显示,I. te r ri co la对12 g/L的L-苹果酸和柠檬酸的降解率分别达到93.17 %和92.08 %,最适生长pH值为2.0 ~ 2.5。
文连奎等人( 2011)研究发现,I. terricola耐受SO2最大浓度为450 mg/L、体积分数5 %的酒精,对质量浓度为8 ~ 20 g/L的L-苹果酸和质量浓度为8 ~ 12 g/L的柠檬酸降解率均达90%以上。I. terricola是陆生毕赤酵母(Pichia terricola)的兼性型(Jolly et al., 2014),亦可属于Pichia sp.。I. terricola可产生β-葡萄糖苷酶,提取I. terricola细胞外的β-葡萄糖苷酶,将其固定在环氧活化树脂上,会增加萜烯类物质,增强葡萄酒香气复杂度。且与其他非酿酒酵母相比,I. terricola产生的β-葡萄糖苷酶酒精耐受性18 %(v/v)更好(González et al., 2011)。