蓝靛果哈尔滨综合试验站
霍俊伟
碳量子点(Carbon Dots, CDs)是一类尺寸小于 10 nm、由碳核和丰富表面官能团组成的新型零维荧光纳米材料,最早于 2004 年在纯化碳纳米管时被意外发现。近年来在植物生长调控、光合作用效率提升以及作物产量增加等方面的研究逐渐增多。CDs 的优异光学性能、环境友好性、 良好的生物相容性以及纳米尺度的特性,使其在农业领域展现了巨大的潜力。尤其是在植物光合作用的促进方面,越来越多的研究表明,CDs 能够促进植物健康生长和提高植物的光合效率,显著影响植物果实的发育、品质和抗病性。
在全球气候变化和环境问题日益严峻的今天,资源的高效利用与环境保护成为了当代科学研究的核心议题之一。蓝靛果具备极高的营养和医疗保健价值拥有极大的开发利用潜能。随着蓝靛果的种植规模逐渐扩大,如何促进其生长,提高其产量成为了农业生产中的一项关键挑战。与此同时,蓝靛果的落叶数量庞大,尤其是在秋冬季节,大量的落叶作为废弃物被简单处理或焚烧,不仅浪费了可再生资源,还可能对环境造成污染。因此,如何将这些生物废弃物转化为高附加值的材料,不仅具有生态环保意义,也为实现绿色经济提供了新路径。
本研究利用蓝靛果的落叶制备 CDs,不仅可以实现废弃物的资源化利用,减少对环境的负面影响,并且为 CDs 的低成本、大规模生产提供了可能性。利用这些 CDs 促进了蓝靛果的生长发育,提高了果实的产量和质量,但其促进生长和提高果实产量的机制尚不清除。本研究不仅探索了一种绿色可持续的农业废弃物处理方式,也为现代农业中作物生长的调控提供了新的技术手段。符合当今社会对绿色发展和循环经济的需求,为解决农业生产中的环境问题和提升作物生产效率提供了新的思路。
1. 材料与方法
1.1 试验材料与处理
选择蓝靛果品种‘乌蓝’作为试验材料,将成熟的蓝靛果果实在纱布中揉搓并用水清洗,除去种子表面的附着物。挑选籽粒饱满无破损的种子,将种子放在有潮湿纱布的培养皿上萌发,期间保持纱布湿润,光周期 12 h/12 h。种子萌发后,将幼苗移栽到装有营养土的育苗盒中,每周浇一次水。一个月后,选取长势一致的幼苗进行处理,共 5 个处理,每个处理重复 12 株苗。用去离子水配置不同浓度(100、300、500、1000 mg/L)的碳量子点(CDs)溶液并以等量的去离子水作为对照(CK),每 3 d 喷施一次叶片,共喷 3 次。处理完成后,取样并测定蓝靛果幼苗的生理指标。
试验选择的蓝靛果扦插苗为 2 年生‘乌蓝’品种,选取无病虫害,长势良好且一致的将其移栽至盆里,2 d 浇一次水,共 6 个处理,每个处理重复 9 株,共 54 株苗。用去离子水配置不同浓度(100、300、500、1000、3000 mg/L)的 CDs 溶液并以等量的去离子水作为对照(CK),每 5 d 喷施一次叶片,共喷 6 次。每株植物喷施的溶液量为 50 mL,喷施时确保叶片表面达到充分的淋洗效果。喷施时喷雾均匀覆盖叶面,直至溶液开始滴落。处理完成后,取样并测定蓝靛果扦插苗的生理指标及光合作用参数。
选取东北农业大学蓝靛果种质资源圃中的多年生蓝靛果‘乌蓝’品种植株,共两个处理,每个处理选取生长势一致、无病虫害的 5 株植株作为试验对象。用去离子水配置 1000mg/L 的 CDs 溶液并以等量的去离子水作为对照(CK),自果实膨大期开始,采用全株叶面喷施法,每 5 d 喷施一次,共喷施 6 次。每次喷施量为每株 150 mL,喷施时确保所有叶片及果实表面均匀覆盖,直到叶面出现轻微滴水现象。此外,在果实成熟期,进行 13C 同位素标记试验,并采集果实样本,随机选择植株上的果实,避免选择病虫害果实或形态异常的果实,保存于 -20℃ 冰箱中,测定其品质指标,以探讨 CDs 处理对果实品质的影响。
1.2 试验方法
1.2.1 碳量子点的制备
取 0.5 g 干燥的蓝靛果叶片粉末,加入 75 mL 蒸馏水于烧杯中,超声溶解 30min 直至溶液充分混合。将悬浮液转至 100 mL 聚四氟乙烯反应釜内,在 200°C 条件下加热 10 h,反应结束后将反应釜冷却至室温,得到 CDs 粗产物。将粗产物以 10000 rmp 转速离心 30 min,提取上清液,用 0.22 μm 滤膜进行抽滤,去除大颗粒,使用透析袋(1000 Da)透析 24 h,去除小分子颗粒。之后冷冻干燥得到 CDs 粉末,并在 4°C 条件下储存。
1.2.2 碳量子点的表征
采用透射电子显微镜(Transmission Electron Microscope, TEM)(JEOL JEM2200FS,日本)观察 CDs 的形貌特征并测定其粒径分布,测试条件为加速电压 200 kV,样品经超声分散后滴加于铜网表面,室温干燥后进行观测。使用荧光分光光度计(F-280,天津港东科技股份有限公司,中国)测定 CDs 的光致发光(Photoluminescence, PL)光谱,测试参数设置为激发波长范围 300-600 nm,发射波长范围 350-700 nm。采用傅里叶变换红外光谱仪(Nicolet iS20 FTIR Spectrometer,Thermo Fisher Scientific,美国)对 CDs 进行傅里叶变换红外光谱(Fourier Transform Infrared Spectroscopy, FTIR)分析。使用 X 射线光电子能谱仪(ESCALAB 250Xi Spectrometer,Thermo Scientific,美国)进行 X 射线光电子能谱(X-ray Photoelectron Spectroscopy, XPS)分析。采用 X 射线衍射仪(Bruker D8 Advance,德国)对 CDs 进行 X 射线衍射(X-ray Diffraction, XRD)分析。使用生物透射电子显微镜(Hitachi H-7650,日本)观察 CDs 在蓝靛果叶片组织中的定位与分布情况。
1.2.3 测定指标
1.2.3.1 生理指标测定
根系长度测定:采用直尺法测定根系长度,选取生长健壮、形态完整的根系,从根颈处至最长根尖进行测量。
植株高度测定:采用直尺法测定幼苗高度,从基质表面至幼苗顶端生长点进行测量。采用卷尺法测定扦插苗高度,从土壤表面至最高分枝顶端进行测量。
茎粗测定:使用游标卡尺测定茎粗,在距基质表面 1 cm 处测量茎秆直径,每个样品测量 3 次取平均值。
干重和鲜重测定:将植株用蒸馏水冲洗干净,滤纸吸干表面水分后立即称量鲜重。随后将样品置于烘箱中 105℃ 杀青 30 min,调整至 75℃ 烘干至恒重,冷却后称量干重。所有称量操作均使用电子分析天平进行,每个样品重复测定 3 次。
1.2.3.2 光合参数测定
光合特性指标测定:采用 Li-6400 型便携式光合测定仪(Li-Cor6400,美国)进行光合特性指标测定。测定指标包括净光合速率(Pn)、气孔导度(Gs)、胞间 CO2 浓度(Ci)和蒸腾速率(E)。测定时间为晴朗无风的早晨 5:00-7:00,设定光强为 1000 μmol·m-2·s-1。每个处理选取 3 株生长一致的幼苗,每株选取 3 片生长健壮、叶位一致的完全展开叶进行测定,每个叶片重复测定 3 次,取平均值作为最终测定结果。
叶绿素荧光参数测定:采用 Handy PEA plus 便携式植物效率分析仪(Hansatech Instruments Ltd.,英国)进行叶绿素荧光参数测定。选取蓝靛果扦插苗健康、完全展开的功能叶进行测定。每个处理随机选取 3 株幼苗,每株测定 3 片叶,每个叶片重复测定 3 次,每个处理共计获得 9 个测定值。测定前将叶片暗适应 20 min,使光系统 II(PSII)达到氧化还原平衡状态。
Rubisco 酶活性测定:取对照和 CDs 处理(100 、300 、500 、1000 mg/L)的蓝靛果扦插苗叶片,经液氮磨成粉末后,称取 0.2 g 样品,加 1 mL 提取介质,置冰浴上研磨匀浆,转移于离心管中,4℃下 10000 g 离心 10 min,上清液即为粗酶液。取 20 μL 粗酶液,加入 7 μL 磷酸甘油酸激酶溶液和 7 μL 甘油醛-3-磷酸脱氢酶溶液,再加入 180 μL 反应工作液,混匀后在 340 nm 波长下记录 1 min 和 6 min 时的吸光度,记为 A1、A2,计算 ΔA测定=A1-A2。空白管用蒸馏水代替上清液,与测定管同时测定,吸光值分别记为 A3、A4,ΔA空白=A3-A4。ΔA=ΔA测定-ΔA空白。单位定义:25℃中每 g 组织每分钟氧化 1 nmol NADH 为一个酶活力单位。
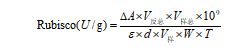
式中:
V 反总—反应体系总体积,0.214 mL;
ε—NADH 摩尔消光系数,6.22×103 L/mol/cm;
d—96 孔板光径,1 cm;
V 样—加入样本体积,0.02 mL;
V 样总—加入提取液体积,1 mL;
T—反应时间,5 min;
W—样品鲜重,g;
109—单位换算,1 mol = 109 nmol
1.2.3.3 果实品质测定
单果重测定:每个处理随机选取 3 株植株,每株随机选取 10 个果实,使用电子分析天平测定单果质量;抗坏血酸(ASA)含量、花色苷含量、总酚含量、类黄酮含量测定均使用植物类测试盒(酶联生物技术有限公司,上海,中国),使用酶标仪进行测定。
1.2.3.4 蔗糖含量测定
选取经 1000 mg/L CDs 处理的叶片及对照(CK)叶片作为测定材料。采用高效液相色谱仪(1260 Infinity II Prime,Agilent,美国)测定叶片蔗糖含量。具体试验步骤如下:
样品前处理:将新鲜叶片样品迅速置于液氮中速冻,随后使用研钵研磨成均匀粉末。准确称取 0.3 g 样品粉末,转移至 10 mL 离心管中。加入 5 mL 80%乙醇溶液,充分混匀后置于 85 ℃水浴锅中提取 30 min,期间每隔 10 min 取出振荡混匀。12000 rpm 离心 10 min,收集上清液至新的 10 mL 离心管中。向沉淀中加入 5 mL 80%乙醇溶液,重复上述提取步骤一次。合并两次提取的上清液,使用真空浓缩仪干燥去除溶剂。干燥后的样品用 200 μL 超纯水复溶,经 0.22 μm 微孔滤膜过滤后备用。
色谱分析条件:色谱柱为 Aminex® HPX-87C 糖分析柱(300 mm × 7.8 mm,Bio- Rad,美国),柱温 85℃。流动相为超纯水,流速 0.6 mL/min。检测器为示差折光检测器(RID),进样量 10 μL。每个处理设置 3 次生物学重复,每个样品测定 3 次技术重复。以蔗糖标准品制作标准曲线,根据保留时间定性,外标法定量。
1.2.3.5 蔗糖磷酸合成酶(SPS)活性测定
采用蔗糖磷酸合成酶(Sucrose Phosphate Synthase, SPS)活性测定试剂盒(索莱宝科技有限公司,北京,中国)进行测定。
1.2.4 13C 同位素标记
采用 1000 mg/L CDs 对植株进行喷施处理,对照(CK)为等量的去离子水。每个处理选取 3 个生长健壮、长势一致的结果枝,每个结果枝选取 15 个幼果作为试验果,于幼果期进行 CDs 溶液处理,每 5 天处理一次,共处理 3 次。在处理完成后,于 8:00 进行 13C 同位素标记试验,使用透光率为 95% 的透明塑料薄膜制作标记室,将小风扇、还原性铁粉及喷施 CDs 溶液的叶片包裹其中,确保标记室气密性良好;对结果枝基部进行环剥处理,并对伤口进行密封包扎;使用注射器向装有 1.0 g Ba13CO3(13C 丰度 98%)的离心管中缓慢加入 1 mol·L-1 HCl溶液,每隔 30 min 补充一次盐酸,确保 Ba13CO3 完全反应并维持 13CO2 浓度稳定,标记过程持续 4 h;在距离标记植株足够远处(确保不受 13C 污染)选取 3 株植株作为空白对照。标记 3 天后进行样品采集,将结果枝各部位依次用清水、洗涤剂、1% 盐酸清洗,最后用去离子水冲洗 3 次,样品经 105℃ 杀青 0.5 h 后,70℃ 烘干至恒重,使用电动磨样机将样品磨碎,过 60 目筛,混匀后装袋备用。采用同位素比率质谱仪(DELTA V Advantage,赛默飞世尔科技公司,美国)测定 δ 13C 值。
13C 丰度(%):
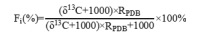
式中:Fi 为器官 13C 丰度(%);RPDB 为碳同位素的标准比值,其值为 0.0112372。
各器官中 13C 的量(mg):
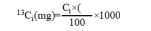
式中:Ci 为各器官所含的碳量(g);ΔF 表示同化前后叶片的 13C 丰度差:ΔF=Fi-Fnl。其中,Fi 和 Fnl 分别为标记株和未标记株的 13C 丰度(%)。
1.2.5 蓝靛果栽培土壤分析
1.2.5.1 土壤酶活性测定
分别收集 CK 和 1000 mg/LCDs 处理过的扦插苗的土壤样品,保存至 -80°C 冰箱中,待测。
(1)β-葡萄糖苷酶活性的测定:样品在干冰上研磨并过 1 mm 筛,称取 0.02 g,加入 10 μL 甲苯混匀后,室温静置 15 min,加入 200 μL 醋酸缓冲溶液和 160 μL 对-硝基苯-β-D 吡喃葡萄糖苷溶液,混匀,37℃ 水浴 3 h 后,立即沸水浴煮沸 5 min,流水冷却(对照管用蒸馏水代替底物)。10000 g 常温离心 10 min,取上清液待测。吸取待测液 100 μL,加入 200 μL 氢氧化钠溶液,充分混匀,室温静置 5 min 后,取上清测定 400 nm 下的吸光值 A。吸光值分别记为 A测定、A对照。计算 ΔA测定=A测定-A对照,每个测定管设一个对照管。将 5 mmol/L 的对硝基苯酚溶液用蒸馏水稀释为 100、80、40、10、8、6、4、2、1 μmol/L 的梯度溶液,与待测液同时测定,并用蒸馏水作为空白,于 400 nm 下读取吸光值,记为 A标准、A空白。ΔA标准=A标准-A空白。根据浓度与吸光值 ΔA标准的关系绘制标准曲线。单位的定义:每天每 g 土样中产生 1 μmol 对-硝基苯酚定义为一个酶活力单位。
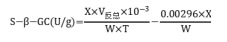
式中:
x—将 ΔA测定带入标准曲线计算出对硝基苯酚浓度 x,μmol/L;
T—反应时间,3 h=1/8 d;
V 反总—反应体系总体积,0.37 mL;
10-3—单位换算,1 mL=10-3 L;
W—样本质量,g。
(2)碱性磷酸酶活性的测定:样品在干冰上研磨并过 1 mm 筛,称取约 0.05 g,加入 25 μL 甲苯,充分浸润后轻摇 15 分钟,再加入 0.2 mL 0.5%磷酸苯二钠,摇匀后,置于 37℃ 恒温培养箱,开始计时,催化反应 24 h,到时间后迅速加入 0.5 mL 0.3%硫酸铝充分混匀,以终止酶催化的反应。8000 rpm,25℃离心 10 min,取上清液置于冰上待测。
测定管:取 96 孔板,加入 10μL 上清液,20 μL pH = 9.4 硼酸盐缓冲溶液,4 μL 氯代二溴对苯醌亚胺试剂,充分混匀,显色后再加蒸馏水 166 μL,混匀后室温静置 30 min,于 660 nm 测定吸光度,记为 A测定。
空白管:取 96 孔板,加入 10 μL 0.5%磷酸苯二钠,20 μL pH = 9.4 硼酸盐缓冲溶液,4 μL氯代二溴对苯醌亚胺试剂,充分混匀,显色后再加蒸馏水 166 μL,混匀后室温静置 30 min,于 660 nm 测定吸光度,记为 A空白。
标准管:取 96 孔板,加入 10 μL 标准液,20 μL pH = 9.4 硼酸盐缓冲溶液,4 μL 氯代二溴对苯醌亚胺试剂,充分混匀,显色后再加蒸馏水 166 μL,混匀后室温静置 30 min,于 660 nm 测定吸光度,记为 A标准。
空白管和标准管只需做 1-2 次。
活性单位定义:37℃中每克土壤每天释放 1 μmol 酚为 1 个酶活单位。
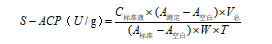
式中:
C标准液—0.5 μmol/mL;
V总—催化体系总体积,0.725 mL;
W—土壤样本质量,g;
T—催化反应时间,24 h = 1 d。
(2)β-N-乙酰氨基葡萄糖苷酶活性的测定:样品在干冰上研磨并过 1 mm 筛,称取约0.05 g,加入 237.5 μL pH 5.0 柠檬酸-磷酸氢二钠缓冲溶液和 62.5 μL 对硝基苯-N-乙酰-β-D-氨基葡萄糖苷溶液,混匀,37℃ 恒温培养 3 h 后,立即沸水浴 5 min,冰浴冷却,12000 g、25℃ 离心 10 min,取上清液待测。取待测液 100 μL,加入 200 μL 0.5% NaOH 溶液,室温静置 2 min 后,10000 g 常温离心 5 min,吸取 200 μL 上清于直接在 96 孔板中,测定 400 nm 处的吸光值 A测定。对照管 37℃水浴后再加入 62.5 μL 对硝基苯-N-乙酰-β-D-氨基葡萄糖苷溶液,其他步骤同测定管,吸光值记为 A对照。单位的定义:每天每 g 土样中产生 1 μmol 对硝基苯酚定义为一个酶活力单位。
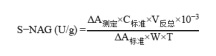
式中:
ΔA测定 = A测定-A对照
ΔA标准 = A标准-A空白
T—反应时间,3 h = 1/8 d;
V反总—反应体系总体积:0.3 mL;
C标准—标准溶液浓度,100 μmol/L;
10-3—单位换算,1 mL=10-3 L;
W—样本质量,g。
(3)亮氨酸氨基肽酶活性的测定:样品在干冰上研磨并过 1 mm 筛,称取约 0.05 g,加入 25 μL 甲苯混匀后,室温静置 15 min,加入 425 μL Tris-HCl 缓冲溶液和 50 μL L-亮氨酸对硝基苯胺溶液,混匀,30℃ 水浴 3 h 后,立即沸水浴煮沸 5 min,流水冷却(对照管先沸水浴后再加 L-亮氨酸对硝基苯胺溶液)。10000 g 常温离心 10 min,吸取 200 μL 上清液测定 405 nm 下的吸光值 A。单位的定义:每天每 g 土样产生 1 μmol 对-硝基苯酚定义为一个酶活力单位。
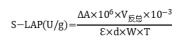
式中:
ε—对硝基苯胺摩尔消光系数:9.87×103 L/mol/cm;
d—比色皿光径,0.5 cm;
V反总—反应总体积,0.5 mL;
10-3—单位换算,1 mL = 10-3 L;
T—反应时间,3 h = 1/8 d;
106—1 mol=106 μmol;
W—样本质量,g。
1.2.5.2 土壤微生物多样性
采用 TGuide S96 磁珠法土壤/粪便基因组 DNA 提取试剂盒(天根生化科技,北京,中国)提取土壤总基因组 DNA,并通过引物扩增细菌 16S rRNA 基因 V3-V4 区。PCR 产物经琼脂糖凝胶电泳验证后,使用 Omega DNA 纯化试剂盒(Omega Inc.,美国)纯化,并于 Illumina Novaseq 6000 平台(美国)进行双端测序(2×250 bp)。原始数据经质控后,基于 USEARCH (v10.0)对相似度≥97% 的序列进行 OTU 聚类,并利用 QIIME2 结合 SILVA 数据库(v138.1)进行物种注释(置信度阈值 70%)。通过计算 Shannon 和 Chao1 指数评估 α 多样性,采用主坐标分析(PCoA,Bray-Curtis 距离)表征 β 多样性。组间差异通过单因素方差分析(ANOVA)及 LEfSe 分析(LDA score > 3.0)进行统计学检验,数据可视化通过 BMKCloud 平台(www.biocloud.net)完成。
2 结果与分析
2.1 碳量子点的表征
2.1.1 碳量子点的制备
在本研究中,CDs 是利用蓝靛果的废弃落叶研磨成粉末后通过水热法制备获得的,图 1 为 CDs 的制备方法示意图。CDs 溶液在室内光线下为浅黄色透明溶液,在 365 nm 紫外灯照射下发出蓝色荧光。

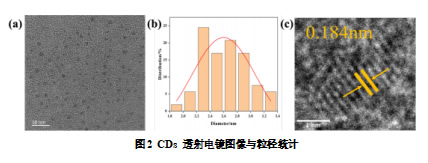
2.1.2 碳量子点的透射电镜图像
如图 2a 的 TEM 分析显示,所制备的 CDs 具有均匀的球形或近球形结构,粒径分布均匀,直径小于 5 nm,平均直径为 2.6 nm(图 2b)且具有良好的分散性和清晰的晶格,晶格间距为 0.184 nm(图 2c),符合纳米粒子的一般特征。TEM 图像揭示了这些 CDs 的良好分散性,这对于其与植物细胞的相互作用具有重要意义。
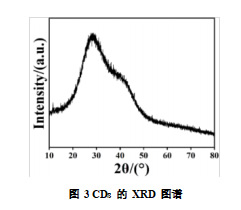
2.1.3 碳量子点的 X 射线衍射(XRD)
为了鉴定 CDs 材料的晶型,对 CDs 进行 XRD 分析,如图 3 所示。XRD 分析表明,所制备的 CDs 主要呈现无定形结构,在 XRD 图谱中 28.79。处显示出一个宽广的衍射峰,位于 2θ 约为 20-30°的范围内。这一结果表明,制备过程中的 CDs 未形成明显的结晶结构,而是表现出非晶态特征。
2.1.4 碳量子点的紫外可见吸收光谱(UV-Vis)和光致发光光谱(PL)
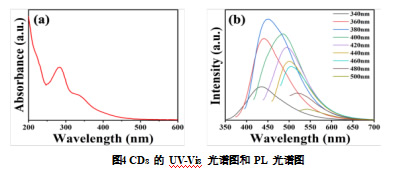
为了进一步了解 CDs 的光物理性质,进行了紫外可见光谱测定和光致发光 PL 分析。如图 4a 所示,紫外可见光谱在 283 nm 处有一个突出的吸收峰,表明合成材料具有特有的光学性质。PL 分析则进一步揭示了 CDs 的光学特性。PL 光谱显示,CDs 的最大激发波长为 380 nm 在此激发波长下的最大发射峰为 450 nm。CDs 在不同激发波长下的发射光谱如图所示,当激发波长改变,CDs 的荧光发射峰位置也随之改变,并且强度也发生改变表明荧光发射具有激发依赖性(图 4b),证明了表面态的发光机制。结果表明其具备优异的光学性能,这使得 CDs 在植物体内的吸收和生物活性更具优势。
2.1.5 碳量子点的傅立叶变换红外光谱(FTIR)
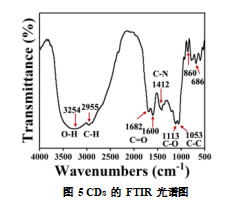
利用傅立叶变换红外光谱仪进一步测定了 CDs 的化学成分。如图 5 的 FTIR 分析显示,CDs 表面含有丰富的官能团,如羟基(-OH)、羧基(-COOH)、醇类(-OH)等,这些官能团的存在增强了 CDs 的亲水性和生物相容性。FTIR 光谱显示,在 3100-3500 cm-1 处观察到有特征吸收峰,这是由于 O-H 和 N-H 的拉伸震动产生的。在 2955 cm-1 处的吸收峰归因于 C-H 的吸收。而 1600-1700 cm-1 处的吸收峰则代表着 CDs 表面有 C=O 的存在。此外,1412 、1113 和 1053 cm-1 处的峰分别对应于 C-N 、C-O 和 C-C 的伸缩振动。这些吸收峰指示了 CDs 表面存在的多种功能基团,这些官能团可能增强 CDs 与植物细胞表面的亲和力,从而促进其吸收与作用。
2.1.6 碳量子点的 X 射线光电子能谱(XPS)
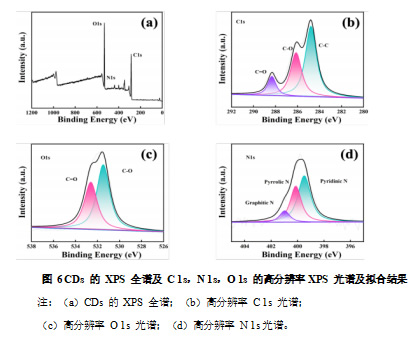
XPS 分析进一步揭示了 CDs 的元素组成和表面化学状态。如图 6a 的 XPS 谱图显示,CDs 主要由 C(284.58 eV,At%=63.23)、O(531.44 eV,At%=33.43)和少量 N(399.4 eV,At% = 3.34)元素组成。C1s 光谱显示(图 6b),CDs 中有 C=O(288.3 eV)、C-O(286.1 eV)和 C-C(284.8 eV)存在。O1s 光谱(图 6c)可以拟合到 532.6 eV 和 531.5 eV 两个峰,分别是 C=O 和 C-O,表明 CDs 表面富含氧元素,主要为醇基、醚基和羧基等含氧基团,这些官能团有助于提高 CDs 的水溶性和生物相容性。N1s 光谱(图 6 d)涉及到三个峰分别是 Graphitic N(401 eV)、Pyrrolic N(400.1 eV)和 Pyridinic N(399.5 eV),进一步证实了少量氮掺杂的存在,可能增强了 CDs 在水溶液中的稳定性。
2.2 碳量子点对蓝靛果生长发育及光合特性的影响
为探究 CDs 对蓝靛果生长发育的影响,本研究以蓝靛果幼苗和扦插苗为试验材料,分别采用不同浓度的 CDs 溶液进行处理,并观察其生长情况。
2.2.1 碳量子点对蓝靛果幼苗生长发育的影响
以蓝靛果种子幼苗为研究对象,采用 0、100、300、500、1000 mg/L CDs 进行叶面喷施处理。试验结果表明,与对照组相比,CDs 处理能够促进幼苗的生长,且表现出浓度依赖性。如图 7a 所示,随着 CDs 浓度的增加,幼苗的植株高度明显提高,叶片面积增大,叶片数量增加,同时根系长度增长,根毛更加密集。其中,1000 mg/L CDs 处理的促进效果最为显著,根长增加 2.6 倍(260.3%)(图 7b),干重和鲜重分别提升 7.7 倍(766.8%)(图 7c)和 3.4 倍(342.2%)(图 7d),苗高较对照组增加 3.11 倍(311.1%)(图 7e)。这些结果表明,适宜浓度的 CDs 能够显著增强蓝靛果幼苗的生长势,提高其地上部分和地下部分的生物量积累。
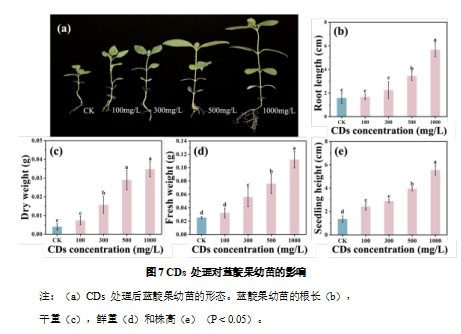
2.2.2 碳量子点对蓝靛果扦插苗生长发育的影响
以蓝靛果扦插苗为研究对象,采用 100、300、500、1000、3000 mg/L CDs 溶液处理,观察其生长表现。如图 8a 显示,在 100-1000 mg/L 的浓度范围内,CDs 能够促进蓝靛果扦插苗的生长,并且随着 CDs 浓度的升高,促进效果逐渐增强。各处理组的植株高度均高于对照组,其中,1000 mg/L CDs 处理的促进作用最为显著。具体表现为,扦插苗的茎粗较对照组增加 38.31%(图 8b),干重提升 72.67%(图 8c),鲜重提高 79.81%(图 8d),株高增加 55.36%(图 8e),表明 CDs 处理能够促进扦插苗的生物量积累,加快生长速率。
然而,当 CDs 浓度提高至 3000 mg/L 时,虽也显著促进了蓝靛果扦插苗的生长,与对照组相比茎粗增加 19.81%,干重提升 40.12%,鲜重提高 19.77%,株高增加 24.91%。但与 1000 mg/L 的 CDs 溶液处理相比,扦插苗的茎粗减少 15.41%、干重减少 54.72%,鲜重减少 50.16%、株高降低 24.39%。
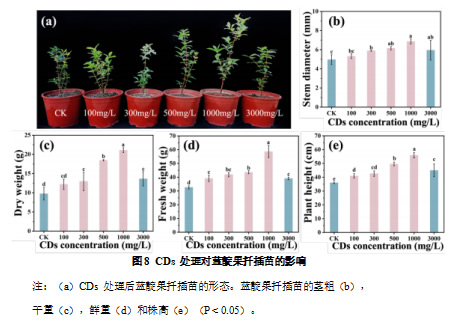
2.2.3 碳量子点对蓝靛果光合作用的影响
植物的生长发育在很大程度上依赖于光合作用,而净光合速率(Pn)、蒸腾速率(E)、气孔导度(Gs)以及细胞间 CO₂ 浓度(Ci)是衡量植物光合能力的重要生理参数。为了探究 CDs 是否通过调节光合作用促进蓝靛果的生长,本研究测定了不同浓度 CDs 处理后蓝靛果的光合参数变化,并进一步分析了其碳固定能力。
如图 9a 所示,CDs 能够显著提高蓝靛果的 Pn,并表现出浓度依赖性。在 100–1000 mg/L的处理浓度范围内,Pn 随 CDs 浓度的增加而升高,其中 1000 mg/L CDs 处理的促进作用最为显著,使 Pn 较对照组提高了 60.4%。进一步分析发现,与对照组相比,CDs 处理显著提高了蓝靛果的 E 和 Gs,两者的变化趋势与 Pn 保持一致,均随 CDs 浓度的增加而升高,且 1000 mg/L CDs 处理的促进作用最为显著。与对照组相比,E 提高了 45.12%(图 9b),Gs 增加了 40.61%(图 9c)。并且这一结果表明,CDs 可能通过促进气孔开放,提高气体交换能力,增强水分蒸腾,从而提高光合效率。然而,Ci 略有下降(图 9d),表明叶片对 CO₂ 的吸收与利用效率得到了增强,从而支持更高的光合速率。
进一步探讨 CDs 对植物碳固定过程的影响,本研究测定了 Rubisco 酶活性。结果显示,CDs 处理显著提高了 Rubisco 酶的活性。与对照组相比,100 mg/L、500 mg/L和 1000 mg/L CDs 处理分别使 Rubisco 酶活性提高了 170.99%、449.6%和 208.12%,其中 500 mg/L CDs 处理的促进作用最显著(图 9e)。
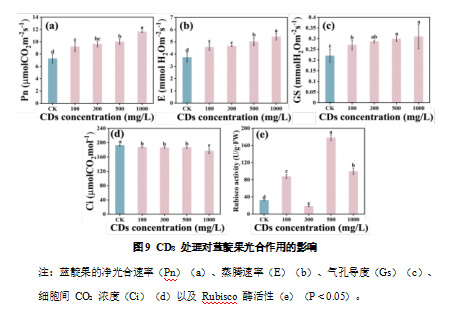
2.2.4 碳量子点对蓝靛果叶绿素荧光参数的影响
为了进一步探究 CDs 对蓝靛果光合作用的影响,本研究测定了不同浓度 CDs 处理后叶片的叶绿素荧光参数,包括最大光化学量子效率(Fv/Fm)、初始荧光(Fo)、实际光合量子产量(Y(II))、电子传递速率(ETR)及非光化学猝灭(NPQ),以评估 PSII 的功能状态和光能利用效率。
试验结果显示,Fv/Fm 值受 CDs 处理影响不显著。在所有处理组中,Fv/Fm 值均维持在约 0.8,与对照组无显著差异,表明 CDs 处理未对 PSII 系统造成损伤,也未引发明显的光氧化胁迫(图 10a)。Fo 值在 300 、1000 和 3000 mg/L CDs 处理后略有下降,但差异未达到显著性水平(图 10b)。Fo 值的轻微下降反映出 PSII 电子传递能力的提升,意味着 CDs 处理可能有助于促进 PSII 的光能转换效率,从而提高光合系统的稳定性与高效性。如图 10c所示,Y(II)值在 CDs 处理后显著提高,且呈现浓度依赖性。在 1000 mg/LCDs 处理下,Y(II)的提升最为明显,较对照组显著提高了 29.85%,表明该浓度的 CDs 能够最大限度地提高光能的实际利用效率。而在 3000 mg/L CDs 处理下,尽管 Y(II)较对照组增加了 14.03%,但与1000 mg/L 组相比却下降了 13.87%,表明过高浓度的 CDs 可能会对 PSII 的光化学活性产生一定的不良影响,导致电子传递效率趋于平稳甚至略有下降。如图 10d 所示,ETR 值在 CDs处理后显著提高,且 1000 mg/L CDs 处理组表现最优,与对照组相比显著提高了 29.85%。然而,3000 mg/L CDs 处理的 ETR 值虽然较对照组增加了 14.03%,但与 1000 mg/L 处理组相比降低了 13.88%。这一结果与 Y(II) 的变化趋势一致,进一步表明适当浓度的 CDs 能够增强 PSII的电子传递能力,优化光合作用过程。
如图 10e 所示,NPQ 值在所有 CDs 处理组中均有所下降,其中 100、300、1000 和 3000 mg/L 的 NPQ 值分别下降了 26.07% 、16.56%、 30.91%和 42.69%。NPQ 值的降低通常意味着 PSII 电子传递效率的提升,从而减少光能的浪费,并提高光合过程中能量的利用率。
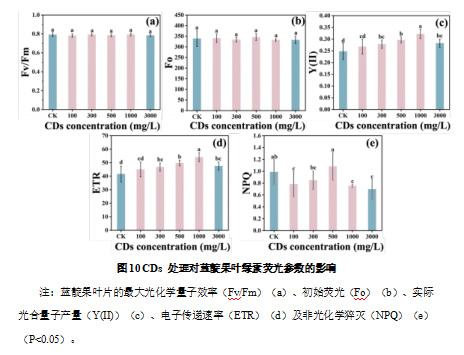
2.3 碳量子点在蓝靛果叶片中的观察
本研究利用透射电子显微镜对 CDs 处理过的蓝靛果叶片进行观察。结果表明,经过 CDs 处理后,蓝靛果叶片的超微结构发生了显著变化,CDs 成功进入了植物细胞,并且进一步进入了叶绿体这一关键的光合作用场所。如图 11 的生物透射电镜图像显示,CDs 可以通过叶肉细胞壁和细胞膜进入叶片细胞的细胞质。最吸引人的是,CDs 不仅停留在细胞质中,还成功进入了叶绿体(图 11c,d)。在叶绿体内部,CDs 主要集中在类囊体膜附近,推测其可能通过调节类囊体膜的功能,促进光合作用效率的提升。另外,试验中未观察到 CDs 对叶绿体结构造成任何明显的损害,说明 CDs 在进入叶绿体后,仍保持了较好的生物相容性。
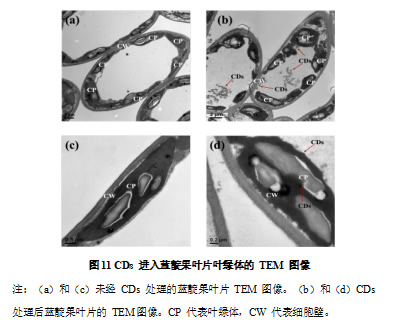
2.4 碳量子点对蓝靛果果实产量及品质的影响
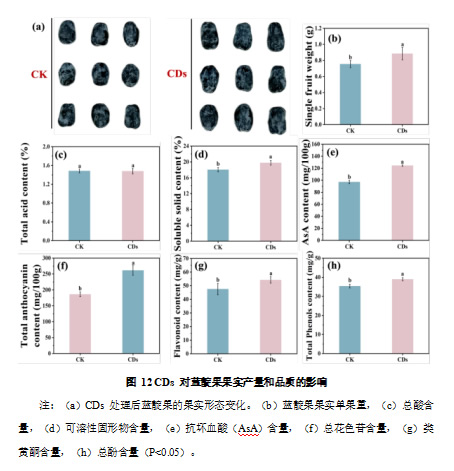
为探究 CDs 处理是否能够影响蓝靛果的果实大小及品质,本研究在幼果期对植株喷施1000 mg/L CDs 溶液,并测定其对果实生长及品质的影响。
如图 12a 所示,CDs 处理显著促进了蓝靛果果实的生长发育,使果实个体大小较对照组明显增大。单果重显著增加了 17.2%,达到 0.88 g(图 12b)。由于果实大小和重量通常与最终产量密切相关,因此推测 CDs 处理可能进一步提高蓝靛果的整体果实产量。在果实品质方面,可溶性固形物含量在 CDs 处理后显著提高,较对照组增加 9.6%(图 12d)。可溶性固形物主要包括糖类、酸类和其他风味物质,通常用于衡量果实的甜度。CDs 处理显著提高了蓝靛果果实中可溶性固形物含量,表明果实的甜度有所增强。而总酸含量未发生显著变化(图12c),这表明 CDs 处理可能通过提高糖酸比来增强果实的甜味,而非单纯降低果酸含量。此外,抗坏血酸(AsA)含量在 CDs 处理后显著提升,较对照组增加 28.07%(图 12e),表明 CDs 处理能够提高蓝靛果果实的营养价值。在次生代谢产物方面,CDs 处理显著提高了蓝靛果果实中花色苷、黄酮类化合物及总酚含量(图12 f, g, h)。与对照组相比,CDs 处理后果实中花色苷含量增加了 40.39%,黄酮含量增加了 14.04%,总酚含量提升了10.28%。花色苷、黄酮和总酚均为重要的抗氧化物质,在植物抗氧化防御系统中发挥关键作用,同时对果实的色泽、风味及保健功能具有重要影响。
2.4 碳量子点对蓝靛果叶片碳代谢及 13C 同化与分配的影响
2.4.1 碳量子点对蓝靛果叶片碳代谢及 13C 同化的影响
碳代谢是植物生长发育过程中至关重要的生理过程,而光合碳同化物的合成、 积累和分配直接决定了植物的营养供应和生长状况。本研究发现,与对照组(CK)相比,CDs 处理使叶片蔗糖含量提高了 25.99%,而光合碳代谢相关关键酶蔗糖磷酸合成酶(SPS)的活性则显著增强了 198.04%(表 1)。
为进一步探究 CDs 对蓝靛果叶片光合碳同化能力的影响,本研究采用 13C 同位素示踪技术来分析碳元素的固定及转运情况。结果表明,CDs 处理显著增强了蓝靛果叶片的 13C 同化能力(ΔF),其中 1000 mg/L CDs 处理使 ΔF 提高了 25%(表 1)。
此外,13C 示踪试验还分析了 CDs 处理对叶片光合产物的自留与输出比率的影响。研究发现,蓝靛果叶片的 13C 光合同化物均表现为自留比例高于输出比例,表明叶片优先满足自身生长和代谢需求后,再将剩余碳源向其他器官转运。对照组叶片中的光合同化物自留比例(标记叶片+标记枝条)为 89.65%,显著高于 CDs 处理组。而在 1000 mg/L CDs 处理后,光合同化物的输出比率显著提高,达到 17.63%(表 1)。进一步分析 CDs 处理对蓝靛果果实的 13C 吸收能力,试验发现,与对照组相比,1000 mg/L CDs 处理显著提高了果实的 13C 吸收量,为 18.15 mg/g,增加了 123.52%(表 1)。

2.5.2 碳量子点对蓝靛果叶片 13C 光合产物分配的影响
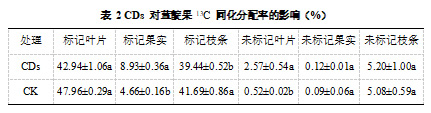
本研究通过 13C 同位素示踪技术分析了 CDs 处理对蓝靛果光合同化物在不同器官中的分配情况。结果表明,13C 同化物的主要分布部位为标记叶片和标记枝条,其次为标记果实,而其他器官的分配量相对较低。这一分配模式与不同器官对碳营养的吸收能力及其代谢活性密切相关。与对照组相比,CDs 处理降低了标记叶片和标记枝条中的 13C 分配率,而增加了其他器官的 13C 分配率。其中,经过 1000 mg/LCDs 处理后,13C 在标记果实中的分配率显著提高,达到 8.93%,提高了 91.63%(表 2)。
2.6 碳量子点对蓝靛果栽培土壤的影响
2.6.1 碳量子点对蓝靛果土壤酶活性的影响
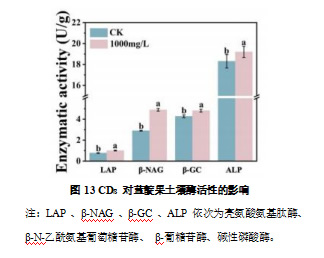
土壤酶活性是衡量土壤生物活性及其生态功能的重要指标,在养分循环和有机物分解过程中起关键作用。如图 13 所示,与对照组(CK)相比,CDs 处理显著提高了土壤中各类酶的活性。其中,LAP、 β-NAG 、β-GC 和 ALP 的活性分别提高了 30.7%、69.0%、12.6% 和 4.9%。LAP 与 β-NAG 均与土壤氮循环密切相关,其中 β-NAG 的活性增幅最大,表明 CDs 处理可能增强了土壤微生物对氮源的分解利用能力。β-GC 作为碳循环关键酶,其活性的提高反映了 CDs 处理对土壤有机碳分解过程的促进作用。
2.6.2 碳量子点对蓝靛果根际土壤微生物多样性的影响
2.6.2.1 测序数据评估
为了全面解析 CDs 对根际微生物群落的影响,本研究利用 Illumina NovaSeq 高通量测序技术,对 6 份根际土壤样本(两组试验处理)进行了 16S rRNA V3-V4 区测序。测序共获得479,623 条原始序列,在质量控制和去噪后,最终保留 330,051 条高质量序列。这些序列被归类为 12,808 个 OTUs,其中 CDs 处理组(CD)包含 8,671 个 OTUs,而对照组(CK)仅包含 7,854 个 OTUs。如图 14 的稀释曲线分析表明,随着测序深度的增加,曲线趋于平稳,表明本研究的测序数据已经充分覆盖了样本中的微生物多样性。
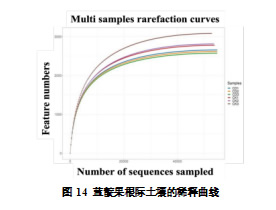
2.6.2.2 根际土壤微生物 Alpha 多样性分析
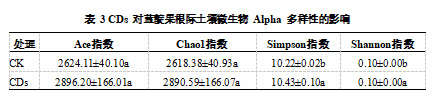
为进一步评估 CDs 处理对土壤微生物多样性的影响,本研究计算了 Alpha 多样性指数,包括 Ace 指数和 Chao1 指数(反映微生物物种丰富度)以及 Simpson 指数和 Shannon 指数(反映微生物物种多样性)。其中所有样本的覆盖率均在 99.9% 以上,表明本次测序结果代表了样本中微生物的真实情况。如表 3 所示,CDs 处理组(CDs)与对照组(CK)相比,Ace 指数和 Chao1 指数均有所提高,尽管 CDs 处理后这两项指数有所增加,但差异未达到显著水平(P > 0.05),表明 CDs 处理对土壤微生物群落的物种总数有所增加,但丰富度提升幅度有限。此外,Simpson 指数和 Shannon 指数均显著增加(P < 0.05)。
2.6.2.3 根际土壤微生物 Beta 多样性分析
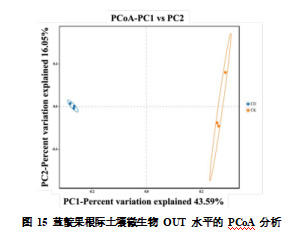
为进一步探讨 CDs 处理对根际土壤微生物群落结构的影响,本研究基于 OTU 水平进行了主坐标分析(PCoA)。如图 15 所示,PC1 和 PC2 分别解释了样本群落结构变异的 43.59% 和 16.05%。PC1 主导了样本间的主要变化趋势,对照组(CK)样本聚集在 PC1 轴的右侧,而 CDs 处理组(CD)样本则聚集在左侧,且两组样本之间的置信区间无重叠。这一结果表明,CDs 处理后,蓝靛果根际土壤微生物群落的组成发生了显著变化,与对照组相比形成了明显的分化。此外,CDs 处理组的样本聚类更紧密,表明该处理组内的群落结构较为稳定,变异性低于对照组。
2.6.2.4 根际土壤微生物群落组成分析
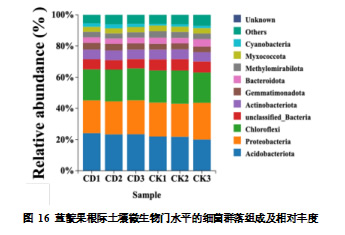
本研究基于 OTU 注释分析了蓝靛果根际土壤微生物的分类组成。如图 16 所示,所有样本共检测到 2 个界(Kingdom)、39 个门(Phylum)、102 个纲(Class)、291 个目(Order)、562 个科(Family)、965 个属(Genus)、1095 个种(Species)。在门(Phylum)水平,CDs处理显著影响了蓝靛果根际土壤细菌群落的组成。未施加 CDs 的对照组(CK)与施加 CDs 的试验组(CD)在菌群组成及相对丰度上均表现出明显差异。结果表明,酸杆菌门(Acidobacteriota)、变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)是蓝靛果根际土壤的优势菌群,占比最高。结合相对丰度热图,可以直观观察到两组样本之间的物种差异。根据热图上方的树状图可知,CK 组与 CDs 处理组(CD)不在同一子集中,表明两组间物种有差异,与 PCoA 的结果一致。CDs 处理后,酸杆菌门(Acidobacteriota)相对丰度显著提高。CDs 处理组(CD)中,酸杆菌门的相对丰度为 23.61%,较对照组(CK)的 21.25% 提高 了 2.36%。酸杆菌门在土壤碳循环和有机质积累与稳定方面具有重要作用,该菌群能够分解土壤有机物,释放养分,为其他微生物提供能量和养分,同时还能够调节土壤酸碱平衡,对土壤生态 系统 的 稳 定性起到积极作用。此外,芽单胞菌门(Gemmatimonadota)和蓝菌门(Cyanobacteria)在 CDs 处理后相对丰度也有所增加。
2.2.4 结论
随着环境与资源浪费问题的日益严峻,废弃物的资源化与高附加值利用成为解决生态问题的重要途径之一。本研究聚焦于利用蓝靛果落叶制备 CDs,并探索其在植物光合作用中的应用潜力。此外,本试验还探讨了关于 CDs 对蓝靛果生长发育、果实品质以及土壤酶活性和微生物群落的影响,得出以下结论:
(1)用蓝靛果落叶制成的 CDs 能够通过叶面喷施的方式进入叶片细胞的叶绿体内。
(2)CDs 能够作用在光系统 II 通过提高电子传递效率和 Rubisco 酶活性,从而提高了光合效率,促进蓝靛果的光合作用进而对其生长发育产生正面效果。尤其是用 1000mg/L CDs 处理对蓝靛果实生苗和扦插苗的生长的促进效果最显著。
(3)CDs 对叶片光合作用的促进能够合成较多的光合同化物(蔗糖),提高了蓝靛果叶片的同化力,为同化物向外输出提供了动力,有利于果实膨大期叶片光合同化物向果实的运输。因此,1000mg/L CDs 处理提高了蓝靛果果实大小和重量且果实中可溶性固形物、抗坏血酸、黄酮、花色苷和总酚的含量也提高了,进而改善了果实品质。
(4)栽培土壤酶活的测定和微生物群落多样性的分析结果表明,用蓝靛果落叶制成的 CDs 可以提高蓝靛果栽培土壤的酶活性和微生物群落丰度从而促进土壤中碳、氮和磷的循环和利用,有机质的降解还有养分的循环。