济南综合试验站
刘利 李勃
盐碱地是我国广泛分布的重要土地资源,总面积3.67×107 hm2,其中1.23×107 hm2 具有农业应用价值,主要分布在华北、西北和东北平原的低地或冲积扇的下部以及沿海地带。黄河三角洲(黄三角)地区属典型的滨海盐碱地,面积约890万亩,后备耕地资源丰富。充分利用盐碱地资源,遵循果树产业发展倡导“上山下滩,不与粮棉争田”这一基本原则。葡萄具有一定的耐盐碱能力,具有见效快、效益好等优势,开展盐碱地葡萄氮素研究对于助推黄三角葡萄矿质营养高效管理生产技术创新具有重要意义。
盐渍化土壤的离子成分主要包括Ca2+、Mg2+、Na+、Cl-、K+、SO42-、CO32-和NO3-等离子,土壤中盐的类型包括NaCl、Na2CO3、NaHCO3和Na2SO4[1]。盐碱地土壤盐分过多影响果树生长,并导致产量下降。盐胁迫对植物的伤害作用主要是通过渗透胁迫、离子毒害、营养失衡三个方面来实现的[2]。盐分影响养分运输和分布,形成竞争性吸收,从而造成植物营养失衡[3]。Na+与不同离子的相互作用已有大量报道,如Na+与Ca2+和K+相互作用[4],Na+抑制铵态氮的吸收[5],硝态氮营养可以调控水稻和油菜的木质部-韧皮部Na+和 K+离子浓度,提高其抗盐性[3]。
在16种必需营养元素中,氮是植物需求量最大的必需营养元素,也是限制植物生长和产量形成的首要因素。氮的同化过程包括吸收、转运和转化三个阶段,首先根系通过硝酸盐转运蛋白NRT1 与 NRT2 家族吸收的硝酸盐(NO3-)在硝酸还原酶(nitrate reductase, NR)的作用下还原为亚硝酸盐(NO2-)[6],NIA/NR 是编码NR的基因;然后亚硝酸还原酶(nitrite reductase,NiR)在细胞质中将亚硝酸盐(NO2-)还原为铵盐(NH4+),NIR是编码NiR的基因;根系吸收的铵盐(NH4+)通过转运蛋白吸收到植物细胞中;最后植物将吸收的氮通过谷氨酰胺合成酶(glutamine synthetase,GS)和谷氨酸合成酶(glutamate synthase,GOGAT)等酶合成氨基酸;GLNs/GSs和GLUs/GOGATs分别是编码GS和GOGAT的基因。盐胁迫对植物氮素营养状况的影响较为明显,盐分影响氮素在土壤里的周转过程[7],致使作物氮素吸收量和利用效率下降[8–9]。植物以NO3-和NH4+ 的形式吸收氮,在丛枝菌根的研究中发现,盐胁迫条件下通过固定NO3-和NH4+来影响两者的吸收[10–11]。当NO3-的吸收受到Cl-的挑战时,NH4+的吸收在膜上面临来自Na+的竞争。氯化钠竞争抑制硝酸铵的吸收,盐诱导的膜蛋白破坏改变了质膜完整性,也会影响NO3-和NH4+的吸收[12]。研究表明,盐胁迫影响水稻根系形态和根系活力以及氮代谢关键酶活性[13],然而水稻是典型的喜铵植物,果树是典型的喜硝植物,盐胁迫对两者的氮代谢机制有可能不一样。
高等植物的硝酸盐转运蛋白分为NRT1和NRT2家族,双亲和转运蛋白NRT1.1/NPF6.3作为NO3–的‘收发器’(转运蛋白和受体蛋白)能转运和感知NO3–,进而激发众多的生理变化来响应外界NO3–浓度的变化[14–15],这是植物吸收和分配NO3–的关键步骤,进而为提高NO3–的有效利用率奠定基础。在拟南芥中把NRT1.2基因敲除后,根部低亲和力系统转运NO3–的能力下降了50-70%[16]。拟南芥中NRT2.1和NRT2.2都是高亲和力的NO3–转运蛋白,饥饿处理后外施NO3–,NRT2.1基因的表达会在短时间内迅速上调。在小麦的研究中发现,氮饥饿处理后(2d、4d、6d和8d),小麦幼苗叶片中TaNRT1.1、TaNRT1.2、TaNRT1.7、TaNRT2.3和TaNRT2.4的表达均受到显著抑制[17]。盐处理显著诱导了玉米中NRT1.2、NRT1.11、NRT1.14A、NRT1.14B、NRT1.15A和NRT1.15B基因的表达,相反,NRT1.1和NRT2.4基因在4个时间点均显著下调[19]。盐处理显著诱导盐地碱蓬 NRT2.1基因的表达,从而增加根系和 叶片中 NO3–的积累[18]。以上结果表明盐处理对植物中NRT1和NRT2的表达影响不一致,可能与植物各自的氮吸收转运机制、盐处理的方式方法、植物的生长发育期不同有关。
植物 体内与 NR 相关的基因主要有 NIA1 和 NIA2 两个基因。在拟南芥突变体pap1-D/fls1ko和fls1ko中,NR活性和NIA1和NIA2表达水平的提高导致蛋白质和脯氨酸的合成增加,从而增加了抵抗盐胁迫的能力[20];另有研究发现拟南芥Ler型比Col-0型的NIA2的转录水平高,NR活性高,从而表现出更强的抵抗盐胁迫的能力[21]。Wang等[22]研究发现盐碱胁迫下(pH 9.0 和10.0)紫花苜蓿的NR和NiR活性下降,NIA和NIR基因的表达水平也下降,影响氮代谢过程。盐碱胁迫如何通过影响葡萄砧木幼苗中NIA和NIR的表达来调控NR和NiR活性进而影响NO3–的同化和利用有待进一步阐释。
目前,关于盐碱胁迫的研究在多种果树上已有报道[23–24],葡萄领域多集中在盐碱处理对葡萄砧木的表型、新梢生长量、根系叶片丙二醛含量和叶绿素形态结构含量、叶绿体荧光参数等生理指标以及糖、酸、香气等品质指标的影响[25–28],加上葡萄砧木根系结构与排盐之间的关系[29]。研究发现盐胁迫、碱胁迫和盐碱复合胁迫下的葡萄光合合成能力和光合速率下降,叶绿素含量和Rubisco活性降低,Na+和K+失衡,叶绿体超微结构老化,Fv/Fm降低,碱胁迫对葡萄的抑制作用大于盐胁迫[25-27];盐处理不利于果实香气的形成,中低浓度的盐有利于着色和糖酸积累,高盐则不利于品质形成[28],NaCl处理使得砧木1103P、110R和SO4的根组织密度和根平均直径下降,比根面积(speciffc root area,SRA)增加,增加了根系Na+和Cl-含量,降低了根系K+/Na+比值,SRA的增强与根组织密度和直径的降低可能通过减少从土壤中吸收盐分来改善葡萄的排盐性[29]。但关于盐碱处理对葡萄氮素吸收、同化和利用的机制尚未系统研究。
因此,本试验以葡萄砧木‘5BB’为材料,在沙培条件下模拟盐胁迫和盐碱复合胁迫,从葡萄砧木幼苗的生理指标、Na+/K+含量、氮代谢关键酶活性、氮素吸收利用率及氮素吸收同化相关基因的表达等方面,探究盐碱胁迫对葡萄砧木幼苗氮代谢和转运的影响,为生产上盐碱地葡萄氮肥的施用提供理论依据。
1 材料与方法
1.1 试验设计
供试材料为砧木品种‘5BB’,试验于2023年3月到6月在山东省农业科学院(北纬36°40 ′,东经117°4 ′)日光温室中进行,定植于23.00cm×21.50cm的黑色塑料花盆中,每盆栽种一株葡萄苗(共60盆),将珍珠岩和蛭石按1:1的比例混合装入花盆中。每隔一天浇水一次(浇透),每周施加一次改良版霍格兰营养液(N浓度为 9.30mmol/L),第一周先施加1/8改良版霍格兰营养液,第二周再施加1/4改良版霍格兰营养液,第三周及以后施加改良版全霍格兰营养液。
选取长势一致的植株27棵进行处理,试验设计三个处理,对照组(不添加盐碱),盐胁迫(添加浓度为0.20 mol/L的NaCl溶液),盐碱复合胁迫(添加比例为1:1的0.20 mol/L NaCl溶液、0.20 mol/L NaHCO3溶液)。待植株长到8~10片真叶时进行胁迫处理(2023年6月15日),处理时减少浇水量。每个处理选取3株长势一致的葡萄砧木幼苗,用0.020 mol/L K15NO3(上海化工研究院生产,丰度为10.20%)进行同位素标记处理,每株浇200ml,均匀地浇到每株葡萄砧木幼苗的根系周围 。
1.2 样品的采集与测定
处理14天后的植株用叶绿素仪测定叶绿素含量,并取样测定生物量、根系指标、氮含量、Na+、K+含量和15N利用率。剩余样品分为叶片和根系,洗净擦干后用锡纸包裹并立即放入液氮中冷冻,用于后续氮代谢酶活性等指标的测定。每个处理每个指标的测定分为三次生物学重复。
1.3 测定项目与方法
1.3.1 生物量、根系表型和叶绿素相对含量的测定
生物量的测定:将植株分为叶片、茎、主干和根部,洗净用吸水纸擦干后用千分之一天平称量其鲜重;将叶片、茎、主干和根部分别装入信封中,放入烘箱中105℃杀青40min,80℃烘干至恒重,用千分之一天平称量其干重。
根系表型的测定:将根部彻底清洗干净,用EPSON Scan根系扫描仪和WinRHIZO根系分析软件对根系的根长、表面积和根尖数等相关指标进行分析。
叶绿素相对含量的测定:在阳光充足的上午7:00-9:00用叶绿素仪(SPAD-502),测定每棵植株的第4~6片真叶的SPAD值,并且每个叶片取三个点进行测量取平均值以减小误差。
1.3.2 Na+、K+含量的测定
分别取葡萄砧木幼苗的根和叶烘干后的植株用消煮法进行消解,然后用FP640火焰光度计进行Na+、K+含量测定。
1.3.3 氮代谢关键酶活性的测定
将处理的葡萄砧木幼苗取出后洗净擦干水分,立即将根(主要取白根)和叶片分别用锡纸包裹放入液氮冷冻,-80℃冰箱保存。硝酸还原酶活性、亚硝酸还原酶活性、谷氨酰胺合成酶活性、谷氨酸合酶活性测定均使用索莱宝公司试剂盒进行测定,3次生物学重复试验。
1.3.4 全氮、硝态氮和铵态氮含量的测定
植株全氮含量用凯氏定氮法测定。硝态氮和铵态氮含量利用索莱宝试剂盒进行测定,3次重复试验。
1.3.5 15N同位素的示踪和氮利用效率的测定
将同位素处理后的葡萄砧木幼苗冲洗干净,分为叶片、茎、主干和根部四部分,剪碎后分别放入信封中,于烘箱中105℃杀青40min,80℃烘干至恒重,将样品放入粉碎机中研磨,过65目网筛,每个样品称取4mg用锡囊包裹,在山东农业大学使用稳定同位素质谱仪(英国 IsoPrime Limited)检测15N丰度。15N相关指标的计算:
R样 = (δ15N ÷ 1000 + 1) × R标;
标记样品15N丰度 = R样 / (R样 + 1);
15N原子百分超 = 标记样品15N丰度 - 15N自然丰度;
Ndff(%)= [(植物样品中15N丰度(%) - 15N自然丰度(%)] / [肥料中15N丰度(%) -15N自然丰度(%)] ×100%=各器官从氮肥中吸收的氮量(g) / 总吸收氮量(g) ×100%;
器官全氮量(g) = 器官生物量(g) × 氮含量(%);
器官15N吸收量(g) = Ndff × 器官全氮量(g);
氮肥利用率(%) = 器官15N吸收量(g) / 施肥量(g) ×100%。
式中,R标 =3676.5×10-6;15N自然丰度 =0.365%。
1.3.6 荧光定量PCR检测
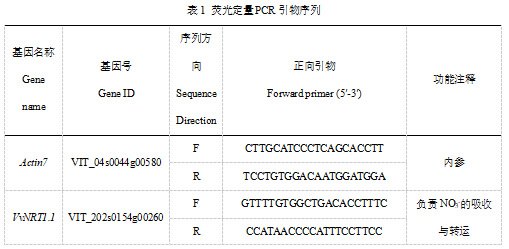
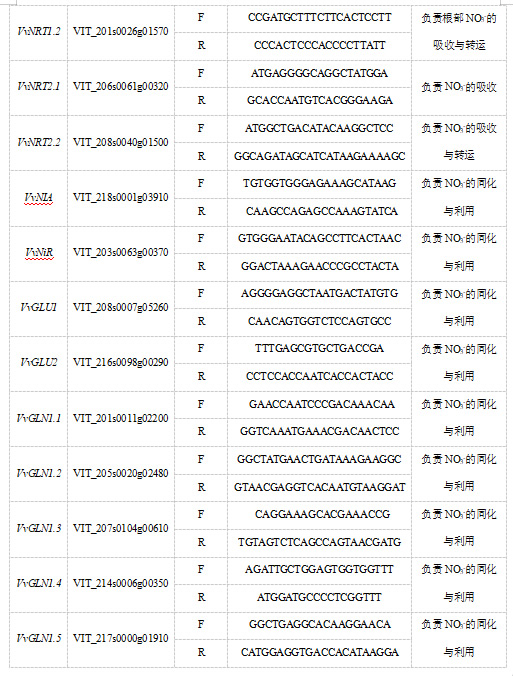
按照RNAiso Easy RNA 提取试剂盒 (Takara,北京) 的说明书从叶和根中提取总 RNA,使用 PrimeScript™ RT reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒(Takara,北京)进行反转录得到 cDNA,使用TB Green® Premix Ex Taq™ II (Tli RNaseH Plus)试剂盒(Takara,北京)进行qRT-PCR反应。使用 Roche LightCycler 96 real-time PCR system (Roche,Basel,Switzerland) 分析基因的相对表达量,以Vvactin7作为内参基因,定量引物利用在线软件Primer Premier 6进行设计,由华大基因股份有限公司(深圳)合成所需引物,相对表达量的计算采用2-ΔΔCt法(Livak and Schmittgen,2001)。每个样品进行 3 次生物学重复和3次技术重复,引物序列见表 1。
1.4 数据处理
试验数据采用Excel 2019进行数据整理,利用SPSS 26进行单因素处理和差异显著性检验,应用Origin 64和Graphpad Prism 8.0.1绘制图表。
2 结果与分析
2.1 盐碱胁迫对葡萄砧木幼苗生长发育的影响
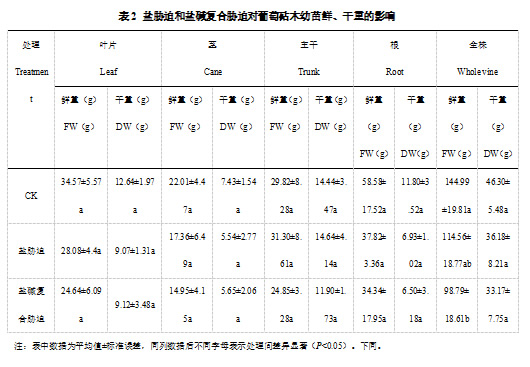
如表2所示,与对照相比,盐胁迫下葡萄砧木幼苗的叶片、茎、根以及全株的鲜重、干重都有一定程度的下降(盐胁迫下主干干重、鲜重除外),盐碱复合胁迫下葡萄砧木幼苗各个部位的鲜重和干重都有一定程度的下降。与对照相比,盐胁迫与盐碱复合胁迫的葡萄砧木幼苗的全株总鲜重分别降低了20.99%、31.86%,可见盐胁迫和盐碱复合胁迫会减少葡萄砧木幼苗生物量,盐碱复合胁迫的影响作用更明显,全株鲜重达到显著性差异。
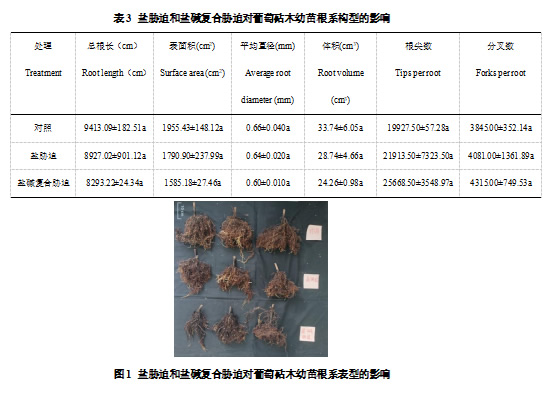
2.2 盐碱胁迫对葡萄砧木幼苗根系表型的影响
由图1可知,盐胁迫和盐碱复合胁迫都抑制了葡萄砧木幼苗根系的发育,且盐碱复合胁迫的抑制作用更明显,根系颜色更深,呈黑色。由表3可知,与对照相比,盐胁迫和盐碱复合胁迫的总根长、表面积、平均直径和体积都有所降低。但是与对照相比,盐胁迫和盐碱复合胁迫的根尖数和分叉数增加。结果表明盐碱胁迫抑制了葡萄砧木幼苗根系的生长。
2.3 盐碱胁迫对葡萄砧木幼苗SPAD值的影响
SPAD值是衡量植株叶片叶绿素相对含量的参数,如图2所示,盐胁迫和盐碱复合胁迫都能降低葡萄砧木幼苗叶片的SPAD值,与对照相比,盐胁迫和盐碱复合胁迫下SPAD值分别降低7.87%和13.90%,且盐碱复合胁迫对SPAD值的影响达到显著差异。
2.4 盐碱胁迫对葡萄砧木幼苗Na+、K+含量的影响
由图3A可知盐碱胁迫下叶片和根部的Na+含量变化趋势一致,均呈现出盐碱复合胁迫>盐胁迫>对照的趋势。与对照相比,盐胁迫与盐碱复合胁迫下叶片的Na+含量分别是对照的1.50倍和2.50倍。与对照相比,盐胁迫与盐碱复合胁迫下根部的Na+含量分别增加67.57%、78.99%。各个处理的叶片及根部的K+含量变化趋势相反。盐胁迫和盐碱复合胁迫下叶片的K+含量显著高于对照,分别是对照的2.26倍和2.81倍;而盐胁迫和盐碱复合胁迫下根部的K+含量显著低于对照,分别比对照降低33.26%和52.83%(图3B)。
2.5 盐碱胁迫对葡萄砧木幼苗氮代谢关键酶活性的影响
由图4可知盐、盐碱胁迫会抑制葡萄砧木幼苗叶片和根系中氮代谢关键酶的活性,NR是氮同化过程中第一个关键酶,和对照相比,盐胁迫和盐碱复合胁迫下叶片和根部的NR活性均显著下降,分别下降10.28%、14.54%和16.55%、25.42%。盐胁迫和盐碱复合胁迫下NR活性、NiR活性、GOGAT活性、GS活性在叶片和根部的变化趋势基本一致,均呈现出对照>盐胁迫>盐碱复合胁迫的趋势。盐胁迫和盐碱复合胁迫下叶片的NiR活性均显著低于对照,分别比对照降低26.78%和39.12%;盐碱复合胁迫下根部的NiR活性显著低于对照,分别比对照降低9.49%和19.66%。盐胁迫和盐碱复合胁迫下叶片的GOGAT活性均显著下降,分别比对照下降13.98%和16.08%;盐碱复合胁迫下根部的GOGAT活性显著下降,分别比对照下降13.66%和28.29%。盐碱复合胁迫下叶片和根部的GS活性显著低于对照,分别下降13.64%、21.79%和24.22%、36.10%。
2.6 盐碱胁迫对叶片和根部氮代谢相关基因表达的影响
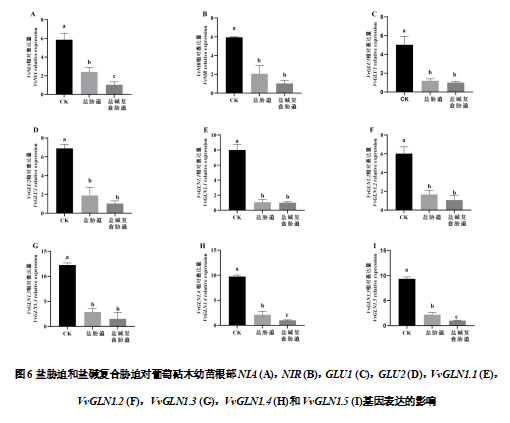
如图5可知,盐胁迫和盐碱复合胁迫均下调了氮代谢相关基因的表达水平。盐胁迫和盐碱复合胁迫处理叶片的VvNIA和VvNIR 基因的表达水平显著下调(P<0.05),分别较CK降低了68.61%、92.55%和66.26%、81.61%。VvGLU1和VvGLU2 表现出类似的趋势。和CK相比,盐胁迫和盐碱复合胁迫处理条件下,编码谷氨酰胺合成酶的基因除了VvGLN1.2 外,其他基因(VvGLN1.1,VvGLN1.3,VvGLN1.4和VvGLN1.5)的表达水平均显著下调(P<0.05)。
和CK相比,盐胁迫和盐碱胁迫条件下根系的VvNIA、VvNIR、VvGLU1和VvGLU2 以及VvGLNs(VvGLN1.1、VvGLN1.2、VvGLN1.3、VvGLN1.4和VvGLN1.5)均显著下调(P<0.05)。
2.7 盐碱胁迫对葡萄砧木幼苗氮素吸收的影响
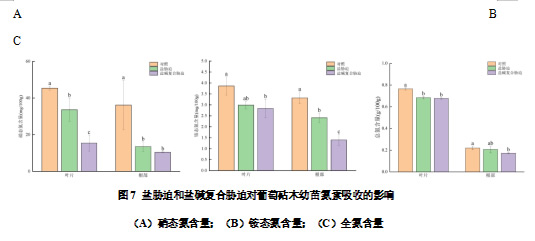
由图7A可知,和CK相比,盐胁迫和盐碱复合胁迫下叶片和根部的NO3-含量均显著降低,盐胁迫和盐碱复合胁迫下叶片的NO3-含量分别下降25.94%、66.02%;盐胁迫和盐碱复合胁迫下根部的NO3-含量分别下降62.64%、71.21%。
盐胁迫和盐碱复合胁迫下叶片的NH4+含量相比于对照均呈现降低的趋势,但只有盐碱复合胁迫下显著下降,分别比对照下降22.54%和35.92%。与CK相比,盐胁迫和盐碱复合胁迫下根部的NH4+含量均显著下降,分别比对照下降27.41%和57.83%(图7B)。
各个处理的叶片的全氮含量均高于根部,可能是由于由根部吸收的氮转移到叶片中供于叶绿素等物质的合成。盐胁迫和盐碱复合胁迫下叶片和根部的全氮含量相对于比对照均呈现降低的趋势,其中叶片分别比对照显著下降10.60%和11.39%;盐胁迫和盐碱复合胁迫下根部的全氮含量分别比对照下降6.10%和21.54%,其中盐碱复合胁迫达到显著差异(图7C)。
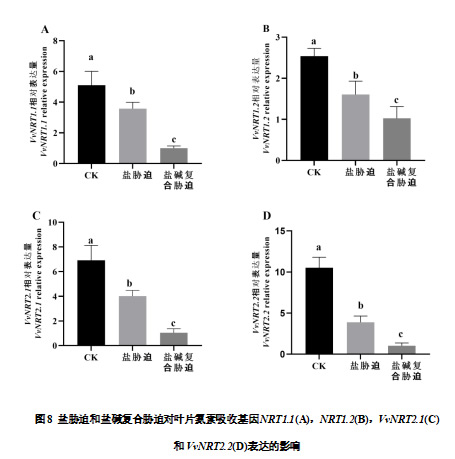
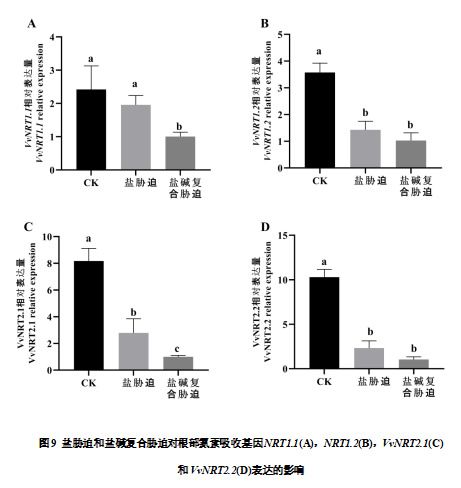
与CK相比,盐胁迫和盐碱复合胁迫下葡萄叶片的VvNRT1.1 均显著下调。叶片中VvNRT1.2 在盐胁迫和盐碱复合胁迫条件下相较于CK 处理均显著下调。盐胁迫和盐碱复合胁迫条件下葡萄叶片VvNRT2.1表达水平分别较CK处理下降42.18%和85.06%。
与CK相比,盐胁迫和盐碱复合胁迫条件下葡萄根系的VvNRT1.1和VvNRT1.2 均下调表达,其中盐碱复合胁迫条件下差异显著。盐胁迫和盐碱复合胁迫条件下葡萄根系VvNRT2.1和VvNRT2.2的表达水平较CK处理均显著下降,分别下降65.89%、87.72%和77.45%、89.95%。
2.8 盐碱胁迫对葡萄砧木幼苗15N肥利用率的影响
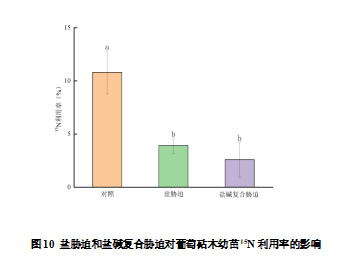
利用15N同位素标记试验分析盐、盐碱复合胁迫对葡萄砧木幼苗15N的吸收分配利用情况发现,盐胁迫、盐碱复合胁迫下15N利用率显著低于对照,分别显著降低63.83%、75.95%,呈现对照>盐胁迫>盐碱复合胁迫的趋势。
3 讨论
3.1 盐碱胁迫对葡萄生长发育的影响
盐碱胁迫对植物最直观的伤害就是明显抑制植株的生长[30]。小麦、花生、海岛棉和柑桔受到盐碱胁迫后,叶片、根系以及根系形态的形成被抑制[31-33]。本研究表明,盐碱复合胁迫抑制了葡萄砧木幼苗的生长发育,植株的总鲜重、总干重和SPAD值等生长指标都出现了下降的趋势。这可能是由于盐碱胁迫影响了根系形态,使根系受到了损伤,根总长、总表面积、总体积以及平均直径降低,影响水分和营养元素(包括氮素等)的吸收利用所致。本研究发现,盐碱胁迫条件下葡萄植株的根尖数和分叉数增加,根长变短,这可能是盐碱胁迫条件下导致根系无法继续下扎,根尖分裂,根系横向生长所造成的,具体的机制有待进一步研究。
3.2 盐碱胁迫对葡萄Na+含量和K+含量的影响
Na+通过Na+/H+逆向转运蛋白在植物液泡中积累,一方面使Na+离开代谢位点缓解Na+对酶和膜系统造成的伤害作用,另一方面利用液泡中的Na+作为渗透调节剂来抵抗盐分造成的渗透胁迫,是植物耐盐性的重要机制。本试验中盐碱胁迫下叶片中Na+增加也是SPAD值降低的关键原因之一,根部Na+大量积累,盐胁迫与盐碱复合胁迫下叶片的Na+含量分别是对照的1.50倍和2.50倍,表明葡萄砧木幼苗在盐胁迫与盐碱胁迫下将Na+隔离于根部以保证地上部正常生长。盐胁迫和盐碱复合胁迫下,土壤中的Na+含量高,植物根系吸收过量的Na+会导致K+、Mg2+、Ca2+等离子的外排与流失,并且以K+的外排最为显著,结果使根中的Na+含量增加,K+含量降低,本试验的结果发现盐胁迫和盐碱复合胁迫下根部的K+含量显著低于对照(图3B)。
3.3 盐碱胁迫对葡萄氮素积累转运的影响
氮素是葡萄生长中需求量最大的矿质元素之一,参与到蛋白质、核酸、叶绿素、酶、维生素和生物碱等有机化合物的合成过程中[34-35]。盐碱胁迫使得葡萄植株氮吸收转运受阻。在对水稻和番茄的研究中发现盐胁迫能够显著抑制地上部NO3-的吸收量[36],在对小麦的研究中盐胁迫下能够抑制地上和地下部对NO3-的吸收[37]。NR的活性直接影响到NO3-的含量。本研究发现,盐胁迫和盐碱复合胁迫处理的葡萄的VvNRT1.1和VvNRT1.2的表达下调,表明盐碱胁迫可能在一定程度上影响了葡萄砧木幼苗对氮素的吸收与转运。紧接着我们测定了葡萄砧木幼苗的氮代谢关键酶活性和NO3-、NH4+以及全N含量来验证上述猜想。结果发现,盐碱胁迫下NIA基因表达下调,NR活性降低,使得NO3-转化为NO2-的能力下降,然而NO3-在根系和叶片的含量也低于对照;盐碱胁迫导致葡萄砧木幼苗的NIR基因表达水平下降,NiR酶活活性也降低,体内的NO2-和NH4+含量也低于对照,这表明盐碱胁迫降低了葡萄砧木幼苗对NO3 −的吸收与转运能力,使得NO3 −同化为NO2-以及NO2-同化为NH4+的能力也相应减低。本研究中盐、盐碱复合胁迫对根系NH4+含量的影响较大,且大于对叶片NH4+含量的影响,可能是由于根中NO3-的含量减少和NR、NiR活性降低,使还原得到的NH4+减少,使盐胁迫下葡萄砧木幼苗根部NH4+含量较对照显著减少,又因为盐碱复合胁迫下使葡萄砧木幼苗处于高pH环境,使较多的NH4+转化为NH3,使根中的NH4+含量显著降低。NH4+在葡萄体内通过GS和GOGAT的作用最终转变成有机氮,盐碱胁迫使得VvGLU 和 VvGLN基因的表达下调,GS和GOGAT活性降低,带来的结果就是有机氮减少,植株全氮含量下降,最终影响氮素的代谢。
3.4 盐碱胁迫对葡萄氮素利用率的影响
为了验证上述试验结果,我们利用K15NO3同位素标记试验进一步证实。研究发现,15N吸收总量在盐胁迫和盐碱复合胁迫处理的葡萄砧木幼苗中显著降低,吸收的15N主要分布在根系和叶片中,15N利用率也显著下降,这表明,盐碱胁迫导致葡萄砧木幼苗对NO3-的吸收转运与利用能力降低,氮代谢水平降低。
综上所述,盐胁迫和盐碱复合胁迫影响了5BB葡萄砧木幼苗的根系构型,这可能影响水分和营养元素(包括氮素等)的吸收利用。对NO3–转运蛋白分析发现,盐胁迫和盐碱复合胁迫下调了VvNRT1.1、VvNRT1.1、VvNRT2.1和VvNRT2.2的表达,使得根部或叶片的NO3–转运受阻。接下来对氮代谢关键酶活性分析发现,盐胁迫和盐碱复合胁迫会降低叶片和根系中氮代谢关键酶活性,下调相应的氮代谢基因的表达水平,这表明盐胁迫和盐碱复合胁迫会降低5BB葡萄砧木幼苗氮代谢水平。进一步发现盐胁迫和盐碱复合胁迫能够降低NO3–、NH4+及总氮的含量,盐胁迫和盐碱复合胁迫下叶片和根部的NO3–含量显著低于对照,盐胁迫和盐碱复合胁迫下根部的NH4+含量显著低于对照,盐胁迫和盐碱复合胁迫下叶片的总氮含量显著低于对照,接下来用 K15NO3同位素标记表明盐胁迫和盐碱复合胁迫条件下葡萄砧木幼苗15N利用率较CK显著降低,这表明盐胁迫和盐碱复合胁迫会降低5BB葡萄砧木幼苗氮素利用。通过测定葡萄幼苗的生物量和SPAD值,发现盐胁迫和盐碱复合胁迫降低了葡萄砧木幼苗叶片、茎、根以及植株的总干鲜重,盐碱复合胁迫能够显著降低葡萄砧木幼苗的SPAD值,这表明盐胁迫和盐碱复合胁迫使得5BB葡萄砧木幼苗的氮代谢能力下降,从而抑制了幼苗的生长发育。
4 结论
盐胁迫和盐碱胁迫影响了5BB葡萄砧木幼苗的根系构型,下调了氮转运相关基因的表达,使得5BB葡萄砧木幼苗叶片和根系中氮代谢关键酶NR、NiR、GS、GOGAT活性降低,氮吸收同化相关基因表达量下调,叶片和根系中NO3-、NH4+和总氮的含量减少,同位素示踪试验结果发现15N利用率降低,表明盐胁迫和盐碱复合胁迫使得5BB葡萄砧木幼苗对氮素的转运同化利用减少,氮代谢水平下降,从而抑制其生长,且盐碱复合胁迫对葡萄砧木幼苗的抑制作用大于盐胁迫的抑制作用。