制汁葡萄品种改良岗位
郭印山 姜长岳 林洪 刘镇东
葡萄灰霉病是危害葡萄产业正常发展的的重要病害之一,可以侵染葡萄多种组织部位包括成熟的果实、花序、幼穗、新梢、果柄和幼嫩的绿叶等,受侵染的部位表面会覆盖灰色的霉层,且组织部位逐渐腐烂坏死。在葡萄整个生长周期会面临两次灰霉病易感期,第一次从花序分离后至开花期,主要对侵染花序部位并产生危害;第二次为果实着色期至成熟期,主要引起果实腐烂。目前国内主栽葡萄品种抗病性较差且在栽培管理上以采用化学防治的方法为主,在增加栽培成本的同时会造成环境污染,尤其是残留在葡萄果实表面的化学残留物会对人体健康造成潜在的危害。因此培育出抗病、丰产和优质的葡萄新种质是我国葡萄育种工作的重要任务。
本研究以母本‘红地球’、父本‘贝达’及其杂交F1代群体为材料,采用离体叶片接种法对196株杂交后代的叶片进行灰霉病抗性鉴定试验,并筛选出抗病性强的株系,对杂交后代的灰霉病抗性遗传趋势进行了初步分析。研究结果为今后葡萄抗灰霉病新品种的选育工作提供理论参考和材料。
1 材料与方法
1.1 试验材料
‘红地球’ב贝达’杂交F1代群体共196株。供试葡萄材料的栽培、选育和采集均在沈阳农业大学葡萄资源圃进行。
1.2 方法
1.2.1 葡萄灰霉菌的培养
利用PDA培养基进行葡萄灰霉菌的培养。将200g新鲜健康的马铃薯去皮洗净,切成长宽高约为1cm的小正方体,放入电磁炉中熬煮约30min,熬煮后取四层纱布进行过滤,在滤液中分别加入20g琼脂粉和葡萄糖,搅拌均匀后定容至1L,进行高压灭菌。灭菌后在超净工作台中分装PDA培养基至无菌培养皿中,在培养基冷却后用接菌针将灰霉菌菌块挑起并接种于培养基上,利用封口膜封闭培养皿并放置于温度22°、湿度80%的培养箱中进行培养。
1.2.2 葡萄灰霉菌孢子悬浮液的配制
从培养箱中取出大量萌发出灰霉菌孢子且已形成密集菌丝体的培养基,首先利用无菌水进行浸泡处理,用涂布器刮取培养基上的菌丝体,进行孢子悬浮液的配置。在万能电子显微镜下使用血球计数板(25×16型)计算孢子悬浮液的浓度,将孢子侵染浓度控制在每毫升1×107个。
1.2.3 葡萄亲本及杂交群体叶片接种灰霉菌处理
分别取亲本及其杂交后代单株新梢顶端第4~5片健康葡萄叶片为供试材料,每个单株选取3片健康状况相同、大小相似的叶片分别进行3次生物学重复。将葡萄叶片用无菌水洗净后用滤纸吸干水分,放置于无菌培养皿的盖子上,在培养皿的底部放置双层滤纸并用无菌水浸湿。利用五针刺伤法将制备好的孢子悬浮液接种在叶片的正面(避开叶片主叶脉)。在叶片上选择2处不同位置进行接种,接种完毕后将装有叶片的培养皿放置于22℃、相对湿度90%的人工智能气候培养箱中(MLR-352H-PC,Panasonic),培养箱光照条件设置为12h光照、12h黑暗进行培养,使用智能叶面积测量仪(YMJ-C)分别在接种后0h、72h、120h对叶面积及平均病斑面积(病情严重度DS)进行统计。记录数据并用于后续整理分析。
1.2.4 葡萄亲本及杂交群体灰霉病抗性鉴定
灰霉病抗性鉴定分级方法如下:DS(病情严重度)≤20.00%为1级;在20.00%<DS≤25.50%为2级;25.50%<DS≤36.00%为3级;36.00%<DS≤46.50%为4级;46.50%<DS≤57.00%为5级;57.00%<DS≤74.50%为6级;74.50%<DS 为7级。根据亲本及其杂交后代群体的灰霉病抗性鉴定数据进行病情指数(Disease Index,DI)计算,按照病情指数的大小,将灰霉病叶片表型数据分为五个抗性等级:当0≤DI<15时,为高抗类型;当15≤DI<30时,为抗病类型;当30≤DI<50时,为中抗类型;当50≤DI<70时,为感病类型;当70≤DI≤100时,为高感类型。病情指数计算公式如下:

2 结果与分析
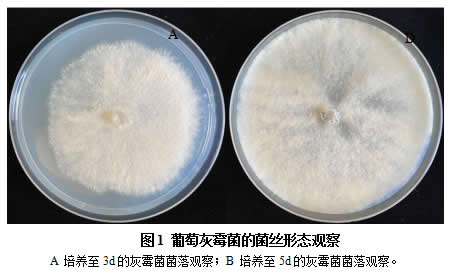
2.1 葡萄灰霉菌菌丝形态观察分析
在PDA培养基上进行灰霉菌的培养至5d后,观察发现灰霉菌菌丝体长势良好,无杂菌感染,说明灰霉菌纯度较高,可用于葡萄叶片的侵染。图1A为培养了3d后的灰霉菌,可看到菌丝由中心接种点向周围扩繁生长,菌丝为白色无杂菌感染。图1B为培养5d的灰霉菌,菌丝生长旺盛且布满整个培养皿,无杂菌生长,说明本研究前期培养的灰霉菌纯度较高,为用于后续葡萄叶片的侵染实验。
2.2 葡萄亲本间灰霉病抗性鉴定
以母本‘红地球’葡萄和父本‘贝达’葡萄为供试材料,利用葡萄灰霉菌孢子悬浮液对亲本葡萄叶片进行离体接种处理,在两个亲本葡萄品种的抗病性鉴定中发现,‘红地球’葡萄和‘贝达’葡萄的抗病表现差异性较大,从侵染后5d的病斑面积上可以看出‘红地球’的病斑面积远大于‘贝达‘的病斑面积。上述结果说明‘红地球’感病性较高,而‘贝达’葡萄的抗病性更强(图2)。

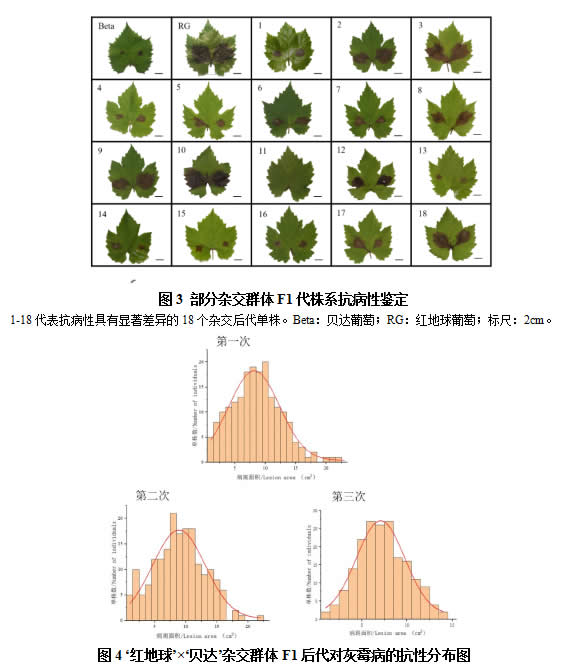
2.3 红地球×贝达杂交F1代群体的抗病性鉴定及遗传分析
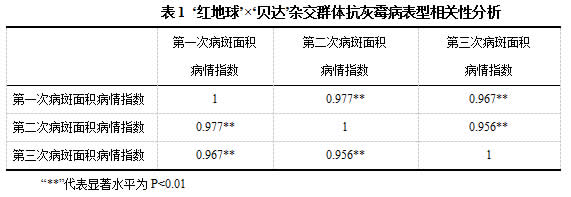
以‘红地球’葡萄为母本,抗病葡萄品种‘贝达’为父本进行杂交,选择杂交后代196个葡萄株系,以亲本及及其杂交后代株系为供试材料,利用灰霉菌孢子悬浮液对成熟叶片进行接种处理,杂交F1代单株的发病情况如图3所示。可以看出,群体后代株系间的发病情况不一致,病斑大小存在差异性。图4是杂交后代株系对灰霉病的抗病性分布图,从图中可以看出杂交群体后代对灰霉病的抗性呈连续性分布,表现出数量性状遗传的特征,整体上接近正态分布,并且病斑面积分布均匀,但部分杂交后代单株的抗病性也存在超亲现象(图4)。
将三次独立进行的抗病性鉴定表型数据进行相关性分析,使用生物信息学分析软件SPSS进行抗灰霉病表型相关性系数的分析(表1),结果显示,三次鉴定试验的结果相关性差异不大,其中第一次和第二次试验的相关性最高,相关性系数为0.977,呈现显著正相关(P<0.01),第二次和第三次试验测得表型的相关性是0.956,呈现显著正相关(P<0.01);第一次和第三次的相关系数为0.967;呈现显著正相关(P<0.01)。
通过对抗病表型数据进行病情指数统计分析,结果表明三次鉴定结果中母本‘红地球’的病情指数均大于父本‘贝达’葡萄的灰霉病病情指数(表2),杂交后代中子代平均值高于亲中值,与母本的病情指数相近,组合传递力高于100%,说明‘红地球×贝达’杂交后代群体抗病性有减弱的趋势。杂交后代中具有较高的变异系数(28.1%-30.7%),表明杂交后代中灰霉病抗性分离广泛,超低亲率较高,后代中有较大的筛选抗病单株的潜力。
3 小结
本研究以灰霉病抗病性强的葡萄品种‘贝达’和抗病性弱的‘红地球’葡萄为亲本材料,从杂交F1代群体中筛选出抗病性差异显著的株系。采用灰霉菌孢子悬浮液并对离体离体葡萄叶片进行侵染,完成杂交群体进行抗病性鉴定,并对鉴定结果进行遗传分析,得出以下结论:‘红地球’ב贝达’杂交后代群体的抗灰霉病表型呈正态分布,葡萄抗灰霉病性状呈现数量遗传的特点,且在杂交后代中筛选出部分高抗和易感型葡萄单株,后续将利用‘高抗’和‘易感’两种抗病性具有显著差异性的葡萄试材进行遗传群体的研究,为构建高密度遗传图谱进行QTL精细定位提供重要的种质资源,同时也为葡萄抗灰霉病特性的遗传研究奠定了理论基础和参考依据。