酿酒微生物岗
刘延琳
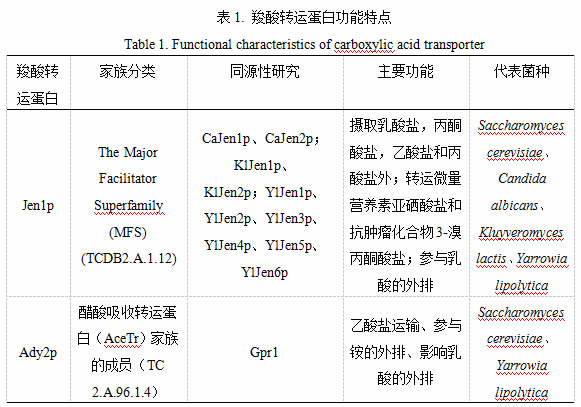
目前对酵母质膜羧酸转运体的研究已经比较丰富,主要是Jen1p、Ady2p、Pdr12p、Fps1p以及Mae1p。研究人员对这些编码质膜羧酸转运蛋白的基因片段进行了测序;对其转录产物,即相应的蛋白,进行了家族分类、同源性研究、功能鉴定、转运机制以及调控机制研究。
1 Jen1p
1.1 家族分类
JEN家族是真菌中负责羧酸质膜转运的主要促进剂超家族,其编码的蛋白Jen1(p)是定位于质膜中的单/二羧酸转运蛋白。该家族所被发现的第一个成员是酿酒酵母S. cerevisiae的SCJEN1,是唾液酸-质子共转运体亚科中属于主要促进者超家族的唯一酿酒酵母成员。
1.2 同源性研究
在乳酸克鲁维酵母中,鉴定出两种Jen1同系物,一种编码乳酸和丙酮酸单羧酸转运体(KlJen1p),另一种编码苹果酸和琥珀酸二羧酸转运体(KlJen2p)。
可以将K1Jen1p视为酿酒酵母ScJen1p的功能直向同源物;而尽管两个蛋白之间存在序列相似性,但KlJen2p不是ScJen1p的功能同源物。
在白色念珠菌中也发现了类似的转运体:CaJen1p与CaJen2p。其中,CaJen1p转运乳酸等一元羧酸,而CaJen2p转运琥珀酸和苹果酸二元羧酸。这些Jen1p同源物的系统发育分析表明,存在两个功能簇Jen1和Jen2,它们分别包含功能上表征的单羧酸和二羧酸转运蛋白。Guo等在解脂耶氏酵母中同样发现Jen1的同源物,共有六个,分别为:YALI0B19470p(YLJen5p),YALI0C15488p(YLJen1p),YALI0C21406p(YL-Jen2p),YALI0D20108p(YLJen3p),YALI0D24607p(YALI0D24607p )。
研究发现葡萄糖不抑制YLJEN1,YLJEN2,YLJEN5或YLJEN6的表达,推测解脂耶氏酵母中未发生葡萄糖分解代谢物阻遏。不同的YLJenp的表达水平和转运目标差异很大,其中,YLJEN1基因在不同羧酸存在下均存在表达增加的现象,似乎YLJen1p是主要的,最有效的转运蛋白,其次是YLJen6p。有些研究表明它们与乳酸、丙酮酸、富马酸、苹果酸、琥珀酸和柠檬酸等一元、二元和三元羧酸的转运有关,这也表示解脂耶氏酵母可能具有转运这些酸的能力。在产朊假丝酵母(Candida utilis)、戴尔凯氏有孢圆酵母(Torulaspora delbrueckii)、马克斯克鲁维酵母(Kluyveromyces marxianus)中均发现了类似的乳酸转运体,但是他们的乳酸运输的机制是不同的。产朊假丝酵母和戴尔凯氏有孢圆酵母同酿酒酵母一样通过质子共转运体转运乳酸,而马克斯克鲁维酵母是单向转运。此外,Isabel等还表征了汉逊德巴利酵母(Debaryomyces hansenii)的四个酿酒酵母ScJen1p同源物的功能,推测其可摄取乳酸盐,乙酸盐,琥珀酸盐和苹果酸。
1.3 功能鉴定
除乳酸外,ScJen1p还运输乙酸、丙酸和丙酮酸。其底物的转运是双向的,故ScJen1p也参与酸的外流。有证据显示,ScJen1p是酵母中单羧酸盐转运蛋白的唯一模型,对于在酿酒酵母中摄取乳酸盐和其他单羧酸盐是必需的,而ScJen1p对此类单羧酸/盐的跨质膜主动转运严格取决于SCJEN1的表达。SCJEN1由乳酸特异性诱导,受到葡萄糖在转录,mRNA周转和载体失活水平上均收到葡萄糖分解代谢物阻遏的影响,葡萄糖显著破坏SCJEN1的 mRNA的稳定性,这一过程不依赖于转录因子Mig1p,并且独立于cAMP的途径;其产物ScJen1p在向细胞中添加葡萄糖后迅速通过内吞作用内化并积聚在液泡中,最终降解,经历不可逆的分解代谢失活过程。这一过程依赖蛋白水解酶Doa4p进行。研究表明,乳酸通透酶的泛素化标志着其内吞作用。
研究表明酵母中的JEN1除了它在乳酸、丙酮酸、乙酸和丙酸的吸收中的作用,还参与运输微量营养素亚硒酸盐。
1.4 转运调控机制
对Jen1的表达在转录水平、转录后水平和翻译后水平上的调节进行研究,主要集中于酿酒酵母的SCJEN1。发现在乳酸、丙酮酸、乙酸或甘油生长的细胞中,JEN1高度表达,而在葡萄糖、甲酸和丙酸生长的细胞中则不可检测。有研究表明,编码乳酸转运体的酿酒酵母JEN1基因在转录和转录后水平上都受到强烈的分解代谢抑制。如果在诱导的细胞培养中加入葡萄糖、果糖或甘露糖可以大大加速SCJEN1 mRNA的衰减,而添加乙醇并不会加速JEN1 mRNA降解。该研究还表明,在葡萄糖存在下,SCJEN1的转录调控不是导致SCJEN1 mRNA加速衰减的主要因素,己糖激酶PII(Hxk2p)除了在糖酵解途径中具有酶促活性外,还在葡萄糖对不同基因的转录调节中起调节作用。在酿酒酵母hxk2缺失突变体中,可以观察到葡萄糖触发的JEN1 mRNA衰减的抑制作用,当然,这很可能与缺乏完整的转录抑制有关。此外,虽然mRNA分子的5’UTR对于葡萄糖触发的mRNA衰变是必要的,但SCJEN1似乎并非如此。Mota S等]对具有JEN1和ADY2基因突变的酿酒酵母菌株的实验显示,DHH1,一种参与基因调控的mRNA解旋酶,可能在转录后水平调控JEN1的表达。
2 ADY2
2.1 家族分类
ADY2是乙酸摄取转运体(AceTr)的家族成员,普遍存在于古细菌、真细菌以及部分真核生物中。
解脂耶氏酵母的Gpr1(TC 2.A.96.1.2)是酵母菌中发现的第一个AceTr家族成员。已有证据表明,它与乙酸敏感性、细胞和菌落形态、酵母到菌丝的转化和细胞寿命有关。与在葡萄糖为碳源的培养基中生长的细胞相比,GPR1转录在以乙酸或乙醇为碳源的培养基中被诱导或解除抑制。Gpr1p对解脂耶氏酵母在含乙酸的培养基的适应中起作用,但是对于已经适应乙酸的细胞的生长并不是必需的。Tzschoppe等曾报道Gpr1的缺失引起乙酸利用缺陷的现象,这也表明了Gpr1可能与乙酸的转运相关。Rosan等在最新研究中将Ady2同源成员被分配给醋酸盐吸收转运蛋白(AceTr)家族,重新分类为ATO(醋酸转运蛋白直系同源物)。
2.2 同源性研究
酿酒酵母ADY2(Tc2.A.96.1.4)和Ato3(Tc2.A.96.1.5)和Fun34(Tc2.A.96.1.5)基因与解脂耶氏酵母的Gpr1基因同源。
2.3 功能鉴定
Paiva等对ADY2、Fun34与Ato3的缺失突变体进行了乙酸摄取量的测定,结果显示,与野生型菌株相比,只有ADY2缺失的突变体在运输乙酸盐的能力上受到强烈影响,其中没有检测到乙酸盐吸收,只能检测到乙酸的简单扩散。而其他两个Gpr1类基因的缺失则没有显著影响。但Marcus等对酿酒酵母GPR1同源物YCR010c(ATO1)和YNR002c(ATO2)中的一些突变体的研究表明,它们反式诱导了该酵母的乙酸超敏反应。Mingming等对删除乙酸转运蛋白基因ADY2的酿酒酵母的研究表明,在存在乙酸胁迫的情况下,ADY2被显著下调,并且缺失ADY2改善了酿酒酵母在乙酸,乙醇下的生长并缓解了过氧化氢压力。
2.4 转运调控机制
ADY2和JEN1具有相似的表达谱,包括在限制碳、氮、磷或硫的条件下酿酒酵母转录反应的激活;基因表达的调节以及都需要Cat8p才能表达,并都受到Adr1p的调节。Christine等的研究还表明,这两个基因的完全表达都需要Snf1p蛋白激酶的存在。Abate等认为,Snf1p参与细胞对许多其他环境胁迫的适应,包括营养胁迫、渗透胁迫,热休克,氧化胁迫和遗传毒性胁迫等,其作为碳和能量代谢的主要调节剂的作用更为广泛。在没有Snf1p或Adr1p和Cat8p的情况下,ADY2 mRNA的积累会受到严重损害。Snf1p在ADY2 mRNA积累中起主要作用。
除羧酸盐转运,酿酒酵母ADY2还具有其它职能,有研究表明,除作为乙酸渗透酶外,ADY2和同样为一元羧酸转运蛋白的JEN1都是乳酸产生的调节剂,可以很好地用于控制酵母细胞中乳酸的输出。
对ADY2的表达在转录水平、转录后水平和翻译后水平上的调节进行研究,与JEN1类似,该基因同样被其对应蛋白的相应转运物特异性诱导,并被葡萄糖抑制。其葡萄糖抑制与解除抑制的机制也存在很多近似之处,这一部分将在下文进行详述。
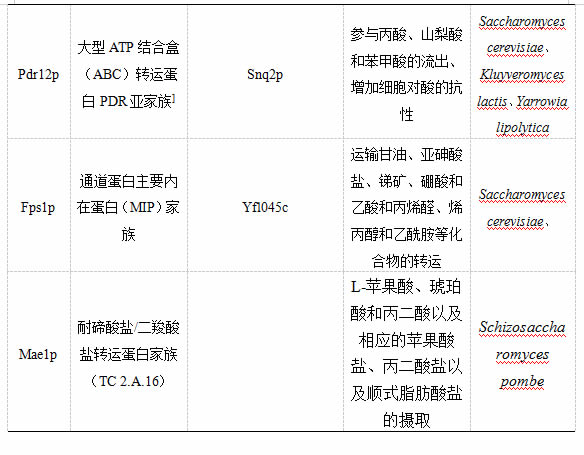
3 Pdr12p
3.1 家族分类
Pdr12p是一个大型ATP结合盒(ABC)转运蛋白PDR亚家族的成员,专性参与羧酸的流出。
3.2 同源性研究
Pdr12p位于质膜上,对酵母适应弱酸胁迫至关重要,可以催化弱酸阴离子从酵母细胞的细胞质中主动流出。其正确表达、定位和功能由Pdr10p控制,Pdr10p是ABC亚家族的另一成员。酿酒酵母中 Pdr12p序列比Pdr5p(38%)更接近 Snq2p(46%)。故Pdr12p和Snq2p群集可能为的共同起源。
3.3 功能鉴定
具体来说,Pdr10p控制Pdr12p在膜中局部环境以及脂质筏(细胞表面的一种特殊结构)中的分配。Pdr12p能够特异性参与丙酸、山梨酸和苯甲酸的流出,增加细胞对这些酸的抗性,使酵母细胞在该高浓度酸胁迫的环境下获得较高生存力。
3.4 转运调控机制
Piper等的研究发现,丙酸,山梨酸或苯甲酸以及酸性pH的存在会强烈诱导Pdr12p的表达。但脂肪链长度大于C7而具有高度疏水性的羧酸或高度亲水性的乳酸、乙酸和甲酸无法通过Pdr12p出口。除了介导C3到C10直链羧酸的转运,Pdr12p还可以转运多环化合物(例如咖啡因)和一些荧光素分子。Bauer等的研究表明,细胞对乙酸应激的特异性反应不涉及Pdr12p泵的激活。Nygard等的研究表明,Pdr12p在羧酸胁迫响应中的影响取决于酸疏水性的程度,即,Pdr12p的表达会降低对亲水性甲酸,乙酸,乳酸和乙醇酸的耐受性,而中等疏水性的山梨酸、丙酸和乙酰丙酸则正相反。需要指出的是,尽管受到高酸胁迫,PDR12启动子由山梨酸和苯甲酸强烈诱导,但其他形式的胁迫几乎没有诱导作用。氧化应激、低张应激或钙/钙调素信号都不诱导PDR12。
酸解离引起的H+和带电荷阴离子(RCOO-)的释放改变了质膜电化学电位。Pma1p能够介导质子的流出,中和细胞质的酸化,但仍然存在电荷不平衡。因此,通过Pdr12p泵出酸性阴离子可以避免它的毒性积累的同时,还以细胞内ATP的消耗为代价,恢复了电荷平衡。Ca2+±钙调蛋白依赖性的蛋白激酶Cmk1能够执行Pdr12p特定功能,例如荧光素和苯甲酸酯的能量依赖性细胞挤压。缺少Cmk1的酿酒酵母细胞本质上对弱酸胁迫具有抗性,因为它们无需在迟滞期中花费很长的适应期,即可在暴露于这种应激后恢复生长。Cmk1缺失并不影响在缺乏弱酸胁迫下生长的细胞的Pdr12p蛋白水平,也不增加PDR12基因的转录,Cmk1事实上是通过转录后机制增加Pdr12p转运蛋白的活性。尚不清楚Cmk1是通过直接使该蛋白磷酸化来负调节Pdr12p转运蛋白,还是通过使Pdr12p的调节剂磷酸化来间接调节Pdr12p转运蛋白。不过Caroline等已经检测到的表观Pdr12p磷酸化明显独立于Cmk1。
在光滑念珠菌、白色念珠菌以及乳酸克鲁维酵母中均鉴定出酿酒酵母Pdr12p同源物。Hebert A等研究表明,在乳酸克鲁维酵母中,Pdr12p还与4-甲硫基-氧代丁酸(一种衍生自蛋氨酸的杂酸)的流出有关。Lucie A等的研究同样证实,Pdr12p参与氨基酸分解代谢产生的杂酸从细胞中的输出。
Kostas等鉴定出WAR1(弱酸抗性)是PDR12表达的阳性调节剂,无论是否存在环境胁迫,War1p在都能识别并占据一个顺式的弱酸反应元件(WARE)。弱酸胁迫会触发War1p的磷酸化和激活。
4 Fps1p
4.1 家族分类
Fps1p是通道蛋白的主要内在蛋白(MIP)家族的成员。 MIP家族是存在于所有生物体中的一组完整的膜蛋白,分为对水有选择性渗透的成员(水通道蛋白)和由甘油渗透而在较小程度上被水渗透的成员,称为水甘油通道蛋白或甘油促进剂。
4.2 同源性研究
在酿酒酵母基因组中发现编码水甘油孔蛋白的两个成员,即Fps1p与 Yfl045c。FPS1编码酵母的水甘油孔蛋白Fps1p,能够介导未解离形式的乙酸进入细胞。而另一个成员,Yfl045c,但其功能仍不明确。
4.3 功能鉴定
有人对酿酒酵母中传统水通道蛋白(Aqy1p和Aqy2p)和甘油通道蛋白(Fps1p和Yfl054c)进行了分析,发现其不仅作为通道而且具有传感器的功能性作用。这些转运蛋白插入生物膜中形成通道,介导水或甘油等小分子的转运。
4.4 转运调控机制
与其他水甘油孔蛋白相比,Fps1不以单体工作,而很可能是水孔蛋白的同型四聚体。在高渗透压胁迫的条件下,包括酿酒酵母在内的许多真菌物种通过产生并保留高浓度的甘油作为相容性溶质来维持渗透平衡。酿酒酵母中的细胞内甘油浓度部分受Fps1甘油通道的调节。外部渗透压升高会导致Fps1闭合,而渗透压降低则会导致通道打开,两者都在外部渗透压变化的几秒钟内完成。在酵母细胞融合过程中,也需要Fps1p来控制膨胀压力。
在酿酒过程中,Fps1p介导甘油被动扩散的作用是维持氧化还原平衡的关键因素,这是抗乙醇胁迫的重要特征,并可能干扰酵母细胞积累海藻糖的能力。此外,Fps1p还参与对渗透胁迫的甘油外流以及亚砷酸盐、锑矿和未解离形式的乙酸的流入。
Fps1p表达调控依赖于Hog1-MAPK途径。当Hog1被高渗胁迫激活,与Fps1的N-末端结合,导致通道关闭并阻止甘油流出。在低渗透条件下,水进入细胞,引起肿胀压力,导致通道打开,甘油通过Fps1流出。Fps1p的活性也受一对正调节剂控制,分别称为Rgc1(甘油通道1的调节剂)和Rgc2(分别为YPR115W和YGR097W)。进一步的遗传分析表明,Hog1是Rgc1和Rgc2的负调节剂,电泳带移分析表明Rgc2在高渗休克反应中被磷酸化,部分依赖于Hog1。这表明Hog1可能通过Rgc1和Rgc2间接调节Fps1p活性——Hog1通过从Fps1p释放Rgc2(或者是Rgc1)来诱导水甘油通道关闭。此外,乙酸胁迫也会激活Hog1-MAPK途径导致Fps1衰变。Hog1在液泡中磷酸化质膜水合糖皮质激素,促进Fps1p磷酸化、泛素化、内吞和降解,减少乙酸的吸收,因此使细胞更能抵抗酸性胁迫。
5 Mae1
5.1 家族分类
MAE1是酵母中编码羧酸通透酶基因的第一个克隆和功能分析的基因片段,经鉴定,可分类为TDT家族的硬脂酸和二羧酸盐转运蛋白(TC 2.A.16)。
5.2 功能鉴定
MAE1编码粟酒裂殖酵母(Schizosaccharomyces pombe)中的二羧酸载体,主要与L-苹果酸、琥珀酸和丙二酸以及相应的苹果酸盐、丙二酸盐以及顺式脂肪酸盐的摄取相关,但与Sousa等的发现相反,α-酮戊二酸似乎不由这一载体运输。
5.3 转运调控机制
Mae1p是一种具有亲水性N-末端和C-末端的典型跨膜蛋白,其N-末端未发现信号肽,但可能存在内部信号肽。Maria等的研究表明,MAE1基因编码苹果酸和其他C4二羧酸的通透酶,并表现为质子-羧酸共转运体,不受葡萄糖的阻遏。Grobler等对MAE1基因在葡萄糖、棉子糖或果糖存在下表达的研究同样表明,粟酒裂殖酵母的MAE1基因表达不受到分解代谢抑制。
在酿酒酵母中,L-苹果酸只有在可吸收碳源存在的情况下才会被代谢。这种L-苹果酸的不完全消耗可能是由于苹果酸吸收有限和缺乏参与酸代谢的酶系统。Salmon等的报道也证明,在酿酒酵母中,L-苹果酸的运输不是载体介导的,而是以未分离分子形式通过简单扩散缓慢地进入细胞。并且,外源L-苹果酸(3g/L)的消耗量有限(10-20%),降解苹果酸的量取决于菌株和培养条件。Camarasa等用粟酒裂殖酵母MAE1基因转化的酿酒酵母菌株的生理特性表明,转运是L-苹果酸利用的限制步骤;苹果酸以单阴离子形式被积极转运,该转运机制是可逆的,其转运效率同时取决于底物的跨膜浓度梯度以及表征质子动力的pH梯度,但与膜电位无关。草酰乙酸、丙二酸、琥珀酸和富马酸能抑制苹果酸的转运,这表示这些有机酸可能共享同一载体。但是值得注意的是,无论是在粟酒裂殖酵母还是酿酒酵母引入MAE1基因的重组菌株中,尽管富马酸酯和α-酮戊二酸酯可以与载体结合,但它们都没有被主动转运到细胞中。