质量安全与营养品质评价岗位
韩富亮 张玉 王强
引言
花色苷(anthocyanins)是一种水果、蔬菜及其相应食品或饮品中广泛分布的水溶性色素。近年来,因其多种生理活性功能逐渐成为食品健康领域一大研究热点。红葡萄酒中含有多种花色苷,科学饮用可对人体健康产生积极的影响。
肠是人体花色苷吸收的重要器官,而己糖转运蛋白是花色苷肠道吸收的重要载体。其中,钠依赖性葡萄糖转运蛋白1(Sodium-dependent glucose transporter 1,SGLT1)是一种主要存在于小肠刷状缘中的己糖转运蛋白,可将胞外的钠离子与葡萄糖同时转运至胞内;葡萄糖转运蛋白2(Glucose transporter 2,GLUT2),可帮助肠细胞内的葡萄糖从基底侧排出进入血液。研究表明,SGLT1和GLUT2均参与了花色苷的肠道转运。
糖尿病是一组以血糖浓度升高为特征的代谢紊乱疾病,相比于一般人群,糖尿病患者具有更高的并发症发病率和死亡率。医学上将糖尿病分为I型、II型两种类型,高达90 %的糖尿病人群为II型糖尿病患者。
通过调节机体葡萄糖稳态,花色苷可帮助改善II型糖尿病。但尽管花色苷通过食用富含花色苷的果蔬、饮品等其摄入量很容易达到200 mg/天,人体对花色苷的生物利用率却相当低(<1%)。本研究通过建立Caco-2细胞吸收模型,模拟人体空肠环境,考察花色苷浓度、结构、预处理等因素对其吸收的影响,旨在阐明小肠中可能涉及的花色苷吸收机制,为研究花色苷潜在的抗糖尿病机制提供理论依据。
1 材料与方法
1.1 实验材料
RPMI 1640培养基、DMEM培养基、二肽谷氨酰胺替代物、非必需氨基酸、胰蛋白酶购自赛默飞世尔科技有限公司;胎牛血清购自美国Gemini公司;青霉素-链霉素混合液)、Hank’s平衡盐溶液(HBSS)购自北京索莱宝科技有限公司;碱性磷酸酶试剂盒购自南京建成生物工程研究所。
二甲花翠素-3-O-葡萄糖苷标准品(纯度≥95 %)、二甲花翠素-3,5-O-双葡萄糖苷标准品(纯度≥95 %)、Caco-2人结直肠腺癌细胞均购自Sigma-Aldrich(上海)贸易有限公司。
葡萄酒样品:试验酒样为新疆产区的赤霞珠红葡萄酒(2017年)和江西产区的刺葡萄酒(2017年)。
1.2 实验方法
1.2.1 Caco-2细胞吸收模型转运花色苷标准品
配制仅含二甲花翠素-3-O-葡萄糖苷的单糖苷标准品溶液、仅含二甲花翠素-3,5-O-双葡萄糖苷的双糖苷标准品溶液和分别两种标准品的混合溶液,设置120 μM、60 μM两种浓度梯度,0.22 μm无菌滤头过滤除菌备用。
随机取正常的Transwell小室4孔,上室添加0.5 mL花色苷标准品溶液,下室添加无菌HBSS 1.5 mL,37 ℃、二氧化碳浓度5 %、湿度90 %条件下转运4 h。分别于0.5 h、1 h、2 h、4 h从下室取样0.15 mL,样品-20 ℃冷冻保存至HPLC分析。
1.2.2 Caco-2细胞吸收模型转运样品
1.2.2.1葡萄酒样品毒理学试验
赤霞珠红葡萄酒冷冻干燥制成干粉后冷冻保存。以1倍、2倍、4倍、5倍、8倍、10倍于原体积的HBSS溶解酒样干粉制成葡萄酒溶液,过滤除菌备用。
选择处于对数生长期状态良好的Caco-2细胞,以1.6×106个/cm2每孔0.1 mL接种于96孔板,37 ℃、二氧化碳浓度5 %、湿度90 %条件下培养72 h。添加0.1 mL不同浓度梯度的葡萄酒溶液,对照孔添加等体积HBSS。培养箱中孵育4 h后,各试验孔添加CCK-8试剂10 μL,继续孵育3 h。酶标仪检测450 nm波长下各孔吸光值,使用下方公式计算细胞存活率:
细胞存活率(%)= (OD试验-OD空白)/(OD对照-OD空白 )×100 %
1.2.2.2 葡萄酒样品的转运
赤霞珠葡萄酒样品设置分别含有原酒花色苷100 %、50 %、20 %质量分数的高、中、低3个浓度梯度,刺葡萄酒样品设置高、低2种浓度梯度。取生长状态良好的Transwell小室,以二甲花翠素-3-O-葡萄糖苷溶液对Caco-2细胞单层分别预处理1 d、3 d、7 d,分别转运赤霞珠葡萄酒和刺葡萄酒。
1.2.2.3 花色苷的HPLC分析
参考Yang等建立的方法稍作修改,葡萄酒样品经0.22μm过滤进样。样品花色苷检测色谱条件如下:色谱柱Phenomenex C18(250 mm×4.6 mm,4 μm),流速1 mL•min-1,柱温35 ℃,进样量20 μL,检测波长520 nm。以超纯水:乙腈:甲酸=16:2:1(v/v/v)配制流动相A;超纯水:乙腈:甲酸=8:10:1(v/v/v)比例配制流动相B。时间程序:0-45 min,0%-35% B;45-46 min,35%-100% B;46-50 min,100% B;50-51 min,100%-0% B;51-55 min,0% B。
根据实验室前期结合质谱建立的花色苷图谱库中保留时间、最大吸收波长确定花色苷种类,以二甲花翠素-3-O-葡萄糖苷为标准品,对样品中的花色苷定量。
1.2.3 SGLT1和GLUT2基因表达和蛋白表达水平测定
1.2.3.1 基因表达水平测定
基因表达水平的测定参考Huang等稍作修改。提取细胞中的RNA,检测浓度与纯度,调整至终浓度200 mg•L-1,进行反转录。对反转录产物进行PCR扩增,程序为:95℃ 30 s;95℃ 10 s,60℃ 30 s,循环(40次);95℃ 30 s,60℃ 90 s,95℃ 30 s。最后一步是溶解曲线的程序。β-Actin为内参基因。采用2-ΔΔCT法对检测结果进行判读。
1.2.3.2 蛋白表达水平测定
蛋白表达水平的测定参考Wong等稍作修改。细胞裂解后提取蛋白定量,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,样品调整浓度在聚丙烯酰胺凝胶中先进行稳流,后进行稳压电泳。凝胶中的蛋白质湿转到硝酸纤维素膜,分别与一抗、HRP标记的二抗孵育,杂交完成后使用HRP-ECL发光法对其鉴定,化学发光成像仪显示结果并分析。
1.2.4 数据处理
采用软件SPSS 21.0中单因素方差分析的Duncan法对试验数据进行显著性差异分析(P<0.05),软件Origin Pro 9.1绘制各类直方图与折线图。
2 结果与讨论
2.1高效液相色谱分析葡萄酒中花色苷种类和含量
葡萄酒花色苷HPLC分析表明,赤霞珠葡萄酒中主要含有9种花色苷(表1),包括5种基本花色苷和4种酰化花色苷。基本花色苷(按出峰顺序排列)为:花翠素-3-葡萄糖苷(delphinidin-3-gliucoside,Dp-3-O-Glu)、花青素-3-葡萄糖苷(cyanidin-3-glucoside,Cy-3-O-Glu)、甲基花翠素-3-葡萄糖苷(petunidin-3-glucoside,Pt 3-O-Glu)、甲基花青素-3-葡萄糖苷(peonidin-3-glucoside,Pn 3-O-Glu)、二甲花翠素-3-葡萄糖苷(malvidin- 3-glucoside,Mv-3-O-Glu)。酰化花色苷为:甲基花青素-3-O-(6-O-乙酰化)-葡萄糖苷(peonidin-3-O-(6-O-acetyl)-glucoside,Pn-3-acetylglc)、二甲花翠素-3-O-(6-O-乙酰化)-葡萄糖苷(malvidin-3-O-(6-O-acetyl)-glucoside,Mv-3-acetylglc)、甲基花青素-3-O-(6-O-反式-对香豆酰化)-葡萄糖苷(trans-peonidin 3-O-(6-O-p-coumaryl)-glucoside,trans-Pn-3-coumglc)、二甲花翠素-3-O-(6-O-反式-对香豆酰化)-葡萄糖苷(trans-malvidin 3-O-(6-O- p-coumaryl)-glucoside,trans-Mv-3-coumglc)。其中,Mv-3-glc含量最高、Mv-3-acetylglc次之,他们是基本花色苷与酰化花色苷中含量最高的花色苷,分别占总花色苷质量分数的51.12 %、15.78 %。含量最低的基本花色苷与酰化花色苷分别为Cy-3-glc和trans-Pn-3-coumglc,占总花色苷质量分数不足1 %。刺葡萄酒中花色苷及其含量分析见表2。按出峰顺序依次为花翠素-3,5-O-双葡萄糖苷(Delphinidin-3,5-O-diglucoside,Dp-3,5-diglc)、3’-甲花翠素-3,5-O-双葡萄糖苷(Petunidin-3,5-O-diglucoside,Pt-3,5-diglc)、甲基花青素-3,5-O-双葡萄糖苷(Peonidin-3,5-O-diglucoside,Pn-3,5-diglc)、二甲花翠素-3,5-O-双葡萄糖苷(Malvidin-3,5-O-diglucoside,Mv-3,5-diglc)、甲基花青素-3-O-(6-O-乙酰基)-5-O-双葡萄糖苷(Peonidin-3-O-(6-O-acetyl)-glucoside-5-O-glucoside,Pn-3-acetylglc-5-glc)、二甲花翠素-3-O-(6-O-乙酰基)-5-O-双葡萄糖苷(Malvidin-3-O-(6-O-acetyl)-glucoside-5-O-glucoside,Mv-3-acetylglc-5-glc)、花翠素-3-O-(6-O-反式-对香豆酰基)-5-O-双葡萄糖苷(Delphinidin-3-O-(6-O-trans-p-coumaryl)-glucoside-5-O-glucoside,trans-Dp-3-coumglc-5-glc)、花翠素-3-O-(6-O-反式-对香豆酰基)-5-O-双葡萄糖苷(Delphinidin-3-O-(6-O-trans-p-coumaryl)-glucoside-5-O-glucoside,trans-Dp-3-coumglc-5-glc)、二甲花翠素-3-O-(6-O-反式-对香豆酰基)-5-O-双葡萄糖苷(Malvidin-3-O-(6-O-trans-p-coumaryl)-glucoside-5-O-glucoside,trans-Mv-3-coumglc-5-glc)。其中,含量最高的是Mv-3,5-diglc,trans-Mv-3-coumglc-5-glc次之,分别是基本花色苷与酰化花色苷中含量最高的花色苷,占总花色苷质量分数的47.88 %、36.55 %。

2.2 红葡萄酒样品对Caco-2细胞活性的影响
经不同浓度梯度的红葡萄酒样品处理4 h后,样品孔校准吸光值及对应细胞存活率如表3。葡萄酒样品对Caco-2细胞存在一定致死作用,但随着稀释倍数的增加,该影响逐渐减弱,当稀释倍数达到10倍时,葡萄酒溶液对细胞活性没有显著影响。因此选择稀释1倍、2倍、5倍的葡萄酒溶液(分别含有原酒花色苷浓度100 %、50 %、20 %)进行转运试验。
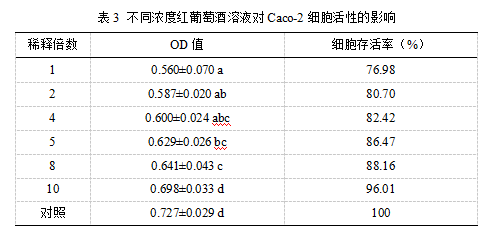
2.3 红葡萄酒花色苷在细胞模型中的转运
细胞单层接触赤霞珠葡萄酒样品2 h后,即可在下室(BL侧)溶液中检测到被转运的花色苷,多数花色苷在1-2 h内转运速率最大。葡萄酒花色苷的转运具有时间依赖性,随着转运时间的延长,花色苷的转运量和转运率显著提高。
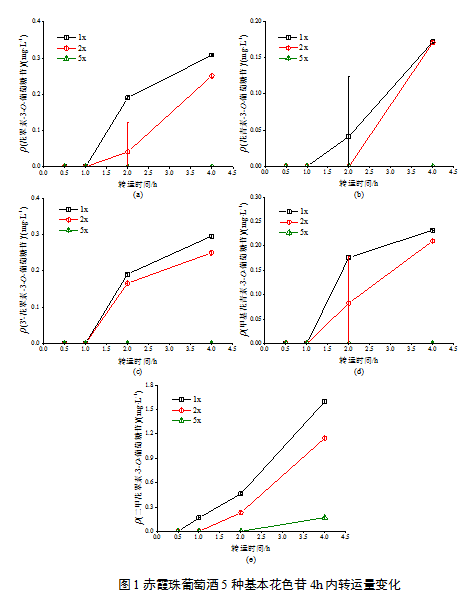
花色苷的转运具有浓度依赖性,初始浓度越高,同一转运时间下室中检测到花色苷的转运量越大(图1、图2)。值得注意的是,葡萄酒花色苷的转运率并不简单因浓度的增大而提高,在转运的第4个小时,除甲基花青素-3-O-(6-O-反式-对香豆酰基)-葡萄糖苷外,稀释2倍的葡萄酒溶液中各花色苷转运率均显著高于原酒浓度样品中各花色苷的转运率(P<0.05),而在转运的第2个小时,后者的转运率显著高于前者。这表明Caco-2细胞对葡萄酒花色苷的转运可能存在适应机制,在转运初期,由于细胞是首次接触到样品中的花色苷,此时花色苷的浓度越高,越容易刺激细胞对其进行转运吸收,但随着转运时间的延长,过高的花色苷浓度可能不利于细胞对其转运吸收。除二甲花翠素-3-O-葡萄糖苷外,葡萄酒花色苷稀释5倍的样品在转运实验中没有检测到花色苷。
注:(a)Dp-3-glc; (b)Cy-3-glc; (c)Pt-3-glc; (d)Pn-3-glc; (e)Mv-3-glc; 1x: 含有原酒花色苷浓度100 %的样品;2x: 含有原酒花色苷浓度50 %的样品;5x: 含有原酒花色苷浓度20 %的样品
注:(a)Pn-3-acetylglc; (b)Mv-3-acetylglc; (c)trans-Pn-3-coumglc; (d)trans-Mv-3-coumglc; 1x: 含有原酒花色苷浓度100 %的样品;2x: 含有原酒花色苷浓度50 %的样品;5x: 含有原酒花色苷浓度20 %的样品
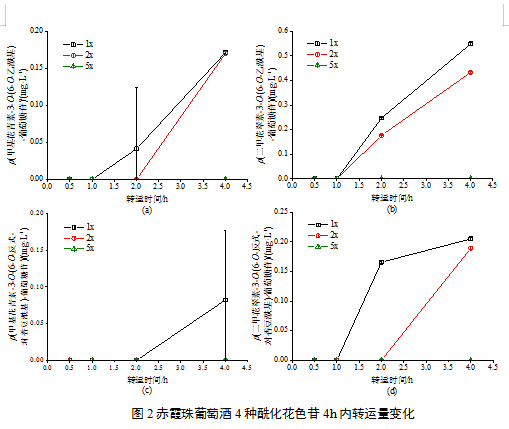
对于刺葡萄酒样品,转运结束时仅在下室溶液中检测到Dp-3,5-diglc、Mv-3,5-diglc、Pn-3-acetylglc-5-glc及trans-Mv-3-coumglc-5-glc 4种花色苷,其转运情况如图3。刺葡萄酒花色苷经1-2 h转运至细胞基底侧,其转运具有时间依赖性,延长转运时间可有效提高花色苷的转运水平。与赤霞珠葡萄酒不同,刺葡萄酒花色苷的转运量受浓度效应影响较小,除Mv-3,5-diglc外,同一转运时间花色苷的转运量间差异不显著。浓度影响刺葡萄酒花色苷的最终转运水平,转运4 h后,低浓度组花色苷转运率均显著高于高浓度组,这与赤霞珠葡萄酒高浓度组花色苷转运率更低的观察结果一致,表明细胞对葡萄酒花色苷的转运可能存在最适浓度,值得进一步研究。
注:(a)Dp-3,5-diglc; (b)Dp-3,5-diglc; (c)Pn-3-acetylglc-5-glc; (d)trans-Mv-3-coumglc-5-glc; 低浓度:含有原酒花色苷浓度50 %的样品;高浓度:含有原酒花色苷浓度100 %的样品
2.4 花色苷对2种转运蛋白mRNA表达水平的影响
2.4.1 葡萄酒花色苷对转运蛋白mRNA表达水平的影响
花色苷预处理细胞可促进转运蛋白mRNA表达(图4a)。赤霞珠葡萄酒样品转运4 h后,在Caco-2细胞中未检测出SGLT1 mRNA的表达,而GLUT2的mRNA相对表达量则显著增加(P<0.05)(图4b)。转运刺葡萄酒后,细胞中2种转运蛋白的mRNA相对表达量均显著增加,且酒样对GLUT2 mRNA的上调作用更强(图4b)。葡萄酒花色苷对转运蛋白 mRNA的表达调控可能与浓度有关,不同稀释倍数的葡萄酒转运后,同种转运蛋白 mRNA的相对表达量间具有显著差异。
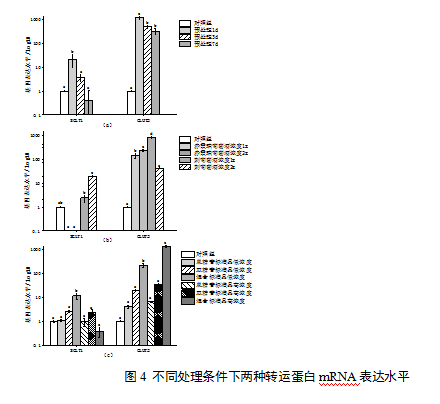
注:(a)花色苷预处理对基因表达水平的影响; (b)转运葡萄酒样品对基因表达水平的影响; (c) 转运花色苷标准品对基因表达水平的影响; 1x:含有原酒花色苷浓度100 %的样品;2x:含有原酒花色苷浓度50 %的样品;低浓度: 60μM;高浓度:120μM
2.4.2 花色苷标准品对转运蛋白mRNA表达水平的影响
转运不同花色苷标准品后,Caco-2细胞中SGLT1、GLUT2的mRNA相对表达水平如图4。由图4可知,Mv-3-glc纯品的转运,对细胞内SGLT1 mRNA的相对表达水平没有显著影响,而转运Mv-3,5-diglc纯品后,SGLT1的mRNA相对表达量有所增加。对于二者的混合样品,低浓度组显著上调SGLT1 mRNA的表达,但高浓度组却使其相对表达量降低。
不同于SGLT1,所有花色苷标准品处理组内,细胞GLUT2 mRNA的相对表达量均有增加,在相同摩尔浓度下,不同样品间GLUT2 mRNA的相对表达量由高到低排序为:混合标准品(Mv-3-glc、Mv-3,5-diglc)、双糖苷标准品(Mv-3,5-diglc)、单糖苷标准品(Mv-3-glc)。
2.5 花色苷对2种转运蛋白表达水平的影响
2.5.1 葡萄酒花色苷对转运蛋白表达水平的影响
Mv-3-glc预处理对转运蛋白SGLT1的表达有上调作用,随着预处理时间延长,此作用有减弱趋势,但不同处理间差异不显著。对于转运蛋白GLUT2,花色苷预处理对其表达发挥下调作用,且该影响随预处理时间的增加而增强(图5a)。SGLT1的相对表达量在转运葡萄酒样后均有减少,赤霞珠和刺葡萄酒对SGLT1的表达水平没有显著影响(图5b)。赤霞珠葡萄酒样对GLUT2的表达水平也没有显著影响,但转运低浓度刺葡萄酒的细胞样品中GLUT2的表达显著上调,比其他处理下相对表达量提高了的1.5倍。
2.5.2 花色苷标准品对转运蛋白表达水平的影响
使用二甲花翠素-3-O-葡萄糖苷进行转运时,花色苷浓度升高,SGLT1的相对表达量有所降低,但高、低浓度作用下SGLT1的相对表达量间差异不显著,但都显著高于对照和双糖花色苷,而双糖花色苷高低浓度下的作用也不显著;单双糖花色苷混合物高浓度的作用显著(图5c)。细胞中GLUT2的表达水平也显著受到二甲花翠素-3-O-葡萄糖苷的正向调控,但区别于SGLT1,GLUT2的相对表达量随二甲花翠素-3-O-葡萄糖苷浓度的增加而提高。双糖花色苷和单双糖花色苷混合物对GLUT2的调节作用也不显著(图5c)。
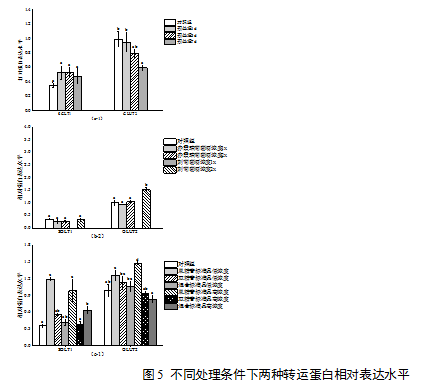
注:(a)花色苷预处理对蛋白表达水平的影响; (b)转运葡萄酒样品对蛋白表达水平的影响; (c) 转运花色苷标准品对蛋白表达水平的影响; 1x:含有原酒花色苷浓度100 %的样品;2x:含有原酒花色苷浓度50 %的样品;低浓度: 60μM;高浓度:120μM
3 结论
小肠细胞对葡萄酒花色苷的转运转运水平很低,仅为1-5 %。花色苷的转运具有时间依赖性和浓度效应。
葡萄糖转运蛋白SGLT1和GLUT2参与花色苷在小肠的转运吸收,花色苷同时对这2种蛋白及其mRNA的表达产生影响。花色苷对转运蛋白SGLT1和GLUT2的mRNA表达均有调节作用,其中GLUT2 mRNA的相对表达量受花色苷的调控作用更强。花色苷预处理可显著上调GLUT2 mRNA的表达。二甲花翠素-3-O-葡萄糖苷可上调转运蛋白SGLT1和GLUT2的表达,双糖花色苷的调节作用则不显著。
因此,花色苷可能通过葡萄糖转运载体SGLT1和GLUT2影响葡萄糖的吸收,从而达到调节血糖水平的作用,且单糖花色苷的调节作用可能强于双糖花色苷。