制汁葡萄品种改良岗位
苏凯 郭印山 刘镇东 李坤 李成祥 马海峰 郭修武
白腐病是葡萄主要病害之一,是由白腐病原菌引起的,是影响葡萄品质和产量的重要生物因素。关于葡萄白腐病抗性的鉴定及遗传研究,多数研究均认为白腐病抗性遗传是受多基因决定的。而通过具有不同白腐病抗性的品种进行杂交创建遗传群体,开展白腐病抗性的鉴定,对了解葡萄白腐病抗性在后代中的遗特性,筛选和培育具有高白腐病抗性的葡萄品种具有重要的理论和实践意义。因此,本试验以‘着色香’和‘维多利亚’两个亲本品种及其杂交后代群体作为试验材料,进一步开展了葡萄白腐病的抗性鉴定及遗传分析,为深入开展葡萄白腐病抗性相关研究打下了初步基础。
1 材料与方法
1.1 试验材料
根据多年的试验观察,葡萄品种‘着色香’(欧美杂种)和‘维多利亚’(欧亚种)在白腐病抗性方面具有显著的差异。因此,本试验选用‘着色香’和‘维多利亚’两个亲本品种及二者杂交后代177株为试材。供试葡萄植株现均种植于沈阳农业大学葡萄试验基地,常规管理,长势良好。
1.2 试验方法
1.2.1 PDA培养基的配置 本试验采用的白腐病菌培养基为PDA培养基。培养基的配置方法如下:
1)将新鲜马铃薯洗净,然后去皮并切成小块,称取200g放置在含有蒸馏水的锅中进行蒸煮,蒸煮时间为30min;
2)将煮好的溶液进行过滤,过滤时,在杯口放置3-5层厚度的医用纱布,以便更好的滤掉残渣;
3)分别称取20g葡萄糖和18g琼脂,然后融入到过滤后的马铃薯溶液中并定容至1000mL;
4)将定容好的溶液放置在高温灭菌锅中进行灭菌,灭菌时的温度为121℃,灭菌时长为0.5h;
5)在无菌的工作台上,将灭菌后的PDA培养基分装在直径为90mm的无菌塑料培养皿中,待液体凝固后,进行封存,备用。
1.2.2白腐病菌的培养以及悬浮液的配置
本试验采用的白腐病菌株来源于北京市农林科学院植保所,菌株编号为JZB3700001。选取白腐病侵染后的葡萄叶片,并取叶片的发病部位与未发病部位的交叉处用于白腐病菌的活化培养。在放置到PDA培养基之前,首先对选取的交叉部位采用0.1%的升汞进行消毒,然后用无菌水反复冲洗3-4次。将消毒完的葡萄叶片交叉部位放置在PDA培养基上,然后放置在黑暗、28°C、相对湿度90%的培养箱中进行培养,培养时间为3-5d。之后,从病原菌的生长部位选取部分菌组织进行纯化和鉴定。将纯化鉴定完的白腐病菌继续在PDA培养基上进行培养,培养时间为3-5d,长出分生孢子后,使用无菌水进行浸泡清洗,之后将含有分生孢子的溶液转移到烧杯中进行收集,转移过程中,需要采用4-6层厚度的医用纱布对孢子悬浮液进行过滤,以便滤去菌丝残体,获的清液。之后,使用血球计数板对获得的孢子悬浮液进行统计,然后使用无菌水将孢悬液稀释到1×106/mL备用。需要注意的是,孢子悬浮液配置好后,应当马上使用,否则须放置在4℃进行过夜或短时间保存,然后在使用前放置在培养箱中23°C进行孵育。
1.2.3 叶片的采集和白腐病菌的侵染
白腐菌的侵染以及鉴定试验于2017-2018年的7-8月份进行。采用离体叶片法进行白腐菌的接种试验。接种叶片为新梢距顶端第3-4片健康叶片。收集到的葡萄叶片首先用70%的乙醇清洗1min,之后再用10%的次氯酸钠溶液冲洗1min,结束后,用超纯水反复清洗3次。之后,将清洗完的叶片放置在塑料培养皿中,采用5针刺的方式在叶片正面左右两边进行轻微的刺伤,之后在叶片刺伤处滴加10 μL的白腐菌孢子悬浮液进行白腐病的侵染。将滴加了白腐菌孢子悬浮液的叶片用塑料培养皿盖好,之后放入到恒温恒湿培养箱中,培养箱温度为28°C,相对湿度为95%,光照强度为0,叶片的保存时间为3d。3d后,使用YMJ-C智能叶面积测量仪对葡萄叶片上的病斑面积进行测量,每一株单株的病斑面积数据保证在3次生物学重复以上,每次重复3-5片叶。
1.2.4数据的统计及分析
采用EXCEL对数据进行收集整理,统计该群体在不同年份以及不同月份间的亲中值、平均值、超高亲率、超低亲率、以及变异系数。使用SPSS19.0软件,采用Shapiro-Wilk对表型数据的正态性分布进行检验。
2 试验结果
2.1亲本白腐病抗性的鉴定
分别选取‘着色香’和‘维多利亚’植株不同枝条上长势一致的成熟葡萄叶片分别在白腐菌侵染后0h、24h、48h和72h观察叶片受侵染状况,使用叶面积测量仪统计葡萄叶片侵染部位病斑大小,并根据病斑大小对不同品种的抗病性进行评估。结果表明,在白腐病菌侵染后24h,‘维多利亚’品种的病斑面积开始显著大于‘着色香’,72h后,两个品种的叶片均不同程度的感染白腐病(图1)。通过对白腐病病斑的测量发现,在侵染后72h,‘维多利亚’叶片病斑面积大小显著高于‘着色香’,分别为1141.86 ± 29.13mm2,和241.88 ± 19.51mm2(图2)。试验结果说明白腐菌对葡萄叶片具有较强的侵染能力,相对于易感病品种‘维多利亚’而言,‘着色香’品种具有较强的抗白腐病能力。
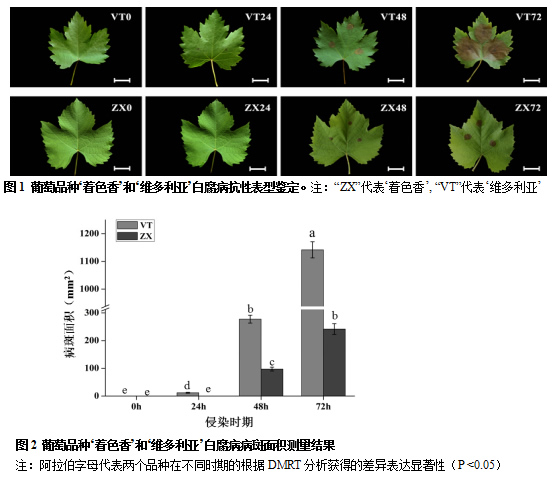
2.2 ‘着色香’和‘维多利亚’杂交后代白腐病抗性鉴定
本试验共有4次重复,分别为2017年的7、8月份和2018年的7、8月份,记作2017-1、2017-2、2018-1和2018-2,病斑面积的值为最少三次重复的平均值。从图3可以看出,‘着色香’和‘维多利亚’杂交后代在白腐病抗性方面出现了广泛的分离。从图4可以看出,‘着色香’和‘维多利亚’杂交后代在白腐病抗性方面表现出了连续变异,是典型的数量性状。通过对后代是否符合正态分布进行Shapiro – Wilk 检验,本试验所获得的表型数据均为非正态分布。

2.3 ‘着色香’和‘维多利亚’杂交后代白腐病抗性遗传分析
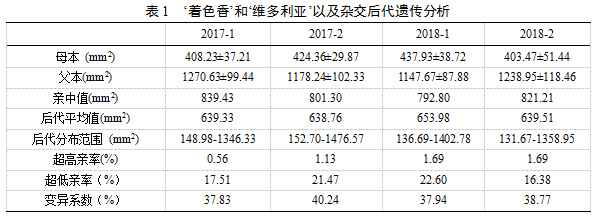
本试验中,2017年7月份鉴定的后代表型数据中,后代白腐病病斑面积的分布范围为148.98 - 1346.33 mm2, 后代平均值为639.33 mm2,通过双亲表型获得的亲中值为839.43 mm2,后代中,超高亲率(后代病斑面积大于易感病亲本)以及超低亲率(后代病斑面积小于抗病亲本)分别为0.56%和17.51%。通过后代表型的标准差以及平均值的比值,该群体在2017年7月份的白腐病病斑面积的变异系数为37.83%;2017年8月份,两个栽培品种的病斑面积亲中值为801.30mm2, 后代病斑面积的平均值638.76 mm2, 病斑面积的分布范围为152.70 - 1476.57 mm2, 超高亲率和超低亲率分别为1.13% 和21.47%,变异系数为40.24%;在2018年7月份的病斑面积统计中,两个栽培品种的亲中值为792.80mm2,后代的平均值和分布范围分别为653.98 mm2和136.69 -1402.78 mm2,后代植株中,超高亲率为1.69%,超低亲率为22.60%,变异系数为37.94%;2018年8月,两个栽培品种的亲中值为821.21mm2,后代的平均值和分布范围分别为639.51mm2和131.67 - 1358.95mm2,后代植株中,超高亲率为1.69%,超低亲率为16.38%,变异系数为38.77%。各重复试验所得的后代平均值低于亲中值,后代的抗病性倾向于母本“着色香”(表1)。
3 小结
本试验选择的亲本材料‘着色香’和‘维多利亚’在白腐病抗性方面具有显著的差异,杂交后代在白腐病抗性方面表现出了连续的变异,进一步证明葡萄白腐病抗性是由多基因控制的数量性状。此外,这两个亲本品种在其它重要的果实性状(单果重、果皮颜色、香气成分以及含量、物候期等)上也有着显著的差异,因此,以这两份试材进行遗传群体的创建,不仅可以为白腐病抗性的遗传特性研究以及QTL定位工作提供重要的试验试材,同时也为其它葡萄果实品质相关的数量性状研究奠定了实践基础。