栽培生理岗位
田淑芬 苏宏 商佳胤 张娜 王丹 王超霞
摘 要:葡萄中白藜芦醇和原花青素是通过苯丙氨酸代谢途径产生的次生代谢产物。虽然白藜芦醇合成机理研究已取得明显进展,但原花青素的生物合成途径中最后一步的聚合反应仍然是不清楚的,需要更进一步深入的研究。本文对葡萄白藜芦醇和原花青素的合成代谢途径、调控机制、影响因素进行详细的总结。
关键词:葡萄;白藜芦醇;原花青素。
1 葡萄白藜芦醇和原花青素的生物合成途径
白藜芦醇(Resveratrol)化学名称为3,4',5-三羟基二苯乙烯,是植物界分布较广的羟基二苯乙烯芪类化合物。白藜芦醇有顺式和反式两种异构体,自然界中以游离态和化合态两种形式存在,化合态以糖苷和低聚物的形式存在,故白藜芦醇一般有4种存在形式:顺、反式白藜芦醇和顺、反式白藜芦醇糖苷。
原花青素又称缩合单宁(condensed tannins, CTs),是一类由不同数量的单体黄烷-3-醇或黄烷-3,4-二醇缩合而成的多酚类物质,在酸性介质中加热,可降解氧化产生红色花青素,故称为原花青素。
葡萄中白藜芦醇和原花青素是通过苯丙氨酸代谢途径产生的次生代谢产物(图1)。苯丙氨酸代谢途径包含原花青素、黄酮醇等多个类黄酮的分支途径,还包含白藜芦醇等非类黄酮代谢。首先通过莽草酸途径合成苯丙氨酸,然后苯丙氨酸在苯丙氨酸裂解酶(phenylalanineammonia-lyase, PAL)催化作用下,裂解为反式-肉桂酸。反式-肉桂酸在肉桂酸-4-羟基化酶(cinnamate4-hydroxylase, C4H)的催化下合成反式-4-香豆酸。4-香豆酸辅酶A连接酶(4-coumarate coenzyme A ligase,4CL)催化反式-4-香豆酸与辅酶A的酯化结合,生成4-香豆酰-CoA,可用于白藜芦醇、类黄酮、木质素等下游分支途径进一步合成各种次生代谢产物。
香豆酰-CoA和丙二酰-CoA在查尔酮合成酶(Chalcone synthase,CHS)催化下,合成中间产物查尔酮,再由查尔酮异构酶(chalconeisomerase, CHI)转变为柚皮素。随后在黄烷酮3-羟化酶(flavanone3-hydroxylase, F3H)和类黄酮3’-羟化酶(flavonoid 3’- hydroxylase,F3’H)的作用下,分别在3和3’位进行羟基化并生成黄烷酮醇。
然后黄烷酮醇在二氢黄酮醇-4-还原酶(dihydroflavonol 4-reductase,DFR)的作用下生成无色花青素,再在花青素合成酶(anthocyanidinsynthase, ANS)或无色花青素双加氧酶(leucoanthocyanidin dioxygenase,LDOX)的催化下形成花青素(Lianget al . 2006),花青素在花青素还原酶(anthocyanidin reductase, ANR)作用下生成表儿茶素。另外,无色花青素还可以在无色花青素还原酶(leucoanthocyanidin reductase,LAR)的作用下生成儿茶素,而儿茶素、表儿茶素等类黄酮途径中的产物又可聚合成原花青素(Proanthocyanidins, 简称 PAs)。葡萄果实中黄烷-3-醇类物质的积累主要是在葡萄进入转色期前,尤其是在葡萄果实发育的早期阶段,而后伴随着葡萄果实的成熟,其呈现下降趋势(严静 2017)。
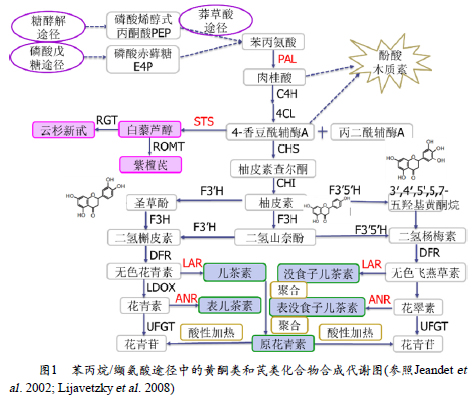
虽然苯丙烷和类黄酮合成机理研究已取得明显进展,但PAs的生物合成途径中最后一步的聚合反应仍然是不清楚的,需要更进一步深入的研究(Dixon et al . 2005)。目前普遍的观点是,儿茶素是PAs合成的起始和延伸单位。儿茶素的合成是在内质网上,而它们聚合形成PAs是在液泡中,其中涉及到转移和聚合的机理(Zhao et al .2010)。在类黄酮转移机理的模式中,可能涉及到转运蛋白MATE(或TT12) (Marinova et al . 2007; Zhao etal . 2011)、谷胱甘肽转移酶(GST或TT19) (Kitamura et al . 2004)以及离子泵(ATPase或AHA10) (Baxter etal . 2005),而糖苷化的黄酮类化合物可能是转移的形式,其中糖苷化黄烷3-醇是转运蛋白MATE的底物(Pang et al . 2008)。
此外,在葡萄中,一分子的反式-4-香豆酰-CoA和三分子的丙二酰-CoA在关键酶芪合酶(stilbenesynthetase, STS)的作用下合成白藜芦醇(Ruppich et al . 1978)。白藜芦醇通过糖基转移酶和甲基转移酶进一步衍生为云杉新甙和紫檀芪。白藜芦醇及其衍生物,属于植物保护素,对植物遭遇逆境(UV、病原菌侵染等)的胁迫有防御作用。
葡萄苯丙氨酸代谢存在STS和CHS两条并行的支路,利用相同底物分别进入白藜芦醇和查尔酮两条不同的代谢途径。因此,葡萄果实中白藜芦醇和原花青素含量在不同生长期和花青素苷含量存在消长关系,白藜芦醇和原花青素含量在着色期后一直下降,伴随着一系列花青苷物质的升高,与果实成熟过程中糖的含量呈负相关(Jeandet et al .1991; Bogs et al . 2005)。正常情况下,苯丙氨酸代谢是沿着CHS途径合成黄酮类和其它酚类物质。一旦植物,苯丙氨酸代谢将启动STS代谢途径并积累芪类化合物,以抵御外界伤害(Adrian et al . 2000;Funget al . 2008;Guerrero et al . 2015;Langcake & Pryce 1976; Schnee et al .2008)。
2 葡萄白藜芦醇和原花青素的转录调控
白藜芦醇与原花青素的代谢受生物胁迫(病虫害相关的)和非生物胁迫(比如光照、温度)等多方面因素调节。这些因素对白藜芦醇和原花青素的影响主要表现为调控代谢终端结构基因的转录或翻译。这些调节作用大多数情况下是间接的,而直接的方式是影响结构基因上游的转录因子的转录或翻译。
2.1 内在调控
调控白藜芦醇和原花青素的转录因子有很多,其中研究最广泛、最清楚的有三类转录因子,分别是MYB、bHLH (basic helix-loophelix)和WD40,三者形成MBW复合体,结合到结构基因启动子的顺式作用元件上,从而影响结构基因的转录。其中MYB决定DNA结合特异性,bHLH可能参与组蛋白修饰和影响DNA结合特异性,而WD40则加强复合体的效果(Hichriet al. 2011)。
2.1.1 MYB类转录因子
MYB转录因子的N端是由1到3个不完美的重复结构域组成(R1、R2和R3),每个结构域长度为52-53个氨基酸,称为SANT结构域。每个SANT结构域由三个螺旋和一个转角组成,三个螺旋按顺序依次称为α1、α2和α3螺旋,其中R2和R3上的两个α3螺旋能够形成折叠,而α1和α2则负责辅助折叠,从而改变蛋白的结构(Jia et al. 2004)。目前植物中发现的促进类黄酮代谢的MYB转录因子多为R2R3-MYB,即缺失了R1的MYB,而抑制类黄酮代谢的MYB转录因子分为R2R3-MYB和R3-MYB两类。就R2R3-MYB而言,其N端的两个SANT结构域折叠后能够识别结构基因启动子的某些顺式作用元件(cis-element),进而调控基因的转录(Naing et al . 2018)。不同种类的R2R3-MYB识别的顺式作用元件不同,因而它们影响的下游基因也不同。R2R3-MYB的C端的序列保守性较差,某些氨基酸组成的基序可能决定MYB促进或抑制转录的能力(Strackeet al . 2001)。目前所有已知的促进原花青素合成的MYB按照序列和功能分为4个组(Liu et al .2014)。这4个组之间在序列和表达甚至是功能上已产生了分歧,显示了植物中原花青素合成调控网络的复杂性。
葡萄中已知有5 个MYB转录因子调控原花青素合成,分别是VvMYBPA1 (Bogs et al . 2007)、VvMYBPA2 (Terrier et al . 2009)、VvMYB5a (Deluc et al . 2006)、VvMYB5b (Deluc et al . 2008)和VvMYC1 (Malacarne et al . 2018)。这5个MYB分属于3个不同的组,这3个组之间序列并不保守,特别是在C端没有共同基序。参与组成MBW复合体的MYB转录因子呈多样性。在葡萄种子中原花青素合成调控复合体MBW使用的MYB转录因子是VvMYBPA1 (Bogs etal . 2007),而在外果皮和叶片中是VvMYBPA2 (Terrier et al . 2009)。
转录因子MYB14和MYB15参与白藜芦醇合成酶STS基因的激活,从而调控白藜芦醇的积累(Höll et al . 2013; Wong et al . 2016)。Al3+和UV-C也正是通过激活转录因子MYB14来诱导白藜芦醇的合成(Duan et al . 2015; Bai et al . 2018)。
植物体内既存在MYB正调控因子,也存在MYB负调控因子即MYB抑制子,比如VvMYB4-like(Pérez-Díaz et al . 2016)。然而MYB抑制子不像MYB正调控因子那样保守地调控某一个特定的代谢途径。
葡萄中的VvMYBC2-L2是一个核蛋白,在根、花和种子中高表达,但在果实发育过程中低表达,研究发现VvMYBC2-L1、VvMYBC2-L2、VvMYBC2-L3 VvMYBC2-L4负调控原花青素合成相关基因,抑制原花青素的合成(Huang et al. 2014;Cavallini et al. 2015; Malacarne et al.2018; Zhu et al. 2018)。
2.1.2 bHLH类转录因子
bHLH转录因子也称MYC转录因子,是调控类黄酮代谢的MYBbHLH-WD40复合体中的重要一员。般来说,bHLH转录因子前200个氨基酸负责同MYB转录因子结合,接下来200个氨基酸负责同WD40结合,而且可能还会负责同RNA聚合酶II接触产生转录激活作用,剩下的C端部分负责二聚化,包括形成同源二聚体(比如GL3)或异源二聚体(比如GL3和EGL3) (Toledo-Ortiz 2003; Hichriet al . 2011)。而bHLH的名称的由来正是在其C端存在一个大概60个氨基酸长度的碱性螺旋-环-螺旋(basic Helix-Loop-Helix)结构,其中碱性区域(basic)包含15-17个氨基酸,参与结合DNA(Hichriet al . 2011)。bHLH蛋白能够结合一些经典的顺式作用元件, 比如E-box (5’-CANNTG-3’)或G-box (5’-CACGTG-3’) (Li etal . 2006)。根据系统进化树分析,bHLH家族可W分成26个亚组,与类黄酮代谢相关的bHLH成员聚类在IIIf组(Carretero-Paulet etal . 2010)。葡萄中与类黄酮相关的bHLH转录因子有VvMYC1和VvMYCA1 (Hichri et al . 2010)。
2.1.3 WD40类转录因子
WD40也称WDR,是一类在植物中广泛参与细胞分裂、细胞调亡、光信号传导、开花、花器官和分生组织发育等生物学过程的转录因子(Van Nocker and Ludwig2003)。WD40蛋白的特点是WD基序串联重复(4-16次),而WD基序是由40-60个氨基酸组成,且以色氨酸-天门冬氨酸结束。目前认为WD40蛋白不结合DNA,而是同很多蛋白结合从而行使功能(VanNocker and Ludwig 2003)。还有报道称WD40通过组蛋白修饰参与染色体重塑,从而影响基因的转录(To et al . 2011)。葡萄中WDR1和WDR2是已知参与类黄酮代谢的WD类转录因子(Matus et al. 2010)。
2.1.4 WRKY转录因子
WRKY转录因子也被报道参与调控芪类化合物的合成。VvWRKY8与VvMYB14直接相互作用,抑制STS基因的表达,从而调节白藜芦醇的合成( J ianget al . 2018)。VviWRKY24 增强VviSTS29启动子的活性,调节白藜芦醇的合成(Vannozzi et al . 2018)。VvWRKY26负调控VvUFGT,抑制原花青素的合成(Hichri et al . 2010;Malacarne et al . 2018)。
2.2 外在调控
MBW复合体能够直接调控白藜芦醇和原花青素合成途径的结构基因,从而促进植物合成白藜芦醇和原花青素,因此MBW复合体成员的突变会直接影响白藜芦醇和原花青素的积累。但更多情况下,白藜芦醇和原花青素合成的变化并非是由MBW复合体突变造成的,而是由环境因子、植物激素等因素造成的,这些因素能够造成MBW复合体转录水平或转录后水平的变化,从而影响白藜芦醇和原花青素的合成(Azuma et al . 2018)。
2.2.1 生物胁迫
现已有许多研究集中在葡萄芪类化合物生物合成的调控。葡萄感染了不同的病原菌如白粉病、霜霉病或者灰霉病后,STS基因的表达量和芪类化合物的含量都有所增加(Bezier et al . 2002; Fung et al .2008; Schnee et al . 2008; Wang et al .2018)。在感染病原菌的葡萄叶片中白藜芦醇的含量可达到50-400 毫克/克鲜重(FW) (Langcake and Pryce1976; Poutaraud et al . 2007)。
在葡萄中,相邻的两个芪合成酶基因的编码区域是非常相似的,但它们的启动子区域序列却差别很大。这相邻两个基因的表达模式能引起葡萄细胞表现出显著的差异,说明两个STS基因可能由不同的因子激活从而导致了快速或者延迟响应诱导(Wiese et al . 1994)。
真菌激发子是来源于真菌的一种特定化学信号,主要来源于真菌的菌丝体、菌丝体降解产物、发酵液、发酵代谢产物等,包括多糖、糖蛋白、蛋白质、短肽等成分。在植物与真菌的相互作用中,针具激发子能快速、高度专一和选择性地诱导植物特定基因的表达,进而活化特定次生代谢途径,积累特定的目的次生产物。Dercks等在葡萄霜霉病方面研究了杀菌剂(Fosetyl)对白藜芦醇积累的影响,结果发现接种霜霉菌孢子同时使用Fosetyl-A1比单独使用Fosetyl-A1效果好,可使白藜芦醇含量增加几倍(Derckset al . 1989)。激发子诱导的Ca2+通量在诱导植物次生代谢产物积累的过程中起着重要的作用(Zhao et al .2005)。各种诱导子处理葡萄细胞能够迅速触发Ca2+注入,细胞外介质的氧化爆发和碱化,以及促细胞分裂原活化蛋白激酶的活化。这些前期反应能够诱导防御基因(包括PAL和STS)的表达,进一步致使产生白藜芦醇和ε-葡萄素(Aziz et al.2003; Poinssot et al . 2003)。已经有试验应用药理学方法来研究葡萄防御信号网络,具体是用番茄灰霉病菌毒力因子--多聚半乳糖醛酸酶1(Bc PG1)来诱导葡萄悬浮细胞。BcPG1诱导Ca2+从胞质外进入,从而触发内源性一氧化氮和活性氧的生产。一氧化氮通过促进细胞内储存的Ca2+释放来参与了防御基因(包括PAL和STS)的表达调控。但是,在Bc PG1诱导处理葡萄细胞后,一氧化氮是必要的但不足以激活PAL和STS的表达,在这种情况下就需要第二信使如H2O2来协同一氧化氮作用(Vandelle et al . 2006)。关文强等人(2005)采用真菌激发子对采后葡萄果皮抗性的研究。
2.2.2 非生物胁迫
白藜芦醇和原花青素同样也受到一些非生物胁迫如机械损伤、紫外光照射(Adrian et al. 2000;Douillet-Breuil etal. 1999)、铝离子(Adrian et al. 1996)、茉莉酸甲酯和乙烯(Belhadj et al. 2006; Belhadj etal. 2008a)、缺水干旱(An et al. 2018)的诱导。
白藜芦醇合成酶STS只能感受波长260-270 nm范围内的紫外线,而对波长在300 nm以上的紫外线感受量很小(Langcake et al . 1977)。普通日光中恰恰缺乏300 nm一下的紫外线,因此大田中的葡萄植株虽然暴露在日光中,但因缺少启动诱导型基因表达的合适紫外线而无法大量合成白藜芦醇。余兴等人(2005)对酿酒葡萄果实进行采后UV处理,表明UV能诱导果实中PAL、POD酶的产生,适宜辐射剂量为200s,辐射后30℃下贮存48h,可使白藜芦醇含量提高7倍。葡萄叶片和果实接受紫外线照射后,STS表达值和白藜芦醇的积累量出现连续两个峰(Adrian et al . 1997;Douillet-Breuil et al . 1999; 李晓东 等2007; 王伟 等 2009)。
高温弱光(High TemperatureLow Light, HTLL)不利于很多植物花青苷的积累。葡萄中光照调控花青苷的合成是通过MBW复合体中MYB转录因子VIMYBA1-3完成的(Azuma et al . 2012)。光照的改变对bHLH或WD40的影响较小,而MYB在转录或翻译水平上的变化非常明显。大部分的花色素苷合成相关类黄酮结构基因与光协同调控或受光促进果实的色素形成,这些结构基因编码形成的酶属于光调节酶,都以光敏色素为光受体。温度是另一个影响花青素合成的因素。高温常常抑制花青苷代谢途径结构基因的表达和花青苷的积累(Delaet al . 2003; Mori et al . 2007)。温度对花青苷代谢的影响也是通过调控MBW成员来实现的。葡萄中发现高温处理可以降低VIMYBA1-3,表明温度和光照可能协同调控花青苷的合成(Azuma et al. 2012; Sugiuraet al . 2018)。
茉莉酸(JA)来自氧化亚麻酸的氧脂素相似激素和气体激素乙烯(ET),在防御信号途径参与抵抗病原体,尤其是对腐生寄生病原菌的调节中发挥了关键作用(Thommaet al . 2001)。一些研究表明通过外源茉莉酸甲酯(MeJA)刺激葡萄悬浮细胞能够芪类化合物的产生。而且芪类化合物的生成无论是在转录水平还是蛋白水平上都与PAL和STS的表达量相关(Belhadj et al .2008b; Krisa et al . 1999; Tassoni etal . 2005)。同样也在赤霞珠叶片中进行了MeJA处理后影响防御基因的表达和对病原体抵抗能力的研究。葡萄叶片经过茉莉酸处理后能够增强PAL、STS和编码PR蛋白基因的表达水平,从而来增强对抗白粉病的抗性。PAL和STS的诱导表达能够增加白藜芦醇及其衍生物(糖苷异构体、葡萄素、紫檀芪)的积累,这可以抵抗白粉病的发展(Belhadj et al .2006)。综合以上结果表明依赖茉莉酸信号通路在芪类化合物生物合成途径的调控中能够起到一定作用。Ca2+信号和茉莉酸之间的联系可能涉及早期钙离子调节磷脂酶参与茉莉酸的生物合成途径(Zhao et al . 2005)。
SA能明显诱导葡萄果实PAL、CHS、STS、DFR、LDOX基因的表达,激活PAL和C4H的活性,对葡萄白藜芦醇具有显著的诱导效果。在葡萄幼果期诱导率较高,但诱导时间较短暂。而且不同水杨酸浓度对葡萄果皮中白藜芦醇含量和苯丙氨酸解氨酶活性呈正相关(Wen et al . 2005; 李晓东 等 2007; 高彩琴 等 2014; Lajara et al . 2015; 丁玲 等 2016; Wang et al . 2017)。
ABA作为内源植物激素,参与胁迫响应、调节植物生长发育、种子休眠以及非呼吸跃变型果实的成熟(Barrero et al . 2005; Sirichandraet al . 2009; Wasilewska et al . 2008).ABA被认为是引发葡萄成熟过程开始的主要信号,并调节葡萄果皮中的次生代谢(Wheeler et al . 2009)。
对着色期前的果穗喷施ABA,能够上调表达苯丙烷途径中的VvDFR、VvANS、VvUFGT和VvMybA1等相关基因,促进果实中花青素、单宁、黄酮类物质的积累(Koyamaet al . 2010; Villalobos-González et al .2016)。对转色期的阳光玫瑰喷施ABA和乙烯,增加白藜芦醇和黄酮醇的含量,使果实着色加深、果粒变大,加快果实成熟(Suehiro et al .2019)通过对葡萄叶片进行乙烯处理诱导得到了和抗白粉病基因相似的芪合成酶基因(Belhadj et al.2008a)。外源乙烯处理影响花色苷合成途径上相关基因的表达(Böttcher et al. 2013; El-Kereamy etal . 2003)。
除此之外,一些化学试剂也能影响葡萄酚类物质的合成。使用粘酸(Mucic acid)可诱导白藜芦醇的产生(Fregoni et al . 1997)。在葡萄成熟时,喷施波尔多液和氢氧化铜,通过样品生化分析,浆果防御机能的综合指标提高,这些指标包括过氧化氢、酚、白藜芦醇、花色苷,表明铜有利于激发植物固有防御机能(Aziz et al . 2006)。